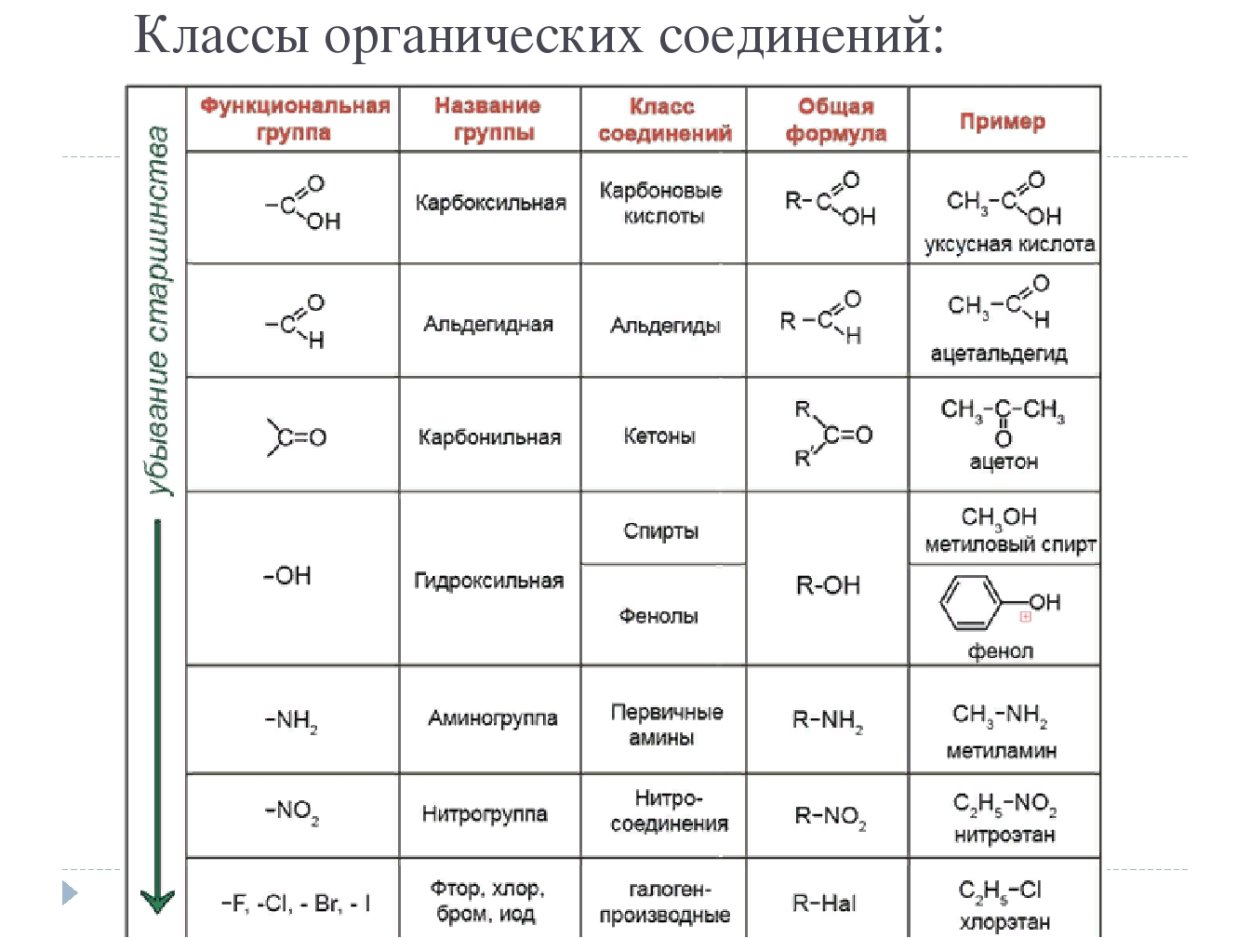
Альдегиды – класс органических соединений, содержащих карбонильную группу (С=О) с одним алкильным или арильным заместителем.
Кетоны – это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Номенклатура и классификация
Систематические названия альдегидов строятся по названию соответствующего углеводорода с добавлением суффикса -аль. Общая формула альдегидов: R–CO–Н.
Систематические названия кетонов строятся по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Общая формула кетонов: R1–CO–R2.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Строение и физические свойства
Свойства альдегидов и кетонов диктуются особенностями строения карбонильной группы >C=O. В карбонильной группе атомы углерода имеют состояние sp2-гибридизации.
При этом углерод sp2-гибридными орбиталями образует три σ-связи (одна из них с кислородом), располагающиеся в одной плоскости под углом около 120° по отношению друг к другу.
π-связь образуется негибридизоваными р-электронами атомов углерода и кислорода [7].

Связь С=О в сильной мере является полярной. Ее дипольный момент (2,6-2,8 D) намного выше, чем у спиртов – 0,70 D. Электроны кратной связи С=О, в особенности π-электроны, смещены к электроотрицательному атому кислорода. Это приводит к образованию частичного отрицательного заряда. Углерод карбонильной группы приобретает при этом частичный положительный заряд:

В молекулах альдегидов и кетонов нет атомов водорода, способных к водородной связи. По этой причине их температуре кипения ниже, чем у аналогичных спиртов.
Метаналь (более распространенное название – формальдегид) – газ, альдегиды С2–C5 и кетоны С3–С4 – жидкости, последующие – кристаллические вещества.
Растворимость низших гомологов достаточно высокая благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. Чем длиннее углеводородный радикал, тем растворимость в воде ниже.
Химические свойства
Реакции присоединения по карбонильной группе. Присоединение большинства реагентов по двойной связи С=О происходит как нуклеофильное присоединение:

При взаимодействии кетонов с аммиаком образуются имины:

Реакции полимеризации. Полимеризация характерна в основном для альдегидов. К примеру, 40 %-ный водный раствор формальдегида (формалина) со временем дает параформ в виде белого осадка. Это полимер формальдегида с невысокой молекулярной массой:
H2C=O + H2O → (OCH2)n-2–O–CH2–OH (n=7, 8)
Реакции конденсации. Конденсация – это реакция, приводящая к возникновению новой углеродной связи и к усложнению углеродного скелета, при этом из двух более простых молекул образуется новая, более сложная.
Обычно в результате реакции конденсации выделяется молекула воды или другого побочного низкомолекулярного продукта.
Наиболее практическое значение имеет реакция фенола с формальдегидом в присутствии кислоты или основания:

Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол.
Реакции восстановления альдегидов и кетонов. Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны – вторичные:

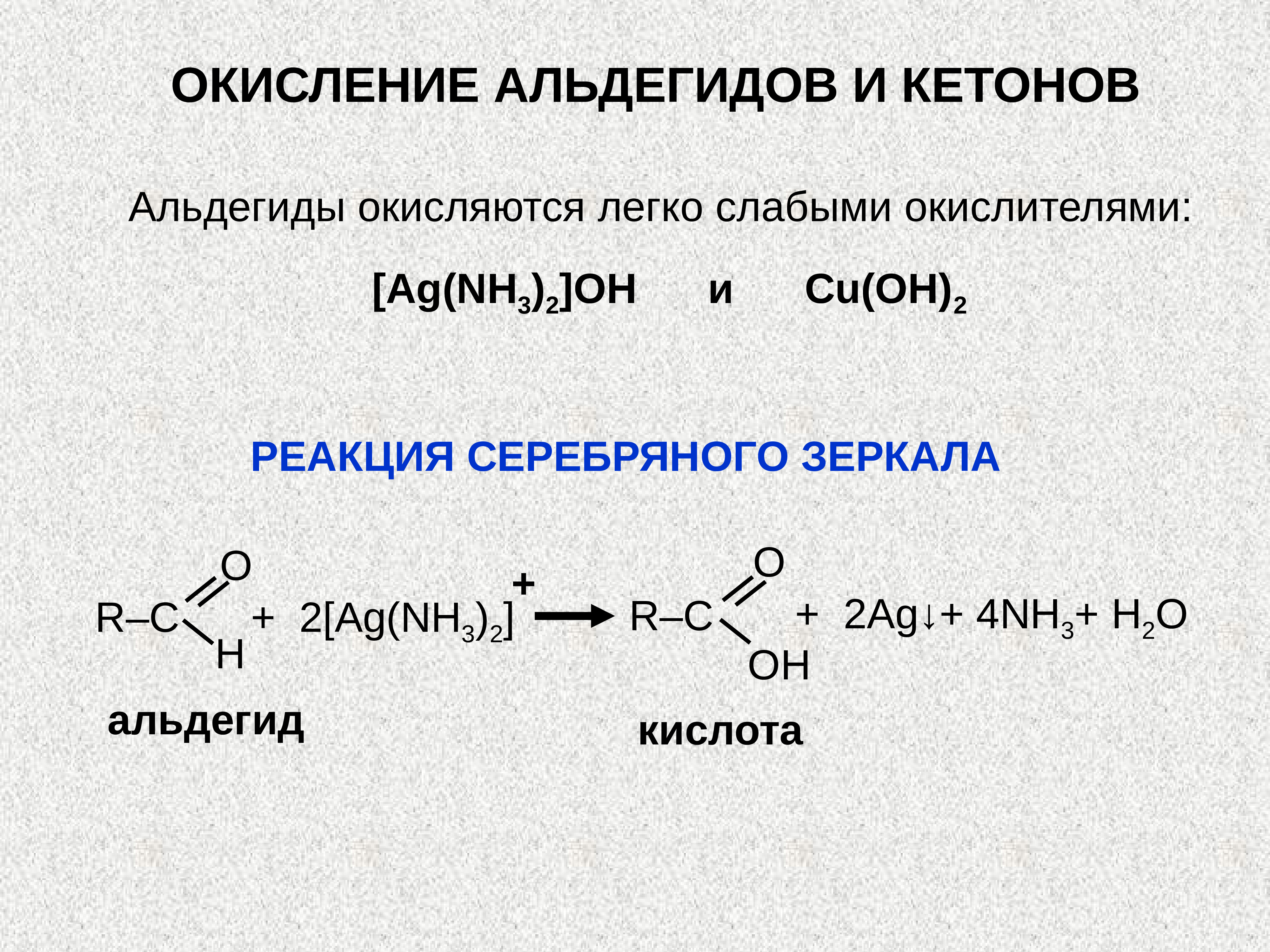
Реакции окисления альдегидов и кетонов. Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием даже таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С–Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(OH)=O.
- Реакция «серебряного зеркала» – окисление аммиачным раствором оксида серебра (реактив Толленса):
- R–CH=O + 2[Ag(NH3)2]OH RCOOH + 2Ag↓ + 4NH3 + H2O.
- Окисление гидроксидом меди (II):
- 1)в виде свежеприготовленного осадка Cu(OH)2 при нагревании;
- 2)в форме комплекса с аммиаком [Cu(NH3)4](OH)2;
- 3)в составе комплекса с солью винной кислоты (реактив Фелинга).
- При этом образуется краснокирпичный осадок оксида меди (I) или металлическая медь (реакция «медного зеркала», более характерная для формальдегида):
- R–CH=О + 2Cu(OH)2 → RCOOH + Cu2O↓ + H2О,
- H2C=О + Cu(OH)2 → HCOOH + Cu↓ + H2О,
- R–CH=O + 2[Cu(NH3)4](OH)2 → RCOOH + Cu2O↓ + 4NH3 + 2H2O,
- R–CH=O + 2Cu(OH)2/соль винной кислоты → RCOOH + Cu2O↓ + 2H2O.
- Кетоны не вступают в эти реакции.
Методы получения
Окисление спиртов. Из первичных спиртов при окислении образуются альдегиды, которые далее могут быть легко окислены до карбоновых кислот:

При окислении вторичных спиртов образуются кетоны:

Гидратация алкинов (реакция Кучерова). Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:

Кетоны получают при гидратации других гомологов ряда алкинов:

Кумольный способ получения ацетона (наряду с фенолом).
Применение
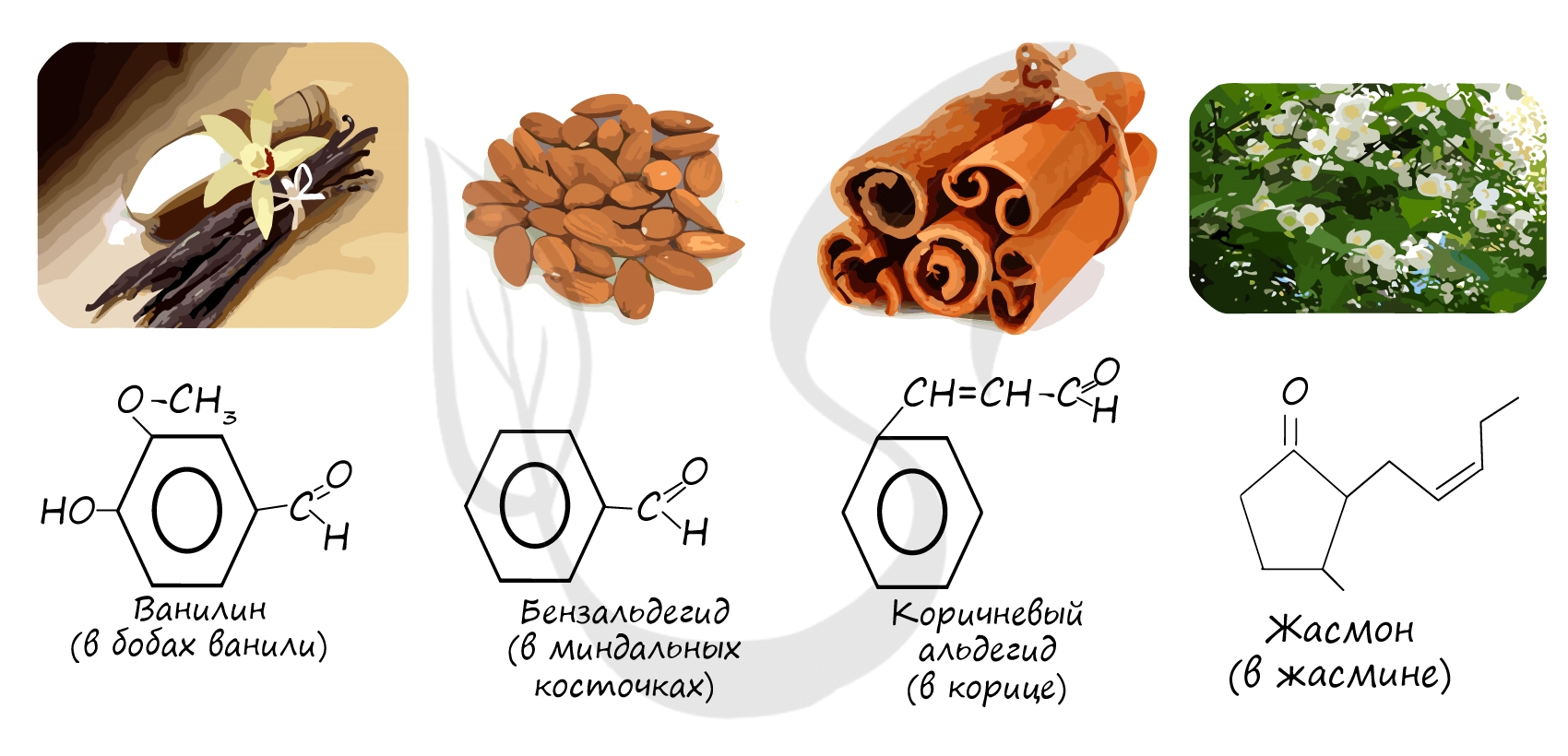
Ацетон – сырьё для синтеза многих важных химических продуктов, растворитель. Ацетон может вызывать значительное понижение уровня кислорода в воде из-за потребления его микроорганизмами. Бензальдегид – для синтеза красителей, душистых веществ, пищевой ароматизатор. Ванилин – ароматизатор.
Диацетил (2,3-бутандион) применяется в пищевой промышленности при формировании запаха масла в производстве маргарина и других жировых пищевых продуктов. Хорошо маскирует синтетические добавки. Дифенилкетон (бензофенон) способен поглощать и отражать УФ-излучение, благодаря чему он может длительное время сохранять вещества от действия света.
Поэтому его используют в качестве фотостабилизатора и фиксатора запаха и добавляют в отдушку для мыла, некоторые духи, косметику для защиты кожи от УФ-излучения, а также в некоторые красители и пигменты для защиты от УФ-излучения [5].
Акролеин является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров. Во время Первой мировой войны использовался в качестве химического оружия.
Источник: http://mmlab5.uginfo.sfedu.ru/tutorial/chapters/chapter7_1.html
Химические свойства
Первая группа свойств — реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи.
В реакциях присоединения пи-связь рвется и образуются две сигма связи — одна с углеродом, вторая — с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде — частичный отрицательный.
Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород — положительно заряженная часть молекулы.
Первое свойство — гидрирование, присоединение водорода.

Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования — никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.

У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство — гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.

Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты, наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая — гидрат формальдегида и уксусного альдегида — возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство — присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство — присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.
Как обычно в реакциях присоединения к карбонильной группе — плюс к минусу, а минус к плюсу.
Пятое свойство — реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа — реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид — это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство — полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
![]()
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство — поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.

В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение — от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств — реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу — окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль — ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу — окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.
Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду.
Так вот это неверно — по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты.
Реакция встречается на егэ очень часто.
Десятая реакция — окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO2, проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция — горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
- Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними.
Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2.
Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n.
Слева атомов кислорода столько же — 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород.
Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения — галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде.
Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом.
Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Источник: https://stepenin.ru/organic/aldehydes/properties
Урок 23. Альдегиды – HIMI4KA
Самоучитель по химии › Органическая химия
Альдегиды — это производные углеводородов, которые содержат альдегидную группу:
Альдегидная группа состоит из карбонильной группы С=О, соединённой с атомом водорода. Карбонильная группа в молекулах альдегидов всегда находится на конце углеродной цепи.
Предельные альдегиды образуют гомологический ряд с общей формулой:

Если использовать эту общую формулу, то следует помнить, что минимальное значение n (числа атомов углерода) равно нулю.
Если n = 0 получаем
метанАЛЬ, муравьиный альдегид, формальдегид;
Если n = 1 получаем

этанАЛЬ, уксусный альдегид, ацетальдегид.
Вопрос. Какой суффикс обозначает наличие в молекуле альдегидной группы?
Названия альдегидов составляют, добавляя суффикс АЛЬ к названию соответствующего углеводорода. При этом учитываются все атомы углерода.
Кроме того, используются тривиальные названия, которые совпадают с названиями соответствующих кислот (см. урок 24.1).
И, наконец, для некоторых альдегидов используют названия, имеющие латинский корень, например формальдегид — от лат. formika — «муравей».
Задание 23.1. Составьте формулу и название альдегида с n = 3. Имеет ли он изомеры?
Начиная с n = 3 у альдегидов появляются изомеры положения карбонильной группы:

Задание 23.2. Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры. Является ли вещество (2) альдегидом?
Но при перемещении карбонильной группы в середину молекулы исчезает альдегидная группа: вещество (2) не альдегид, это — кетон:

По номенклатуре ИЮПАК кетоны называют, добавляя суффикс ОН к названию соответствующего углеводорода.
Задание 23.3. Составьте формулы и названия альдегидов с n = 4. Дайте им названия.
Изомерия альдегидов связана со строением углеводородного радикала:


Строение молекул
Отличительным признаком альдегидов является наличие в их молекуле альдегидной группы. В её состав входят атомы углерода и кислорода, связанные двойной связью.
Вопрос. Какой тип реакций характерен для соединений с двойной связью?
Поэтому альдегиды легко вступают в реакции присоединения по месту разрыва π-связи карбонильной группы.
Кроме того, в состав альдегидной группы входит атом водорода, соединённый с карбонильной группой.
Вопрос. Является ли эта связь полярной?
За счёт разрыва полярной С–Н связи альдегидной группы альдегиды очень легко окисляются. Атом кислорода альдегидной группы делает эту группу в целом сильно полярной. Поэтому альдегидная группа влияет на углеводородный радикал, и в радикале возможны реакции замещения.

Свойства альдегидов
Физические свойства
В альдегидах отсутствует гидроксогруппа, за счёт которой между молекулами спиртов возникали водородные связи.
Вопрос. Какие соединения (спирты или альдегиды) имеют бОльшую температуру кипения?
Поэтому альдегиды, в отличие от спиртов, легче испаряются, имеют меньшие температуры кипения. Например, формальдегид — газ с резким запахом, а метанол — жидкость. Низшие альдегиды могут растворяться в воде.
Раствор формальдегида в воде (формалин) применяется в медицине, кожевенной промышленности. Его применение основано на том, что формальдегид активно реагирует с белками, вызывая в них необратимые изменения (денатурацию).
Следовательно, формальдегид сильно ядовит.
Химические свойства
При рассмотрении строения молекулы альдегидов были сделаны выводы, что для них должны быть характерны реакции присоединения, замещения (в углеводородном радикале), и окисления.
Примером реакции присоединения к карбонильной группе может служить реакция гидрирования, т. е. присоединения водорода:
Вопрос. К какому классу относится полученное соединение? Назовите его.
При окислении альдегидов образуются кислоты:
Окисление альдегидов происходит даже при их хранении, т. е. в обычных условиях. Реакции окисления альдегидов используют для того, чтобы обнаружить их в растворах. Например, если к раствору альдегида добавить аммиачный раствор оксида серебра и нагреть, то на стенках сосуда появится зеркало. Это выделилось чистое серебро, которое блестящим тонким слоем покрыло стекло:
Эта реакция получила название «реакция серебряного зеркала».
Альдегид можно превратить в кислоту (окислить) и при помощи гидроксида меди (II). Если к осадку Сu(ОН)2 добавить раствор альдегида и нагреть, то образуется жёлтый осадок СuОН, переходящий в красный оксид меди (I). В результате образуется оранжевый осадок:
Если эту же смесь долго греть, то на стенках пробирки выделится в виде блестящего слоя чистая медь «медное зеркало». Поэтому эту реакцию часто называют реакцией «медного зеркала».
Запомните: реакции «серебряного зеркала» и «медного зеркала» — качественные реакции на альдегидную группу.
Задание 23.4. Составьте уравнения качественных реакций для формальдегида.
Вопрос. Можно ли при помощи гидроксида меди (II) различить растворы глицерина и уксусного альдегида? Укажите условия и эффекты обеих реакций.
Получение и применение альдегидов на примере уксусного альдегида
Уксусный альдегид получают в больших количествах при помощи реакции Кучерова*:
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик, открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
В небольших количествах этот альдегид можно получить окислением этанола:
Задание 23.5. В уроках 20.3 и 22.4 посмотрите на соответствующие уравнения реакций; обратите внимание, за счёт каких атомов они происходят, и попробуйте составить аналогичные уравнения реакций:
- пропин + вода →
- пропанол-1 + СuО →
- пропанол-2 + СuО →
- Сделайте вывод: всегда ли в этих реакциях получаются альдегиды?
- Если Вы всё сделали правильно, в реакциях 1 и 3 получается ацетон (кетон), а в реакции 2 — пропаналь.
- Уксусный альдегид применяют для получения уксусной кислоты, этилового спирта, лекарств и других веществ.
Выводы
Альдегиды — это производные углеводородов, содержащие альдегидную группу. Для них должны быть характерны реакции
- присоединения (за счёт карбонильной группы);
- замещения (в углеводородном радикале);
- окисления.
Источник: https://himi4ka.ru/samouchitel-po-himii/urok-23-aldegidy.html
Альдегиды и кетоны. Формула, получение, применение :
Среди кислородсодержащих органических соединений огромное значение имеют целых два класса веществ, которые всегда изучают вместе за схожесть в строении и проявляемых свойствах. Это альдегиды и кетоны.
Именно эти молекулы лежат в основе многих химических синтезов, а их строение достаточно интересное, чтобы стать предметом изучения. Рассмотрим подробнее, что же представляют собой эти классы соединений.
Альдегиды и кетоны: общая характеристика
С точки зрения химии, к классу альдегидов следует относить органические молекулы, содержащие кислород в составе функциональной группы -СОН, называемой карбонильной. Общая формула в этом случае будет выглядеть так: R-COH.
По своей природе это могут быть как предельные, так и непредельные соединения. Также среди них встречаются и ароматические представители, наравне с алифатическими.
Количество атомов углерода в радикальной цепи варьируется в достаточно широких пределах, от одного (формальдегид или метаналь) до нескольких десятков.
Кетоны также содержат карбонильную группу -СО, однако соединена она не с катионом водорода, а с другим радикалом, отличным или идентичным тому, что входит в цепь. Общая формула выглядит так: R-CO-R,. Очевидно, что альдегиды и кетоны схожи по наличию функциональной группы такого состава.
Кетоны также могут быть предельными и непредельными, да и проявляемые свойства сходны с близкородственным классом. Можно привести несколько примеров, иллюстрирующих состав молекул и отражающих принятые обозначения формул рассматриваемых веществ.
- Альдегиды: метаналь — НСОН, бутаналь — СН3-СН2-СН2-СОН, фенилуксусный — С6Н5-СН2-СОН.
- Кетоны: ацетон или диметилкетон — СН3-СО-СН3, метилэтилкетон — СН3-СО-С2Н5 и другие.
Очевидно, что название данных соединений образуется двумя путями:
- по рациональной номенклатуре согласно входящим в состав радикалам и классового суффикса -аль (для альдегидов) и -он (для кетонов);
- тривиально, исторически сложившееся.
Если привести общую формулу для обоих классов веществ, то станет видно, что они являются изомерами друг другу: CnH2nO. Для них же самих характерны следующие виды изомерии:
- для кетонов — строение углеводородной цепи радикала и положение группы -СО;
- для альдегидов — только расположение атомов в цепи.
Чтобы различать между собой представителей обоих классов, используют качественные реакции, большинство из которых позволяют выявить именно альдегид. Так как химическая активность данных веществ несколько выше, благодаря наличию катиона водорода.
Строение молекулы
Рассмотрим, как же в пространстве выглядят альдегиды и кетоны. Строение их молекул можно отразить несколькими пунктами.
- Атом углерода, непосредственно входящий в функциональную группу, имеет sp2 — гибридизацию, что позволяет части молекулы иметь плоскую пространственную форму.
- При этом полярность связи С=О сильна. Как более электроотрицательный, кислород забирает себе основную часть плотности, концентрируя на себе частично отрицательный заряд.
- В альдегидах связь О-Н является также сильно поляризованной, что делает атом водорода подвижным.
В результате получается, что подобное строение молекул позволяет рассматриваемым соединениям и окисляться, и восстанавливаться. Формула альдегида и кетона с перераспределенной электронной плотностью позволяет предсказать продукты реакций, в которых участвуют данные вещества.
История открытия и изучения
Как и многие органические соединения, выделить и изучить альдегиды и кетоны людям удалось лишь в XIX веке, когда виталистические взгляды полностью рухнули и стало понятно, что эти соединения могут образовываться синтетическим, искусственным путем, без участия живых существ.
Однако еще в 1661 году Р. Бойль сумел получить ацетон (диметилкетон), когда подвергал нагреванию ацетат кальция. Но подробно изучить это вещество и назвать его, определить систематическое положение среди других, он не смог. Лишь в 1852 году Уильямсон сумел довести это дело до конца, тогда и началась история подробного развития и накопления знаний о карбонильных соединениях.

Физические свойства
Рассмотрим, каковы физические свойства альдегидов и кетонов. Начнем с первых.
- Первый представитель метаналь по агрегатному состоянию — газ, следующие одиннадцать — жидкости, свыше 12 атомов углерода входят в состав твердых альдегидов нормального строения.
- Температура кипения: зависит от числа атомов С, чем их больше, тем она выше. При этом чем более разветвлена цепочка, тем ниже опускается значение температуры.
- Для жидких альдегидов показатели вязкости, плотности, преломления зависят также от числа атомов. Чем их больше, тем они выше.
- Газообразный и жидкие альдегиды растворяются в воде очень хорошо, однако твердые практически не могут этого делать.
- Запах представителей очень приятный, часто это ароматы цветов, духов, фруктов. Лишь те альдегиды, в которых количество атомов углерода равно 1-5, являются сильно и неприятно пахнущими жидкостями.
Если обозначать свойства кетонов, то также можно выделить главные.
- Агрегатные состояния: низшие представители — жидкости, более массивные — твердые соединения.
- Запах резкий, неприятный у всех представителей.
- Растворимость в воде хорошая у низших, в органических растворителях отличная у всех.
- Летучие вещества, данный показатель превышает таковой у кислот, спиртов.
- Температура кипения и плавления зависит от строения молекулы, сильно варьируется от количества атомов углерода в цепи.
Это основные свойства рассматриваемых соединений, которые относятся к группе физических.

Химические свойства
Самое важное, это с чем реагируют альдегиды и кетоны, химические свойства данных соединений. Поэтому их мы рассмотрим обязательно. Сначала разберемся с альдегидами.
- Окисление до соответствующих карбоновых кислот. Общий вид уравнения реакции: R-COH + [O] = R-COOH. Ароматические представители еще легче вступают в подобные взаимодействия, также они способны формировать в результате сложные эфиры, имеющие важное промышленное значение. В качестве окислителей используют: кислород, реактив Толленса, гидроксид меди (II) и другие.
- Альдегиды проявляют себя как сильные восстановители, при этом превращаясь в предельные одноатомные спирты.
- Взаимодействие со спиртами с образованием продуктов ацеталей и полуацеталей.
- Особые реакции — поликонденсации. В результате образуются фенолформальдегидные смолы, имеющие значение для химической промышленности.
- Несколько специфических реакций со следующими реактивами:
- водно-спиртовая щелочь;
- реактив Гриньяра;
- гидросульфиты и прочие.
Качественной реакцией на данный класс веществ является реакция «серебряного зеркала». В результате нее образуется металлическое восстановленное серебро и соответствующая карбоновая кислота. Для нее необходим аммиачный раствор оксида серебра или реактив Толлинса.

Химические свойства кетонов
Спирты, альдегиды, кетоны являются схожими по проявляемым свойствам соединениями, так как все они кислородсодержащие. Однако уже на стадии окисления становится ясно, что спирты — самые активные и легко поддающиеся воздействию соединения. Кетоны же окислить труднее всего.
- Окислительные свойства. В результате образуются вторичные спирты.
- Гидрирование также приводит к упомянутым выше продуктам.
- Кето-енольная таутомерия — особое специфическое свойство кетонов принимать бета-форму.
- Реакции альдольной конденсации с образование бета-кетоспиртов.
- Также кетоны способны взаимодействовать с:
- аммиаком;
- синильной кислотой;
- гидросульфитами;
- гидразином;
- ортокремниевой кислотой.
Очевидно, что реакции таких взаимодействий очень сложны, особенно те, которые являются специфическими. Это все основные особенности, которые проявляют альдегиды и кетоны. Химические свойства лежат в основе многих синтезов важных соединений. Поэтому знать природу молекул и их характер при взаимодействиях крайне необходимо в промышленных процессах.
Реакции присоединения альдегидов и кетонов
Мы уже рассмотрели данные реакции, однако не давали им такого названия. К присоединению можно отнести все взаимодействия, в результате которых активность проявила карбонильная группа. А точнее, подвижный атом водорода. Именно поэтому в данном вопросе преимущество отдается именно альдегидам, вследствие их лучшей реакционноспособности.
С какими веществами возможны реакции альдегидов и кетонов по нуклеофильному замещению? Это:
- Синильная кислота, образуются циангидрины — исходное сырье при синтезе аминокислот.
- Аммиак, амины.
- Спирты.
- Воду.
- Гидросульфат натрия.
- Реактив Гриньяра.
- Тиолы и другие.
Эти реакции имеют важное промышленное значение, поскольку продукты используются в разных областях жизнедеятельности людей.

Способы получения
Существует несколько основных методов, которыми синтезируют альдегиды и кетоны. Получение в лаборатории и промышленности можно выразить в следующих способах.
- Самым распространенным методом, в том числе и в лабораториях, является окисление соответствующих спиртов: первичных до альдегидов, вторичных до представителей кетонов. В качестве окислительного агента могут выступать: хроматы, ионы меди, перманганат калия. Общий вид реакции: R-OH + Cu (KMnO4) = R-COH.
- В промышленности часто используют способ, основанный на окислении алкенов — оксосинтез. Основной агент синтез-газ, смесь СО2 + Н2. Результатом становится альдегид с большим на один углерод числом атомов в цепи. R=R-R + СО2 + Н2 = R-R-R-COH.
- Окисление алкенов озоном — озонолиз. Результат также предполагает альдегид, но кроме этого еще и кетон в смеси. Если продукты мысленно соединить, убрав кислород, станет ясно, какой исходный алкен был взят.
- Реакция Кучерова — гидратация алкинов. Обязательный агент — соли ртути. Один из промышленных способов синтеза альдегидов и кетонов. R≡R-R + Hg2+ + H2O = R-R-COH.
- Гидролиз дигалогенпроизводных углеводородов.
- Восстановление: карбоновых кислот, амидов, нитрилов, хлорангидридов, сложных эфиров. В результате образуется как альдегид, так и кетон.
- Пиролиз смесей карбоновых кислот над катализаторами в виде оксидов металлов. Смесь должна быть парообразной. Суть заключается в отщеплении между молекулами диоксида углерода и воды. В результате образуется альдегид или кетон.
Ароматические альдегиды и кетоны получают иными способами, так как данные соединения имеют ароматический радикал (фенил, например).
- По Фриделю-Крафтсу: в исходных реагентах ароматический углеводород и дигалогензамещенный кетон. Катализатор — ALCL3. В результате образуется ароматический альдегид или кетон. Другое название процесса — ацилирование.
- Окисление толуола действием разных агентов.
- Восстановлением ароматических карбоновых кислот.
Естественно, что в промышленности стараются использовать те методы, в которых исходное сырье как можно более дешевое, а катализаторы менее токсичные. Для синтеза альдегидов — это окисление алкенов кислородом.

Применение в промышленности и значение
Применение альдегидов и кетонов осуществляется в таких отраслях промышленности, как:
- фармацевтика;
- химический синтез;
- медицина;
- парфюмерная область;
- пищевая промышленность;
- лакокрасочное производство;
- синтез пластмасс, тканей и прочее.
Можно обозначить еще не одну область, ведь ежегодно только формальдегида синтезируется приблизительно 6 млн т в год! Его 40% раствор именуется формалином и используется для хранения анатомических объектов. Он же идет на изготовление лекарственных препаратов, антисептиков и полимеров.
Уксусный альдегид, или этаналь, также массово производимый продукт. Количество ежегодного потребления в мире составляет около 4 млн т. Он — основа многих химических синтезов, при которых образуются важные продукты. Например:
- уксусная кислота и ее ангидрид;
- ацетат целлюлозы;
- лекарства;
- бутадиен — основа каучука;
- этиловый спирт;
- ацетатное волокно.
Ароматические альдегиды и кетоны — это составная часть многих ароматизаторов, как пищевых, так и парфюмерных. Большинство из них имеют очень приятные цветочные, цитрусовые, травяные ароматы. Это позволяет изготовлять на их основе:
- освежители воздуха различного рода;
- туалетные и парфюмерные воды;
- различные чистящие и моющие средства.
Некоторые из них являются ароматическими добавками к пище, разрешенными к употреблению. Их природное содержание в эфирных маслах, фруктах и смолах доказывают возможность подобного использования.
Отдельные представители
Такой альдегид, как цитраль, представляет собой жидкость с большой вязкостью и сильным ароматом лимона. В природе содержится как раз в эфирных маслах последнего. Также в составе эвкалипта, сорго, кебаба.
Хорошо известны области его применения:
- педиатрия — понижение внутричерепного давления;
- нормализация артериального давления у взрослых;
- компонент лекарства для органов зрения;
- составная часть многих душистых веществ;
- противовоспалительное средство и антисептик;
- сырье для синтеза ретинола;
- ароматизатор в пищевых целях.
Источник: https://www.syl.ru/article/199335/new_aldegidyi-i-ketonyi-formula-poluchenie-primenenie
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны – это органические соединения, молекулы которых содержат карбонильную группу (оксогруппу) >С=О.
По наличию этой функциональной группы альдегиды и кетоны относят к карбонильным или оксосоединениям.
Альдегиды – органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
Общая формула альдегидов: R–CН=O или (R = H, алкил, арил)
Функциональная группа –СН=О называется альдегидной.
Кетоны – органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Общие формулы: R2C=O, R–CO–R' или (R, R' = алкил, арил) Примеры
| Модели простейших карбонильных соединений | ||
| Название | Формула | Модель |
| Формальдегид(метаналь) | H2C=O | |
| Ацетальдегид(этаналь) | СH3-CH=O | |
| Ацетон(пропанон) | (СH3)2C=O |
|
Для перехода к виртуальной (VRML) модели щелкните на выбранной картинке.
В зависимости от строения углеводородных радикалов карбонильные соединения подразделяются на группы:
- алифатические:
- алициклические (пример
 );
); - ароматические (пример
 ).
).
— предельные (например, CH3–CH=O, CH3CH2CH=O, CH3COCH3), — непредельные (CH3–CH=CH–CH=O, CH2=CH–CO–CH3);
Каждая из этих групп карбонильных соединений в зависимости от состава углеводородного радикала имеет свою общую формулу гомологического ряда.
Например:
- CnH2nO – предельные альдегиды и кетоны (производные алканов); CnH2n-2O – карбонильные производные алкенов (с одной связью С=С) и циклоалканов; CnH2n-8O – ароматические альдегиды и кетоны (карбонильные производные аренов).
Источник: http://orgchem.ru/chem4/o3.php
Альдегиды: их строение, физические и химические свойства
Альдегиды представляют собой органические соединения, в которых углерод имеет двойную связь с кислородом и одинарную с водородом либо атомом, который имеет обозначение R в структурных схемах. Многие из альдегидов обладают приятным запахом, вследствие чего находят активное применение в разных промышленных целях. Получают альдегиды из спиртов путем их дегидрирования. Об их физических и химических свойствах, применении и получении наша сегодняшняя статья.
Химические свойства альдегидов
Практически все альдегиды способны вступать в разнообразные химические реакции, включая полимеризацию. Сочетание их с другими видами молекул ведет к созданию так званных конденсационных полимеров, которые активно используются, например, при производстве пластмассы, в качестве растворителей и парфюмерных ингредиентов.
А некоторые альдегиды даже принимают активное участие в физиологических процессах, так они являются частью:
- витамина А, очень важного для зрения,
- пиридоксальфосфата – одной из форм витамина В6,
- глюкозы и прочих редуцированных сахаров,
- некоторых природных и синтетических гормонов.
Важным отличием альдегидов от тех же углеродов является наличие у них карбонильной группы. Карбонильная группа эта изначально полярна, то есть электроны образующие связь С=О притягиваются больше к кислороду, нежели к углероду. Благодаря этому первый из электронов получает отрицательный заряд, а второй положительный.
Также стоит заметить, что альдегиды имеют более высокий дипольный момент по сравнению с остальными углеводородными соединениями.
Физические свойства альдегидов
Температура кипения альдегидов и их плавления гораздо выше у карбонилсодержащих соединений, нежели у просто состоящих из углерода и водорода. К примеру, бутан и ацетон имея одинаковую молекулярную массу, закипают очень по разному: бутан закипает уже при 0 С, в то время как ацетону для кипения необходимо уже +56 С.
В отличие от углеводородов альдегиды способны растворятся в воде, но не все, а только имеющие менее пяти атомов углерода в молекуле. Но если углеводородная часть их молекул выше этого числа, это делает их нерастворимыми в воде.
Структура альдегидов
Формальгид – простейший альдегид, имеет молекулу, связанную с двумя атомами водорода. У всех других альдегидов молекулы связаны лишь с одним атомом водорода.
Углерод, связанный с карбонильной группой может быть частью алкильных либо неалкильных групп, они в свою очередь могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения, обладающие двумя альдегидными группами называются диальдегидами.

Номенклатура альдегидов
Есть два способа наименования альдегидов. Один из них основан на системе, разработанной Международным союзом теоретической и прикладной химии, его еще называют систематической номенклатурой.
Он предполагает использовать в качестве исходного алкана самую длинную цепь атомов углерода, содержащую карбонильную группу в качестве исходного алкана. Числовое определение исходной карбонильной группы при этом использовать не принято, так как она всегда находится в конце родительской цепи.
Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
Другой метод представляет собой общую номенклатуру. Принцип общей номенклатуры заключается в том, чтобы называть соединения по общему наименованию соответствующей карбоновой кислоты. Иными словами структура та же, что и у альдегида, только вместо CHO появляется COOH, как у уксусной кислоты — CH3COOH или C2H4O2.
Производство альдегидов
Так как альдегиды одни из ключевых строительных блоков органической химии, то не удивительно, что для их получения и производства существует множество разных методов:
- Окисление. Представляет собой один из основных методов для получения альдегидов. Обычно спирты могут быть окислены до состояния альдегидов. Для этого первичный спирт пропускается через горячий катализатор (гидроксид меди) или через аммиачный раствор оксида серебра (так званая реакция серебряного зеркала). Увы, но этот способ не подходит для маленьких лабораторий.
- Гидроформилирование – еще один способ для получения альдегидов, когда алкены обрабатываются монооксидом углерода, водородом и катализатором на основе переходного металла.
- Один из альдегидов (ацетальдегид) может быть получены путем взаимодействия ацетилена с водой.
Для коммерческого получения альдегидов чаще всего применяют гидроформилирование.

Где и как используются альдегиды?
Альдегиды находят многообразное применение в разных сферах человеческой жизни. Сотни их соединений используются химиками для синтеза других веществ. Например, благодаря формальдегиду мы получаем формалин, который в свою очередь активно применяется для дубления, консервации и бальзамирования, а также в качестве фунгицидного и бактериального средства для обработки растений.
Альдегиды, имеющие высокую молекулярную массу (к примеру, бензальдегид и фенилацетальдегид) обладают приятным запахом и поэтому используются в парфюмерии при производстве духов.
Альдегиды, видео
И в завершении образовательное видео по теме нашей статьи.
Источник: https://www.poznavayka.org/himiya/aldegidyi/
Альдегиды

Строение молекул
Для определения химической формулы органического вещества небольшую его массу сжигают, а затем исследуют продукты сгорания.
Так, например, при сжигании 3,75 г формальдегида получили 2,25 г водяного пара и 5,5 г оксида углерода (IV). Установили, что плотность паров формальдегида по водороду 15.
Пользуясь этими данными, находят, сколько граммов углерода и водорода содержится в 3,75 г формальдегида:
M (CO2 ) = 12 + 32 = 44; M = 44 г / моль
44 г CO2 содержит 12 г
5,5 г CO2 » x1
44 ÷ 5,5 = 12 ÷ x1; x1 = (5,5 · 12) / 44 = 1,5; m (C) = 1,5 г
M (H2O) = 2 + 16 = 18; M = 18 г / моль
18 г H2O содержит 2 г
2,25 г H2O » x2
- 18 ÷ 2,25 = 2 ÷ x2; x2 = (2,25 · 2) / 18 = 0,25; m (H) = 0,25 г
- x1 + x2 = 1,5 + 0,25 = 1,75
- Так как для сжигания было взято 3,75 г формальдегида, то можно вычислить массу кислорода:
- 3,75 — 1,75 = 2; m (O) = 2 г
- Определяют простейшую формулу:
C : H : O = (1,5 ÷ 12) : (0,25 ÷ 1) : (2 ÷ 16) = 0,125 : 0, 25 : 0,125 = 1 : 2 : 1 - Следовательно, простейшая формула исследуемого вещества CH2O.
- M = 2D (H2 ) = 2 · 15 = 30; M = 30 г / моль
- Находят молярную массу по простейшей формуле:
- M (CH2O) = 12 + 2 + 16 = 30; M (CH2O) = 30 г / моль
- Следовательно, молекулярная формула формальдегида CH2O
- В молекуле формальдегида между атомами углерода и водорода существуют σ—связь, а между атомами углерода и кислорода — одна σ— и одна π—связь.
Находят общую массу углерода и водорода:
Зная плотность паров формальдегида по водороду, вычисляют его молярную массу:
Изомерия и номенклатура
Для альдегидов характерна изомерия углеводородного радикала. Он может иметь либо неразветвленную, либо разветвленную цепь.
Названия альдегидов происходят от исторических названий соответствующих органических кислот, в которые они превращаются при окислении (муравьиный альдегид, уксусный альдегид, пропионовый альдегид и др.).
По международной номенклатуре названия альдегидов производят от названий соответствующих углеводородов с прибавлением суффикса -аль.
Важнейшие представители альдегидов.
Метаналь, или формальдегид*
Этаналь, или ацетальдегид*
Пропаналь
Бутаналь
2-Метилпропаналь
Пентаналь
Гексаналь

Получение
В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода и другие вещества, способные отдавать кислород. В общем виде это можно показать так:

В промышленности альдегиды получают различными способами. Экономически наиболее выгодно получать метаналь непосредственным окисление метана кислородом воздуха в специальном реакторе.
Чтобы метаналь не успел окислиться, смесь метана с воздухом через зону реакции пропускают с большой скоростью. Метаналь получают также окислением метанола, пропуская его пары вместе с воздухом через реактор с раскаленной медной или серебряной сеткой.
Однако этот способ экономически менее выгоден.
Этаналь можно получить и гидратацией ацетилена в присутствии солей ртути в качестве катализатора (реакция М. Г. Кучерова). Так как в этой реакции в качестве катализатора используют ядовитые вещества — соли ртути, то в последнее время разработан новый метод получения ацетальдегида: смесь этилена с воздухом пропускают через водный раствор солей меди, железа и палладия.
Физические свойства
Метаналь — бесцветный газ с резким запахом. Раствор метаналя в воде (35 — 40%-ный) называется формалином. Остальные члены ряда альдегидов — жидкости, а высшие — твердые.
Химические свойства
Для альдегидов наиболее характерны реакции окисления и присоединения.
1. Реакции окисления
а) Качественной реакцией на альдегиды является реакция «Серебряного зеркала».
Для ее осуществления в чистую пробирку наливают аммиачный раствор оксида серебра (I) (Ag2O в воде практически не растворяется, но с аммиаком образует растворимое соединение [Ag (NH3)2]OH), к нему добавляют раствор альдегида и нагревают.
Восстановленное серебро оседает на стенках пробирки в виде блестящего налета, а альдегид окисляется в соответствующую органическую кислоту.
б) Другой характерной реакцией является окисление альдегидов гидроксидом меди (II).
Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть, то сначала появляется желтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I).
В этой реакции окислителем является медь со степенью окисления +2, которая восстанавливается до степени окисления +1.
2. Реакции присоединения
Реакции присоединения обусловлены наличием в карбонильной группе π—связи, которая легко разрывается. По месту ее разрыва присоединяются атомы и атомные группы. Так, например, при пропускании смеси метаналя с водородом над нагретым катализатором происходит его восстановление в метанол.
Аналогично присоединяют водород и другие альдегиды.
Другие заметки по химии
Источник: http://edu.glavsprav.ru/info/aldegidy/
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
- где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
- Группу –СНО называют альдегидной.
- Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
- где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах.
По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е.
обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
- 4) основными и амфотерными гидроксидами металлов:
- 5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
- Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
- Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
- Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
- Обратный реакции этерификации процесс называют гидролизом сложного эфира:
- Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
- При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
- В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
- Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
- В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
- При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/svojstva-aldegidov-karbonovyh-kislot-jefirov