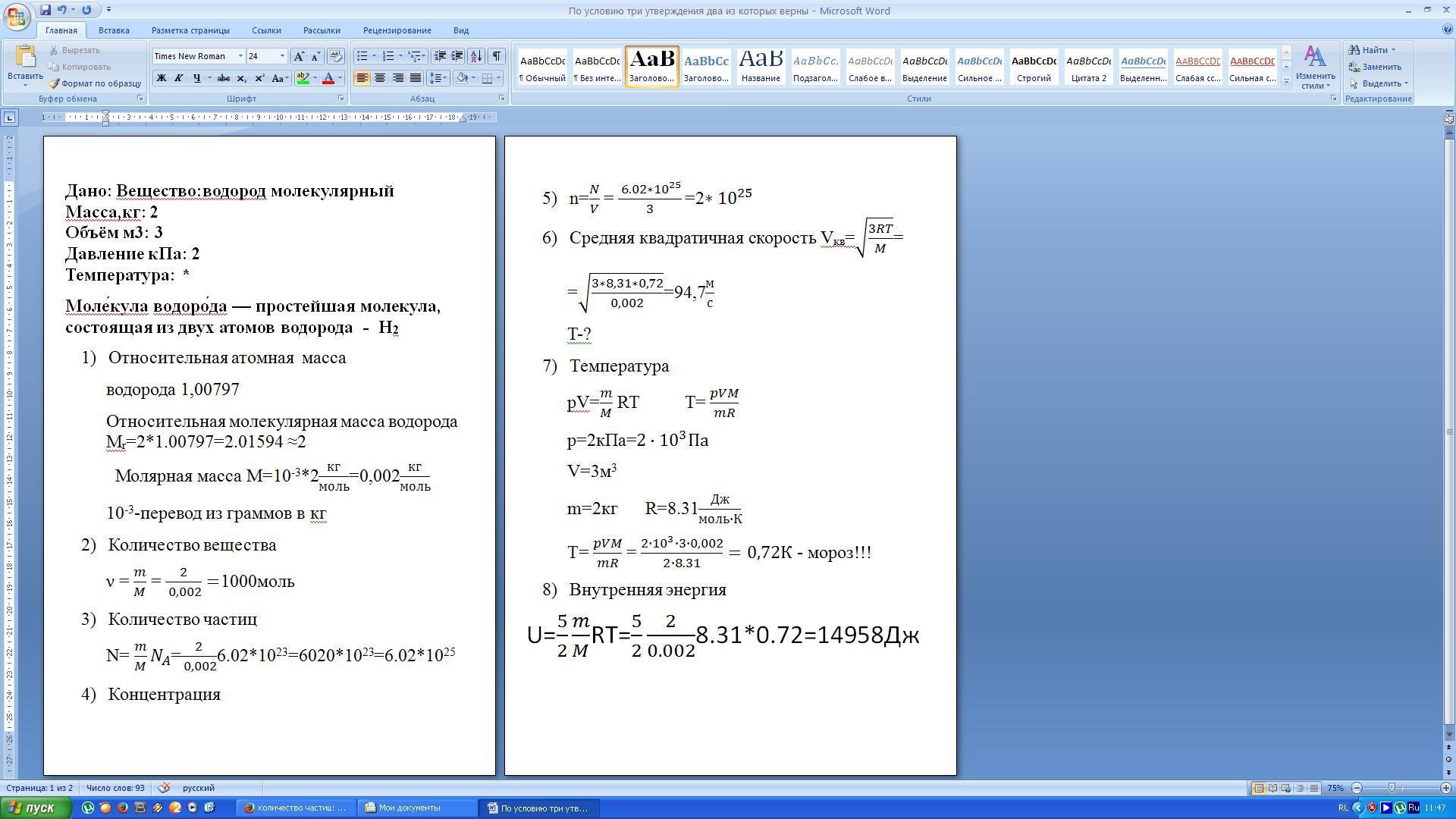
- В приводимой ниже таблице приняты следующие обозначения:
- М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.

* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
- РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
- Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
- Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
- (I)
 (2)
(2) - где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
- Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
 (3)
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
- (4)
 (5)
(5) - где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
- Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
 (6)
(6)- При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
 (7)
(7)- где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
- Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А или А2.
(8)
(9)  (10)
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
 (11)
(11)- Объем воды (в мл) для разбавления: b = V2 — V1
- Смешивание двух растворов различной концентрации
- Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:

- Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
- «Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:

- Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
- К оглавлению
- см. также
ActionTeaser.ru — тизерная реклама
Источник: http://www.himikatus.ru/art/chemop/formulydlyap.php
Конспект урока по химии на тему "Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрация"
Алимова Э.Н.
Химия Дата:04.12.2018г. Урок №19 Класс:11
Тема: Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрация.
Цели:
- Образовательные:
- 1. Закрепить знания о, массовой доли растворенного вещества в растворе.
- 2. Закрепить знания и умения, учащихся при решении задач на проценты, совершенствовать навыки решения текстовых задач с помощью химических формул.
- 3. Сформировать навыки решения расчетных задач с применением молярной концентрации.
- Воспитательная:
- 4. Воспитание мотивации к учению.
- Развивающая:
- 5. Развитие познавательного интереса к урокам химии.
Тип урока: комбинированный урок.
Оборудование: презентация, периодическая система Д.И.Менделеева, карточки с заданиями для учащихся.
- Лабораторное оборудование и вещества: На столах учащихся: мерный цилиндр, лабораторные весы с разновесами, стеклянная палочка, химический стакан, колба с водой,
- пробирка с солью (по вариантам).
- План урока
I.Организация класса к учебной работе.
1. Приветствие.
2. Организационный момент.
3. Создание комфортной доброжелательной обстановки в классе.
- II. Актуализация и фиксирование индивидуальных затруднений в пробном действии
- Организует повторение материала, изученного на предыдущем уроке и основных терминов, и понятий, необходимых для освоения нового материала.
- Проверяется наличие у учеников выполненных письменных работ. Обсуждаются задания, которые вызвали затруднения
- Фронтальная беседа с классом:
- что такое дисперсные системы?
- какими бывают дисперсные системы?
- какими свойствами обладают дисперсные системы?
- значение дисперсных систем.
1.Работа у доски.
Решение задачи на массовую долю растворенного вещества в растворе
Вычислите массу воды, которую нужно добавить к 50 г 20 %-ного раствора соляной кислоты, чтобы уменьшить её концентрацию до 10 %. Ответ укажите в граммах с точностью до целых.
Решение:
Найдем массу кислоты:
![]()

пусть — масса воды, которую нужно добавить, тогда:
![]()
2. Работа с классом.
Учитель раздаёт на каждую парту лист с химическим диктантом /приложение 1/ и даёт такие комментарии:
– Ребята, я предлагаю вам выполнить это задание для того, чтобы вы вспомнили ключевые понятия прошлого урока. Многие характеристики кислорода помогут нам более детально разобраться в теме сегодняшнего урока.(приложение 1)
Далее учитель показывает на слайде “ключ” ответов:
– Я прошу вас продемонстрировать результат выполненной работы; поднимите руку те дети, кто получил положительную оценку. (Если в классе окажутся дети с неудовлетворительной оценкой, учитель предложит им выполнить это задание ещё раз на следующем уроке).
III.Мотивация
На практике часто приходится иметь дело с растворами, имеющими строго заданное содержание в них растворенного вещества.
Во-первых, это приготовление различных лекарственных растворов. Если в аптеке случайно произойдет ошибка с количеством лекарства в его растворе, то последствия могут быть самыми плачевными.
Во-вторых, многие химические реакции проводят в растворах. И здесь ошибки могут приводить к печальным результатам. Например, если фотограф ошибется при растворении проявителя, то фотографии либо не проявятся, либо будут испорчены.
Другой пример: если залить в аккумулятор раствор, в котором содержание серной кислоты будет меньше или больше требуемого, то аккумулятор либо не будет работать, либо выйдет из строя
IV. Объяснение нового материала.
- Учитель: -Тема сегодняшнего урока «Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрация».
- »
- И сегодня вы должны
- • расширить и систематизировать представления о способах выражения
- концентрации растворов;
- • изучить новые способы выражения концентраций растворов;
- • учиться применять полученные теоретические знания при решении задач;
- • развивать интеллектуальные умения и навыки.
- — Концентрация — величина, характеризующая количественный состав раствора.
- Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого
- вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями.
- Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
- — Существуют несколько способов выражения концентраций растворов:
- 1 Массовая доля (весовые проценты, процентная концентрация)
- 2 Объёмная доля
- 3 Молярность (молярная концентрация)
- 4 Мольная доля
- 5 Моляльность (моляльная концентрация)
- 6 Титр раствора
- 7 Нормальность (молярная концентрация эквивалента)
- 8 Растворимость вещества
- — Мы с вами рассмотрим массовую долю растворенного вещества в растворе и молярную концентрацию.
Понятие массовой доли растворенного вещества в растворе вы изучали в курсе химии 8 класса и решали задачи. Вспомните определение массовой доли и формулу ее расчета.
Учащиеся: — Массовая доля растворённого вещества — это отношение массы растворённого вещества к массе раствора.
 (слайд №5)
(слайд №5)
Решим задачу: Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Массовая доля вещества в растворе вычисляется по формуле:

Найдем массу вещества:
![]()
Найдем массу раствора:
![]()
Имеем:

Учитель: — В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра).
Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Часто для выражения концентрации (например, серной кислоты в аккумуляторах) пользуются просто их плотностью.
Распространены ареометры предназначенные для определения концентрации растворов веществ.
— Решим задачу: задача №1 стр. стр.81 учебника Г.Е.Рудзитиса, Ф.Г.Фельдмана «Химия.11 класс. (Задачу у доски решает ученик)

- — Следующий вид выражения концентрации раствора – это молярность или молярная концентрация.
- Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
- C(B) = n(B) / V = m(B) / (M(B) · V),
- где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 M NaOH — двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Молярность чаще выражают в моль/л или ммоль/л. Возможны следующие обозначения молярной концентрации — С, См, М.
Так, раствор с концентрацией 1,0 моль/л называют одномолярным, можно записать – 1М,
0,1 моль/л – децимолярным – 0,1М, 0,01 моль/л – сантимолярным – 0,01М (слайд №7)
— Решим задачу: задача № 4 стр.2 учебника.
Задачи:
Раствор объемом 500 мл содержит NaOH массой 5 г. Определить молярную концентрацию этого раствора.
- Д а н о:
- V(р-ра)=500мл, или 0,5 л
- m(NaOH )=5г;
- ____________________
- Найти: C(NaOH )
- Решение:
- 1. Вычислим число моль в 5 г NaOH :
- ⱱ(NaOH)=m(NaOH)/M(NaOH); ⱱ =5г/40г/моль=0,125 моль
- 2. Определим молярную концентрацию раствора:
- C=ⱱ (NaOH)/V(р-ра);
- C=0,125 моль/0,5=0,25моль/л;
- Ответ:C=0,25моль/л
- Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200 мл, если его молярная концентрация 2 моль/л.
- Д а н о
- V(р-ра)=200мл, или 0,2 л
- C(NaCl )=2 моль/л
- Найти: m(NaCl )
- Решение:
- 1. Вычислим число моль m(NaCl ), которое содержится в растворе объёмом 0,2л:
- C= ⱱ (NaCl)/V(р-ра); ⱱ(NaCl)=С·V(р-ра);
- ⱱ(NaCl)=2моль/л·0,2л=0,4 моль
- 2. Вычислим массу NaCl:
- m(NaCl)=M(NaCl) * ⱱ(NaCl); M(NaCl)=58,5г/моль
- m(NaCl)=58,5г/моль·0,4 моль=23,4г NaCl
- Ответ:m(NaCl)=23,4г
III. Закрепление изученного – выполнение лабораторной работы «Приготовление растворов с заданной молярной концентрацией».
Повторение правил техники безопасности
— А теперь выполним лабораторную работу №1 «Приготовление растворов с заданной молярной концентрацией» стр.82 учебника.
- Для этого решите задачу по вариантам. Задания даны на карточках-инструктажах
- Затем приготовьте раствор заданной концентрацией взвесив рассчитанную массу на весах и отмерьте нужный объем воды мерным цилиндром.
- Вспомним правила работы с лабораторными весами и правила измерения объёма жидкости с помощью измерительного цилиндра.
- Составьте отчет о работе в произвольной форме.
- После выполнения работы сдайте тетради на проверку, уберите свое рабочее место и запишите домашнее задание
Подведение итогов урока. Выставление оценокРефлексия -Что мы узнали сегодня нового? – Что мы научились выполнять? – Какие были затруднения? – Что показалось самым интересным? – Что удивило вас? – Спасибо за сотрудничество!
IV. Домашнее задание: Домашнее задание:
§17 №3,4 стр.81, ответить на тестовые задания стр.81
- Рефлексия ФИО ученика_______________________________________
- -Что мы узнали сегодня нового? ___________________________________
- _______________________________________________________________
- – Что мы научились выполнять?___________________________________
- ______________________________________________________________
- – Какие были затруднения?______________________________________
- ______________________________________________________________
- – Что показалось самым интересным? _____________________________
- _______________________________________________________________
- Приложение 1
Дисперсные системы. Растворы. Процессы происходящие в растворах.
- Вариант 1.
- А1.Чистое (индивидуальное) вещество, в отличие от смеси, — это:
- 1)чугун; 2) пищевая сода; 3) воздух; 4) нефть.
- А2. Дисперсная система, в которой в газовой дисперсионной среде распределены частицы жидкости, — это:
- 1)аэрозоль; 2)пена; 3) эмульсия; 4)золь.
- А3. Суспензия – это дисперсная система, в которой:
-
газообразные частицы распределены в жидкости;
-
газообразные частицы распределены в газе;
-
частицы жидкости распределены в жидкой, не растворяющей ее среде;
-
твердые частицы распределены в жидкости.
А4.Истинным раствором является:
-
речной ил; 2) кровь; 3)соляная кислота; 4) молоко.
А5.Оцените справедливость утверждений.
А. С повышением температуры растворимость всех веществ увеличивается.
Б. Коагуляция коллоидного раствора происходит при добавлении электролита
1) верно только А. 2) верно только Б.
3) верны оба утверждения; 4) оба утверждения неверны.
Дисперсные системы. Растворы. Процессы происходящие в растворах.
- Вариант 2.
- А1.Чистое (индивидуальное) вещество, в отличие от смеси, — это:
- 1)известковая вода; 2) нержавеющая сталь; 3)царская водка; 4)медный купорос.
- А2. Дисперсная система, в которой в жидкой дисперсионной среде распределены частицы жидкости, — это:
- 1)гель; 2) эмульсия; 3) аэрозоль; 4)суспензия.
- А3. Аэрозоль – это дисперсная система, в которой:
- 1) твердые частицы распределены в жидкой дисперсионной среде;
- 2) газообразные частицы распределены в газе;
- 3) твердые и жидкие частицы распределены в газовой среде;
- 4) частицы жидкости распределены в жидкой, не растворяющей ее среде.
- А4.Истинным раствором является:
-
кисель; 2)раствор сульфата меди (II); 3)известковое молоко; 4) молоко.
А5.Оцените справедливость утверждений.
А. С повышением давления растворимость газов увеличивается.
Б. В отличие от истинных растворов коллоидные растворы рассеивают проходящий через них свет
1) верно только А. 2) верно только Б.
3) верны оба утверждения; 4) оба утверждения неверны.
Ответы:
Вариант 1
- 1.2
- 2.1
- 3.4
- 4.3
- 5.2
- Вариант 2
- 1.4
- 2.2
- 3.3
- 4.2
- 5.3
- Приложение 2
- Лабораторная работа № 1
- Приготовление растворов с заданной молярной концентрацией
- Цель работы: научиться готовить раствор с заданной молярной концентрацией, проверить на практике действенность теоретических знаний о способах выражения концентрации веществ в растворе
- Реактивы: хлорид натрия, хлорид кальция, дистиллированная вода.
- Оборудование: весы, мерные колбы.
- Ход работы:
- Задания:
- Рассчитайте массу соли, которую необходимо взять для приготовления:
- Вариант I — 100мл 0,1 М раствора хлорида натрия.
- Вариант II — 100мл 0,2 М раствора хлорида калия.
- Алгоритм приготовления определённого объёма раствора с заданной молярной концентрацией:
-
Рассчитать массу хлорида натрия.
-
Для расчетов использовать формулы:
C = ν / V; ν = C V; m = ν M; m = C V M
-
Взвесить на весах рассчитанную навеску.
-
Перенести навеску соли в мерную колбу.
-
Прилить в колбу немного воды и перемешать стеклянной палочкой до полного растворения соли.
-
Налить в мерную колбу воды до метки.
-
Чтобы не перелить воду, последние капли добавлять с помощью пипетки.
-
Закройте мерную колбу пробкой и несколько раз переверните вверх дном, придерживая пробку пальцем. (Каждый раз, когда раствор в колбе будет принимать нормальное положение, открывайте пробку).
Вывод: Научились ли Вы готовить растворы определенного объема с заданной молярной концентрацией?
Источник: https://infourok.ru/konspekt-uroka-po-himii-na-temu-sposobi-virazheniya-koncentracii-rastvorov-massovaya-dolya-rastvorennogo-veschestva-molyarnaya-k-3636214.html
Концентрация растворов (видео) — Портал аналитической химии
Концентрация — величина, характеризующая количественный состав раствора. Концентрация растворённого вещества это отношение количества растворённого вещества (либо его массы) к объёму раствора.
В тоже время величины, которые являются отношением однотипных величин (соотношение объёма растворённого вещества к объёму раствора, масс растворённого вещества к массе раствора) называют «долями». Однако на практике доли также относят к концентрациям.

- Существует ряд способов для выражения концентрации растворов.
- Массовая доля — соотношение масс растворённого вещества к массе раствора. (в долях единицы или в процентах):
- ,
- где:
- · m — общая масса раствора, г .
- · m1 — масса растворённого вещества, г;
- Массовое процентное содержание компонента, m%
- m%=(mi/Σmi)*100
Объёмная доля — соотношение объёма растворённого вещества к объёму раствора. Объёмная доля определяется в долях единицы или в процентах.
- ,
- где:
- · V — общий объём раствора, л.
- · V1 — объём растворённого вещества, л;
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.

- где:
- · n — число компонентов;
- · νi — количество i-го компонента, моль;
- Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора, единицы измерения (моль/м³),
- ,
- где:
- · V — общий объём раствора, л.
- · ν — количество растворённого вещества, моль;
Нормальная концентрация (или нормальность)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Единицы измерения моль-экв/л.
Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

- где:
- · V — общий объём раствора, л;
- · ν — количество растворённого вещества, моль;
- · z — число эквивалентности (фактор эквивалентности
- ).
- Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество.
- К примеру, одномолярный раствор H2SO4 будет двухнормальным в реакции с образованием K2SO4 и однонормальным если он предназначается для реакции со щёлочью с образованием KHSO4.
Моляльность ( моляльная концентрация)
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Единицы измерения моли на кг.
- ,
- где:
- · m2 — масса растворителя, кг.
- · ν — количество растворённого вещества, моль;
- Титр раствора — масса растворённого вещества в 1 мл раствора.
- ,
- где:
- · V — общий объём раствора, мл;
- · m1 — масса растворённого вещества, г;
Формулы пересчета концентраций
- Из молярности в нормальность:
- ,
- где:
- z — число эквивалентности.
- · M — молярность, моль/л;
- Из массовой доли в молярность:
- ,
- где:
- · M1 — молярная масса растворенного вещества, г/моль.
- · ω — массовая доля растворенного вещества в долях от 1;
- · ρ — плотность раствора, г/л;
- Из массовой доли в титр:
![]()
- где:
- · ω — массовая доля растворенного вещества в долях от 1;
- · ρ — плотность раствора, г/л;
- Из молярности в титр:
![]()
- где:
- · M1 — молярная масса растворенного вещества, г/моль.
- · M — молярность, моль/л;
- Из моляльности в мольную долю:
![]()
- где:
- · mi — моляльность, моль/кг;
- · M2 — молярная масса растворителя, г/моль.
Наиболее распространённые единицы
Из молярности в моляльность:
![]()
- где:
- · M — молярность, моль/л;
- · ρ — плотность раствора, г/мл;
- · M1 — молярная масса растворенного вещества, г/моль.
Источник: http://www.chemical-analysis.ru/video/kontcentratciia-rastvorov-video.html
6.2. Концентрация растворов
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
- Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:

где m (B) и m (A) – масса растворенного вещества B и масса растворителя A.
- Объемная доля растворенного вещества σ (B) выражается в долях единицы или объемных процентах:

где Vi – объем компонента раствора, V (B) – объем растворенного вещества B. Объемные проценты называют градусами*). *) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
- Мольная доля растворенного вещества χ (B) выражается соотношением


Сумма мольных долей k компонентов раствора χi равна единице
К размерным концентрациям относятся следующие концентрации:
- Моляльность растворенного вещества Cm (B) определяется количеством вещества n (B) в 1 кг (1000 г) растворителя, размерность моль/кг.

- Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр: где μ (B) – молярная масса B, V – объем раствора.
- Молярная концентрация эквивалентов вещества B CЭ (B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1: где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
- Титр раствора вещества B (TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
г∙мл–1 или г∙мл–1.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, бензол–толуол, жидкие натрий–калий). Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин).
| Модель 6.2. Растворимость солей |
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором.
В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Источник: https://chemistry.ru/course/content/chapter6/section/paragraph2/theory.html
Нахождение объема раствора серной кислоты через молярную концентрацию
Какой объем 96-процентного раствора серной кислоты (H2SO4) плотностью 1,84 г/мл потребуется для приготовления 3 литров раствора с концентрацией 2 моль/л?
Решение задачи
Найдем сколько серной кислоты (H2SO4) (в г) потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
![]()
- где:
- CM – молярная концентрация раствора;
- n – химическое количество растворенного вещества;
- M – молярная масса растворенного вещества;
- m – масса растворенного вещества;
- V – объем раствора.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
![]()
- Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, получаем:
- m (H2SO4) = 2 моль/л ∙ 98 г/моль ∙ 3 л = 588 (г).
- Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора серной кислоты (H2SO4):

- Получаем:
- m (раствора H2SO4) = 588 г/ 0,96 = 612,5 (г).
- Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
- Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
- Получаем:
- V (раствора H2SO4) = 612,5 г /1,84 г/мл = 332,88 (мл).
- Ответ: объем раствора серной кислоты равен 332,88 мл.
Источник: https://himik.pro/rastvory/nahozhdenie-obema-rastvora-sernoy-kislotyi-cherez-molyarnuyu-kontsentratsiyu
Концентрация растворов
Способы выражения концентрации растворов Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
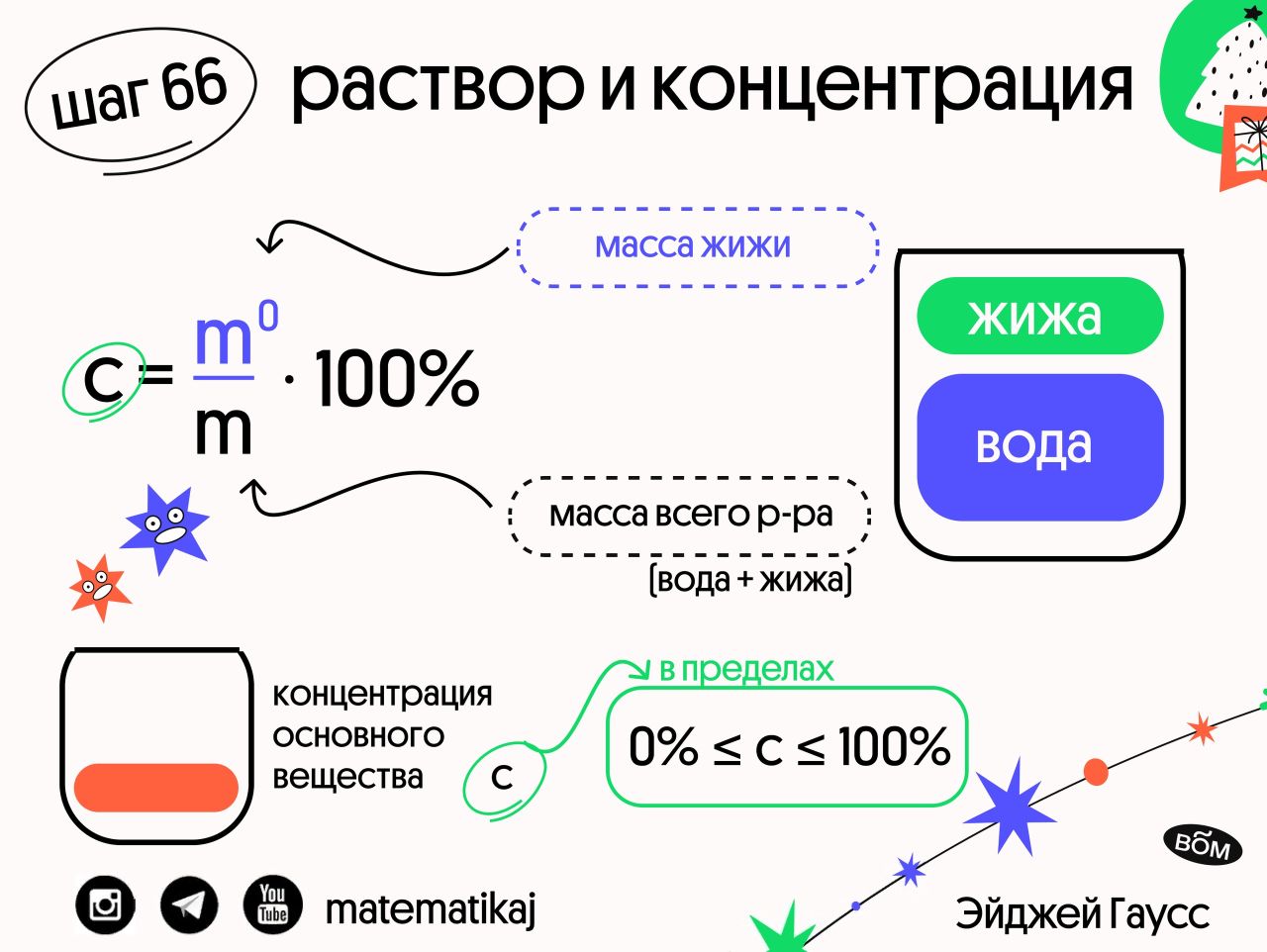
Массовая доля растворённого вещества w(B) — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества — CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г. Пример Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора? Решение
- m(Na2SO4) = w(Na2SO4) / 100 = (5300) / 100 = 15 г
- где w(Na2SO4) — массовая доля в %, m — масса раствора в г
- m(H2O) = 300 г — 15 г = 285 г.
- Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора. C(B) = n(B) / V = m(B) / (M(B)V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 MNaOH — двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример
- Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
- Решение M(K2CrO4) = C(K2CrO4)
- V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра. Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм — эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ — это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд Пример Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г Э Al2(SO4)3 = М Al2(SO4)3 / (23) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4».
Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой.
Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4. Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
- Следовательно, в 1 л раствора содержится 701000 / 61,92 = 1130,49 г H2SO4
- Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
- Пересчет концентраций растворов из одних единиц в другие
- M = (cp 10) / m
- N = (cp 10) / э
- Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную. Пример 1
- Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
- m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
- M = (121,08 10) / 98 = 1,32 M
- б) Нормальная концентрация 12% раствора серной кислоты равна N = (121,08 10) / 49 = 2,64 H.
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с — процентная концентрация; M — молярная концентрация; N — нормальная концентрация; э — эквивалентная масса, r — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими: Решение Мольная масса серной кислоты равна 98. Следовательно, Подставляя необходимые значения в формулы, получим: а) Молярная концентрация 12% раствора серной кислоты равна
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н.
раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
- M = (NЭ) / m
- N = (Mm) / Э
- Пример Нормальная концентрация 1 М раствора серной кислоты N = (198) / 49 = 2 H.
Пример Молярная концентрация 0,5 н. Na2CO3 M = (0,553) / 106 = 0,25 M.Упаривание, разбавление, концентрирование,
смешивание растворов Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1. Упаривание раствора В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2 Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m (где m1 — масса растворенного вещества в исходном растворе) m1 = w1m
w2 = m1 / (m — Dm) = (w1m) / (m — Dm)
Пример Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 — 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,0560) / (60 — 10) = 3 / 50 = 0,06 (или 6%-ный)
- Концентрирование раствора Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы приготовить раствор с массовой долей растворенного вещества w2? Решение
- Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2, (где m1 — масса вещества в исходном растворе). m1 = w1m
- w2 = (m1+x) / (m + x) = (w1m + x) / (m+x)
- Решая полученное уравнение относительно х получаем: w2m + w2 x = w1 m + x
- w2m — w1 m = x — w2 x
- (w2 — w1)
- m = (1 — w2) x
- x = ((w2 — w1)m) / (1 — w2)
- Пример Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным? m = 90 г
- w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 — 0,08) 90) / (1 — 0,1) = (0,02 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов? Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1, в растворе №2 — w2 m2. Масса образовавшегося раствора (№3) — (m1 — m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
- w 1m1 + w 2 m2 = w3 (m1 + m2)
- w1m1 + w 2 m2 = w3 m1 + w3 m2
- w 1m1 — w 3 m1 = w3 m2 — w2 m2
- (w1- w3)m1 = (w3- w2) m2
m1 / m2 = (w3- w2 ) / (w1- w3) Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
| w1 | (w3 — w2) / | m1 |
| w3 | ||
| / w2 | (w1 — w3) | m2 |
m1 / m2 = (w3 — w2) / (w1 — w3) Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 — w3), w1 > w3 и (w3 — w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют. Пример
Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% | 5% / | m1 |
| 10% | ||
| / 5% | 30% | m2=210-m1 |
- 5 / 30 = m1 / (210 — m1) 1/6 = m1 / (210 — m1) 210 — m1 = 6m1 7m1 = 210 m1 =30 г; m2 = 210 — m1 = 210 — 30 = 180 г
- Разбавление раствора Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2): w1 = m1 / (r1V1) откуда V1= m1 /( w1 r1)
- w2 = m2 / (r2V2)
- m2 = w2r2 V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда V1= (w2r2 V2) / (w1 r1)
m2 = w2 • r2 • V2
или
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1 При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу. Пример Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
- m1(раствор) / m2(раствор) = w2 / w1
- 3x = 50
- 30 = 1500
- x = 500 г Последнюю задачу можно также решить, используя «правило креста»:
50 / x = 3 / 30
| 30% | 3% / | 50 |
| 3% | ||
| / 0% | 27% | X |
- 3 / 27 = 50 / x x = 450 г воды
- 450 г + 50 г = 500 г
Источник: https://www.examen.ru/add/manual/school-subjects/natural-sciences/chemistry/obshhaya-ximiya/konczentracziya-rastvorov/
Способы выражения концентраций
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными. Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе).
Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве. Существуют растворы газовые, жидкие и твердые.
Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Существует множество способов измерить количество вещества, находящегося в единице объема или массы раствора, это так называемые способы выражения концентрации раствора. Каждый их методов занимает важное место в количественном и качественном анализе и находит в химии свое применение, поэтому при изучении химии, необходимы знания о том, каким образом можно выразить концентрацию растворов. Итак, приступим к рассмотрению каждого из методов.
Концентрацию раствора можно охарактеризовать как качественную и количественную. Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор. С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
- Наиболее распространенный способ выражения концентрации растворов – молярная концентрация растворов или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V:
См = n/V, моль/л (моль ·л-1 )
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц. Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
- Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили здесь. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях. Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде представляет собой 1/5 (KMnO4).
Введем понятие фактор эквивалентности – число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции. Он может быть равен 1 или быть меньше 1. Фактор эквивалентности для предыдущего примера fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента определяется числом молярных масс эквивалентов на 1 литр раствора. Эквивалент определяется в соответствии с типом рассматриваемой реакции.
Сн = nэ/V, моль/л (моль ·л-1)
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
- Процентная концентрация раствора или массовая доля показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Это отношение массы m (х) вещества x к общей массе m раствора или смеси веществ:
ω (х) = m (х)/m,
Массовую долю выражают в долях от единицы или процентах.
- Моляльная концентрация раствора b (x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m:
b (x) = n(x)/m, моль/кг
- Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора:
Т (х) = m (х)/V, г/мл
- Мольная или молярная доля α (х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α (х) = n(х)/ Σn.
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Источник: http://zadachi-po-khimii.ru/obshaya-himiya/sposoby-vyrazheniya-koncentracij.html




