- Сложные эфиры – функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR) - Сложные эфиры карбоновых кислот – соединения с общей формулой
- R–COOR’, где R и R’ – углеводородные радикалы.
- Физические свойства:
- · Летучие, бесцветные жидкости
- · Плохо растворимы в воде
- · Чаще с приятным запахом
- · Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке спирта и названию группы RCOO— в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.

- Применение
- · В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
- · В производстве пластмасс, резины в качестве пластификаторов.
- Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
- Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+)↔ RCOOH + R’OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
![]()
- Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
- Жиры
- Жиры — сложные эфиры глицерина и высших одноатомных карбоновых кислот .
- Общее название таких соединений — триглицериды или триацилглицерины, где ацил — остаток карбоновой кислоты -C(O)R.
- В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (олеиновой C17H33COOH, линолевой C17H29COOH).
Жиры содержатся во всех растениях и животных. Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение — рыбий жир). Они состоят главным образом из триглицеридов предельных кислот.
Растительные жиры (подсолнечное масло, соевое, хлопковое и др.) – жидкости (исключение — кокосовое масло). В состав этих триглицеридов входят остатки непредельных кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел .
Продукт гидрогенизации масел — твердый жир (искусственное сало, саломас).
Маргарин — пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами. При участии щелочей гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов.
Натриевые соли — твердые мыла, калиевые — жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Природные жиры содержат следующие жирные кислоты
Насыщенные:
|
В СОСТАВЕ ЖИВОТНЫХ ЖИРОВ |
Ненасыщенные:
|
В СОСТАВЕ РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт — глицерин и смесь карбоновых кислот:

или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:

Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:

В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
 Реакция получения жиров (этерификация)
Реакция получения жиров (этерификация)

-
- Производство мыла и косметических изделий
-
- Производство смазочных материалов

Источник: http://www.yoursystemeducation.com/slozhnye-efiry-zhiry/
Сложные эфиры
Сложные эфиры – это функциональные производные карбоновых кислот, в которых гидроксильная группа замещена остатком спирта или фенола.
Так, сложный эфир этилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – этанола. Пропилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – пропанола.
Сложные эфиры содержат сложноэфирную группу. Для сложных эфиров, как и для карбоновых кислот? можно использовать формулу CnH2nO2, которая отражает молекулярный состав.
По правилам номенклатуры ИЮПАК при названии сложных эфиров сначала указывают алкильную группу спирта, а потом кислоту, заменяя суффикс -овая- на суффикс -оат-. Кроме этого, допускаются и названия сложных эфиров, когда сначала называется спирт, затем записывают слово «эфир» и далее название кислоты.
Назовём следующие сложные эфиры. Первый эфир называется пропилэтаноат, или пропиловый эфир уксусной кислоты. Второй эфир называется этилметаноат, или этиловый эфир муравьиной кислоты.

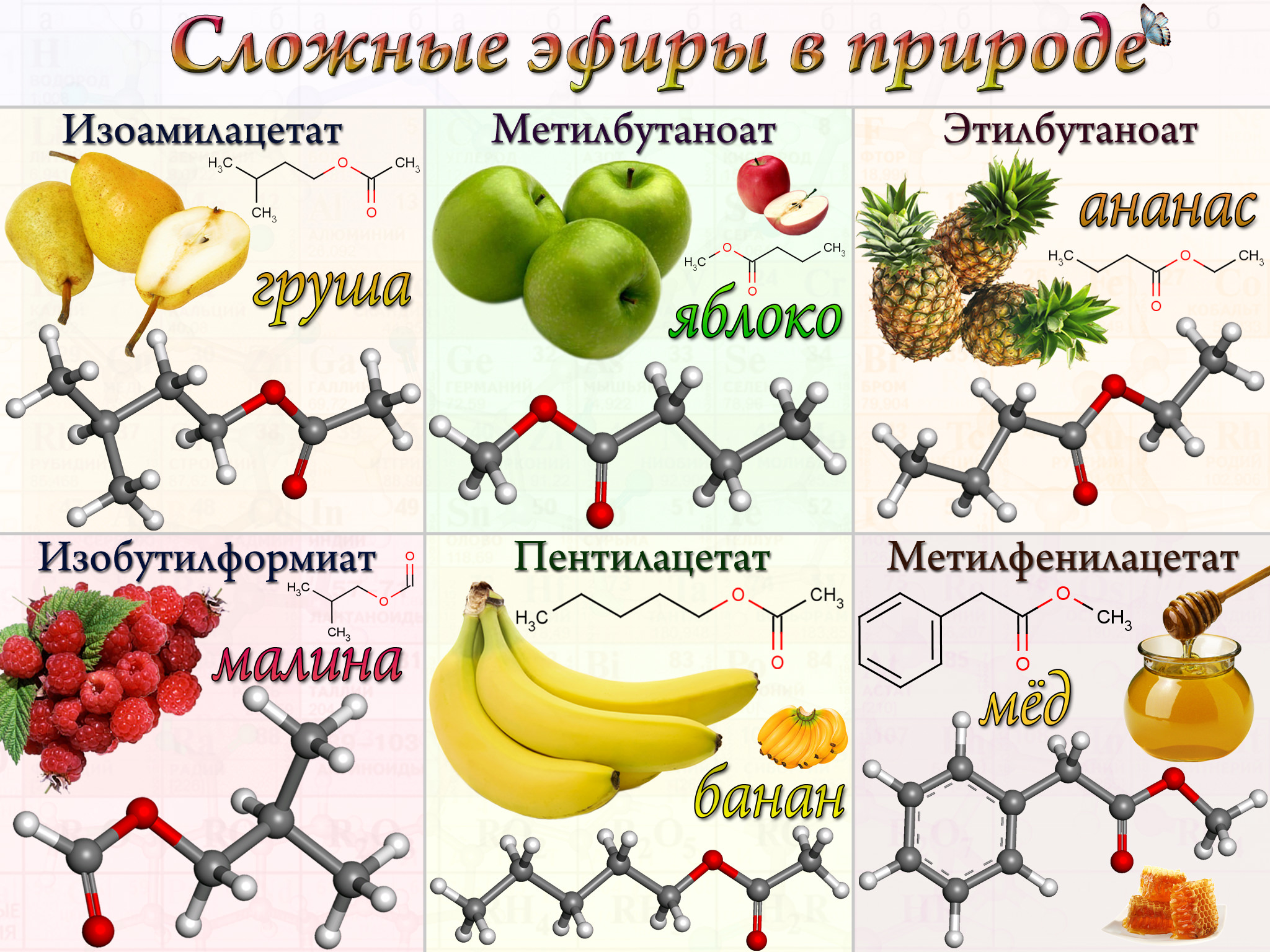
Для сложных эфиров возможно существование структурных изомеров. Например, составим структурные изомеры состава С5Н10О2. Это метилбутаноат, припилэтаноат, метил-2-метилпропаноат.

Кроме того, для сложных эфиров характерна межклассовая изомерия с карбоновыми кислотами.
Сложные эфиры, в составе которых низшие карбоновые кислоты и спирты, − летучие, малорастворимые и практически нерастворимые в воде жидкости. Они хорошо растворимы в органических растворителях.
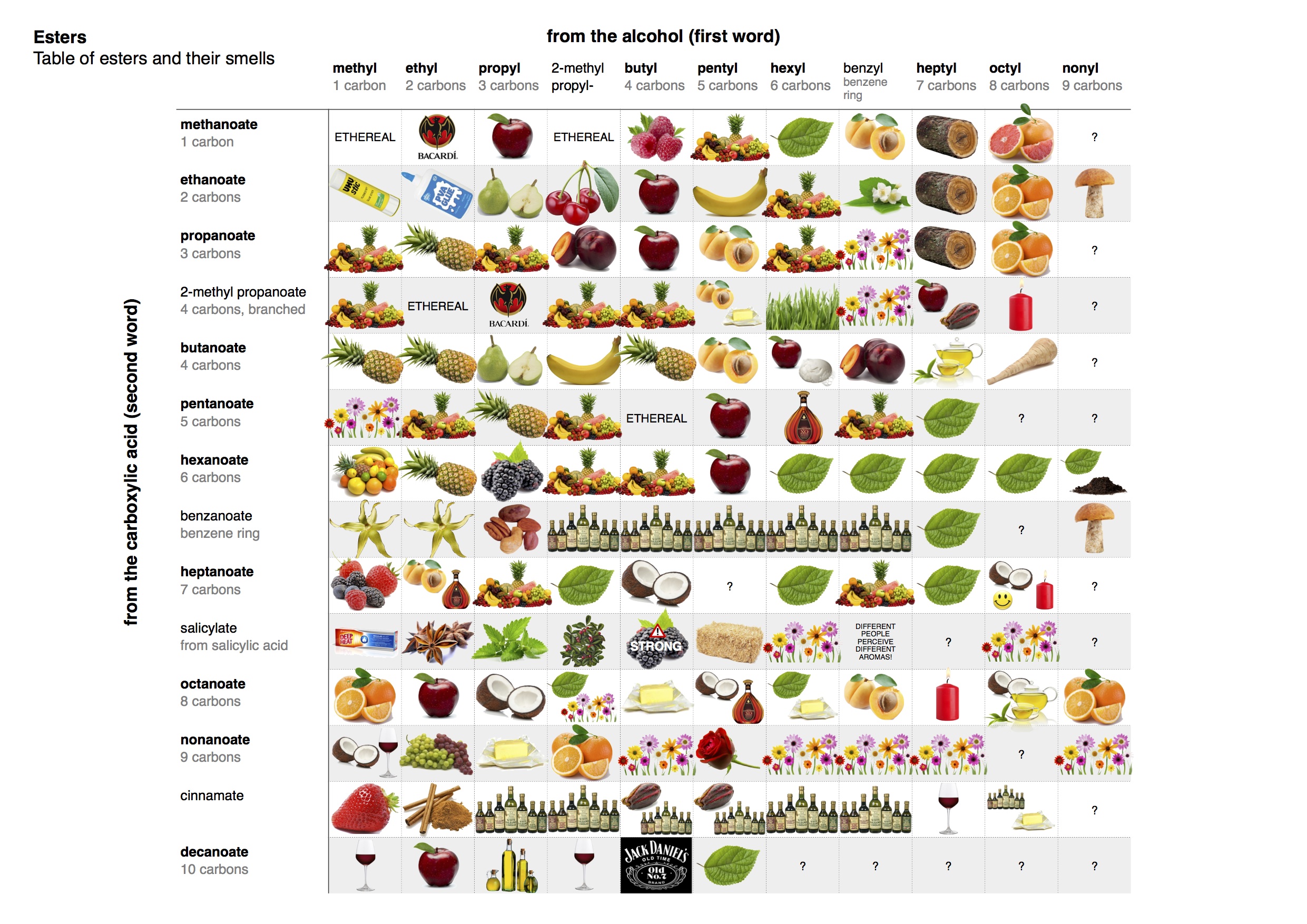
Многие эфиры имеют приятный запах: запах ананаса имеет бутиловый эфир бутановой кислоты, запах груш – изоамиловый эфир этановой кислоты, абрикосами пахнет пентиловый эфир бутановой кислоты, запах жасмина напоминает бензиловый эфир этановой кислоты, запах хризантенм – бензиловый эфир метановой кислоты.
Получить сложные эфиры можно несколькими способами. Например, в реакции карбоновых кислот и спиртов в присутствии минеральных кислот. Так, в реакции уксусной кислоты с этанолом образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты.
Реакцию образования сложного эфира, как известно, называют реакцией этерификации. Термин «эфир» впервые использовал К. Шееле в конце 18 века.
Сложный эфир можно получить и в реакции глицерина и азотной кислоты, в результате данной реакции образуется тринитроглицерин.

Для сложных эфиров характерны реакции горения. Например, составим реакцию горения метилформиата. При горении образуется углекислый газ и вода.
HCOOCH3 + 2O2 → 2CO2↑ + 2H2O
Важная реакция сложных эфиров – это реакция их с водой в присутствии кислоты или щёлочи. Эта реакция называется гидролизом. Гидролиз – реакция обратная реакции этерификации. Так, в результате гидролиза этилэтаноата в присутствии сильной минеральной кислоты, образуется этановая кислота и этанол. Эта реакция является обратимой.
CH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH
В результате щелочного гидролиза этилэтаноата образуется этаноат натрия и этанол. Этот гидролиз необратим и называется омылением.

Сложные эфиры встречаются в виде эфирных масел, жиров, восков.
Воски – это сложные эфиры высших карбоновых кислот и высших спиртов. Пчелиный воск на 70 % состоит из сложного эфира, главным образом, из пальмитиновой кислоты и миристилового спирта. Из воска изготавливают политуры, смазки, пропиточные составы для бумаги и кожи, они входят в состав косметических кремов и мазей.
Сложные эфиры применяют в парфюмерии при производстве духов, в производстве бытовой химии, сложные эфиры составляют основу эссенций для приготовления фруктовых вод, кондитерских изделий, сложные эфиры применяют как растворители органических веществ, при производстве полимерных материалов, в частности пластификаторов, в лакокрасочной промышленности, в производстве искусственных волокон, при производстве лекарственных средств (валидола, аспирина). Сложные эфиры – основа органического стекла.
Таким образом, сложные эфиры – это функциональные производные карбоновых кислот, у которых гидроксильная группа замещена на остаток спирта. Сложные эфиры широко распространены в природе.
Сложные эфиры образуются в реакциях между спиртами и кислородсодержащими кислотами. Сложные эфиры гидролизуются растворами минеральных кислот и щелочей.
Сложные эфиры применяются во многих областях промышленности.
Источник: https://videouroki.net/video/29-slozhnye-ehfiry.html
Сложные эфиры — понятие, свойства, применение
- В прошлой статье мы рассказывали о простых эфирах, а сейчас поговорим
 о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.Сложные эфиры — органические соединения на основе кислородосодержащих органических карбоновых или неорганических кислот. Структуру вещества можно представить как молекулу кислоты, в которой атом Н в гидроксиле ОН— замещен углеводородным радикалом.Получают сложные эфиры в результате реакции кислоты и спирта (реакция этерификации).
о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.Сложные эфиры — органические соединения на основе кислородосодержащих органических карбоновых или неорганических кислот. Структуру вещества можно представить как молекулу кислоты, в которой атом Н в гидроксиле ОН— замещен углеводородным радикалом.Получают сложные эфиры в результате реакции кислоты и спирта (реакция этерификации).
Классификация
 — Жиры — содержат в молекуле 9-19 атомов углерода. Получают из глицерина (трехатомного спирта) и высших карбоновых кислот. Жиры могут быть жидкими (растительные жиры, называемые маслами) и твердыми (животные жиры).— Сложные эфиры минеральных кислот по своим физическим свойствам тоже могут быть как маслянистыми жидкостями (до 8 атомов углерода), так и твердыми веществами (от девяти атомов C).
— Жиры — содержат в молекуле 9-19 атомов углерода. Получают из глицерина (трехатомного спирта) и высших карбоновых кислот. Жиры могут быть жидкими (растительные жиры, называемые маслами) и твердыми (животные жиры).— Сложные эфиры минеральных кислот по своим физическим свойствам тоже могут быть как маслянистыми жидкостями (до 8 атомов углерода), так и твердыми веществами (от девяти атомов C).
Свойства
В нормальных условиях сложные эфиры могут быть жидкими без цвета, с фруктовым или цветочным запахом, или твердыми, пластичными; как правило, без запаха. Чем длиннее цепочка углеводородного радикала, тем тверже вещество. Почти неводорастворимы. Хорошо растворяются в органических растворителях. Горючи.
Вступают в реакции с аммиаком с образованием амидов; с водородом (именно эта реакция превращает жидкие растительные масла в твердые маргарины).
В результате реакции гидролиза разлагаются на спирт и кислоту. Гидролиз жиров в щелочной среде приводит к образованию не кислоты, а ее соли — мыла.
Сложные эфиры органических кислот малотоксичны, оказывают на человека наркотическое воздействие, в основном относятся ко 2-му и 3-му классу опасности. Некоторые реактивы на производстве требуют использования специальных средств защиты для глаз и дыхания. Чем больше длина молекулы эфира, теми он токсичнее. Эфиры неорганических фосфорных кислот ядовиты.
В организм вещества могут попадать через органы дыхания и кожу. Симптомами острого отравления служат возбуждение и нарушенная координация движений с последующим угнетением ЦНС. Регулярное воздействие может привести к болезням печени, почек, сердечно-сосудистой системы, нарушениям формулы крови.
Применение
— В органическом синтезе.— Для производства инсектицидов, гербицидов, смазок, пропиток для кожи и бумаги, моющих средств, глицерина, нитроглицерина, олиф, масляных красок, синтетических волокон и смол, полимеров, оргстекла, пластификаторов, реагентов для обогащения руд.
 — В синтезе парфюмерных отдушек, пищевых фруктовых эссенций и косметических ароматизаторов; лекарственных средств, например, витаминов А, Е, В1, валидола, мазей.
— В синтезе парфюмерных отдушек, пищевых фруктовых эссенций и косметических ароматизаторов; лекарственных средств, например, витаминов А, Е, В1, валидола, мазей.
— Как растворители красок, лаков, смол, жиров, масел, целлюлозы, полимеров.
В ассортименте магазина «ПраймКемикалсГрупп» вы можете купить востребованные сложные эфиры, в том числе бутилацетат и Твин-80.
Бутилацетат
Применяется как растворитель; в парфюмерной промышленности для изготовления отдушек; для дубления кож; в фармацевтике — в процессе изготовления некоторых лекарств.
Твин-80
Он же полисорбат-80, полиоксиэтилен сорбитан моноолеат (основан на сорбите оливкового масла). Эмульгатор, растворитель, техническая смазка, модификатор вязкости, стабилизатор эфирных масел, неионогенный ПАВ, увлажнитель.
Входит в состав растворителей и смазочно-охлаждающих жидкостей. Используется для производства продукции косметического, пищевого, бытового, сельскохозяйственного, технического назначения.
Обладает уникальным свойством превращать смесь воды и масла в эмульсию.
Источник: https://pcgroup.ru/blog/slozhnye-efiry-ponyatie-svojstva-primenenie/
Угольная кислота H2CO3 — слабая двухосновная кислота, неустойчивое соединение, легко распадающееся на диоксид углерода и воду:

Угольная кислота образует два ряда производных — полные (средние) и неполные (кислые). Кислые производные нестабильны и разлагаются с выделением диоксида углерода. К наиболее важным производным угольной кислоты относятся:

Фосген COCl2 (полный хлорангидрид угольной кислоты) — газ (т.кип. 8,2 °C) с запахом прелого сена, очень ядовит, взывает отёк лёгких (применялся как боевое отравляющее вещество во время 1-ой мировой войны). В промышленности фосген получают радикальным хлорированием оксида углерода(II) над активированным углем:
CO + Cl2 COCl2
Благодаря высокой реакционной способности, фосген используется для получения других производных угольной кислоты и как реагент в различных органических синтезах для введения группы С=О. При взаимодействии фосгена со спиртами образуются сложные эфиры двух типов — полные (карбонаты) и неполные (хлоругольные эфиры):

С двухатомными фенолами или спиртами фосген вступает в реакцию поликонденсации с образованием сложных полиэфиров — поликарбонатов, имеющих широкое практическое применение.
nHO–R–OH + nCOCl2 [–O–R–O–CO–]n + 2nHCl
В реакции фосгена с первичными аминами образуются изоцианаты:
RNH2 + COCl2 R–N=C=O + 2HCl
с диаминами — диизоцианаты:
H2N–R–NH2 + 2COCl2 O=C=N–R–N=C=O + 4HCl
Диизоцианаты — исходные мономеры в производстве полиуретанов:
nO=C=N–R–N=C=O + nHO–R'–OH [–CO–NH–R–NH–CO–O–R'–O–]n
Благодаря разнообразию механических свойств, полиуретаны различных типов применяются в качестве защитных покрытий, лакокрасочных изделий, клеев, герметиков, деталей машин, изоляторов, имплантатов, подошв обуви, спортивных шин и прочих изделий.
Карбамид (мочевина) CO(NH2)2 (полный амид угольной кислоты) — кристаллическое вещество белого цвета (т.пл. 132,7 °C), растворимое в полярных растворителях (воде, этаноле и т.п.).
Промышленный способ получения мочевины — взаимодействие аммиака с диоксидом углерода при повышенных давлении и температуре:
2NH3 + CO2 NH2–CO–NH2 + H2O (реакция Базарова)
Мочевина — крупнотоннажный продукт, используемый в основном как азотное удобрение. Другое важное промышленное применение мочевины — производство мочевино-формальдегидных смол для изготовления древесно-волокнистых плит (ДВП) и других изделий.
Источник: http://orgchem.ru/chem4/o2512.php
Определение молекулярной формулы исходного сложного эфира, если при его гидролизе образуются карбоновая соль и двухатомный спирт
Определение молекулярной формулы сложного эфира в тестах ЕГЭ | Задача 100
Подробности Категория: ЕГЭ — химия
Задача 100. При щелочном гидролизе 40 г некоторого сложного эфира было получено 2 продукта: 41 г натриевой соли предельной одноосновной карбоновой кислоты и 19 г предельного двухатомного спирта.
Определите молекулярную формулу исходного эфира (при расчете считать, что в исходном эфире отсутствовали группы (ОН)).
Дано: масса сложного эфира: m(эфира) = 40 г;масса соли карбоновой кислоты: m(соли) = 41 г; масса двухатомного спирта: m(спирта) = 19 г.
Найти: молекулярную формулу эфира.
Решение:Шаг 1. В состав сложного эфира входят те же элементы, из которых состоит получающийся в результате гидролиза спирт и кислотный остаток карбоновой кислоты. Это углерод, водород и кислород. Общую формулу эфира удобно составить с учетом образующихся в химической реакции продуктов, так как во взаимодействии участвуют только функциональные группы.
Указание на одноосновность и предельность кислоты позволяет нам использовать общую формулу этого гомологического ряда, в которой лишь одна неизвестная величина «x»: CxH2x+1COOH.
Указание на предельность и двухатомность спирта дает возможность записать его общую формулу с применением лишь одной переменной. Обозначим ее «у » : СуН2у(ОН)2.
- Таким образом, общая формула искомого эфира будет: (CxH2x+1COO)2– CyH2y.
- Шаг 2. В результате гидролиза получилась натриевая соль карбоновой кислоты, следовательно, для реакции гидролиза использовали NаОН:
- (CxH2x+1COO)2– CyH2y + 2NaOH ⇔ 2CxH2x+1COONa + CyH2y(OH)2
Шаги 3,4. Приведенные в условии данные не позволяют в этих шагах определить соотношения элементов и простейшую формулу.
Шаг 5. Для выявления значений х и у в истинной формуле эфира необходимо сопоставить массы участвующих в реакции веществ, данные о которых фигурируют в условии.

- Составим 2 пропорции:
- 40 г эфира дают 41 г соли (по условию)(28х + 14у + 90) г эфира дают (28x + 136) г соли (по уравн.)
- Из этой пропорции получаем первое математическое уравнение:
40 . (28x + 136) = 41 . (28x + 14у + 90)
- В результате приведения подобных и упрощения получаем:
- 28x + 574у = 1750 (1 уравнение)
- 40 г эфира дают 19 г спирта (по условию)(28х + 14y + 90) г эфира дают (14у + 34) г спирта (по уравн.)
- Из этой пропорции получаем второе математическое уравнение:
40 . (14у + 34) = 19 . (28х + 14у + 90).
- В результате приведения подобных и упрощения получаем:
- 294у – 532x = 350 (2 уравнение)
- Объединяем два математических уравнения в систему:
![]()
- Решая ее, получаем х = 1; у = 3.
- Подставим значения х и у в общую формулу эфира, получим:
- (С1Н3СОО)2–С3Н6
- Ответ: (СН3СОО)2–С3Н6.
Источник: http://buzani.ru/zadachi/ege-khimiya/1041-opredelenie-molekulyarnoj-formuly-slozhnogo-efira-v-testakh-ege-zadacha-100




