Спирты (алкоголи) – это углеводороды, строение которых отражается наличием по крайней мере одной гидроксильной группы –ОН, присоединенной к углеводородной цепи. Далее детально рассмотрим какова классификация, строение, изомерия и номенклатура спиртов.
- Классификация по строению связанной с ОН – группой углеводородной цепи:
- • Предельные спирты. Гидроксильная группа связанна насыщенной углеродной цепью, например, этанол, изопропанол, третбутанол, вторбутанол:
- • Непредельные спирты. Гидроксильная группа связанна с углеродной цепью, в составе которой имеется одна или несколько кратных связей, например, аллиловый и пропаргиловый спирты:

- • Ароматические спирты. Группа – CH2OH связанна с ароматической структурой, например, бензиловый спирт, 1-фенилэтанол-1, 2-метил-2-фенилпропанол:

- Классификация по количеству ОН – групп в молекуле
• Одноатомные спирты. В молекуле присутствует только одна гидроксильная группа, например, третбутанол, пропинол, бензиловый спирт (структурные формулы представлены выше).
• Многоатомные спирты. В молекуле присутствует более двух гидроксильных групп, например, этиленгликоль (1,2-этандиол), глицерин (1,2,3-пропантриол), пинакон (2,3-диметилбутандиол-2,3): 
Многоатомные спирты, в молекуле которых каждая группа – ОН соединена с различными атомами углерода стабильны.
Если две ОН – группы находятся у одного атома углерода, то такие соединения не отличаются стабильностью. В этом случае происходит отщепление молекулы воды и переход в более устойчивый альдегид.
Молекул спиртов, в которых у одного атома углерода находятся одновременно три ОН – группы не существуют.
Классификация спиртов по характеру связанного с гидроксильной группой углеродного атома
• Первичные. ОН — группа связана с первичным атомом углерода (т.е. связанным еще с одним атомом углерода), например, пентанол-1, 2-метилбутанол-1: 
- • Вторичные. ОН — группа связана со вторичным атомом углерода (атом углерода связан с двумя другими атомами углерода), например, втор-пропанол, втор-бутанол, 1,2-диметилбутанол-1:

- • Третичные. ОН-группа связана с третичным атомом углерода (связанным с тремя другими атомами углерода), например, трет-бутанол, 1,1,2-триметилбутанол-1:

- Гидроксильные группы аналогично называют первичной, вторичной и третичной.
- Молекулы многоатомных спиртов одновременно могут содержать и первичные и вторичные группы ОН, например, в глицерине две ОН – группы – первичные и одна вторичная.
- Общая молекулярная формула спиртов:
- • Насыщенные одноатомные спирты — CnH2n+1OH • Ненасыщенные одноатомные спирты (одна двойная связь) – CnH2n-1OH • Многоатомные насыщенные спирты — CnH2n+1(OH)k, где k – целое число более 2.
Строение спиртов
- В молекуле предельного спирта атомы углерода и кислорода находятся в состоянии sp3 – гибридизации.
- Две гибридные орбитали атома кислорода заняты неподеленными электронными парами, две другие свободны для связывания с другими атомами:

- Для примера приведем строение этанола:
- Угол Н-С-Н составляет 109,5°, С-O-H – 108,9° (в молекуле воды угол Н-О-Н равен 104,5°).
Изомерия и номенклатура спиртов
Изомерия спиртов зависит от строения углеродной цепи (изомерия углеродного скелета) и положения —ОН в цепи (функциональная изомерия). Кроме этого, для них характерна межклассовая изомерия (спирты изомерны простым эфирам).
Например, соединение состава С4Н10О имеет следующие изомеры: 
Как и другие органические соединения, спирты называют как по правилам рациональной номенклатуры (как замещенные метилового спирта — карбuнола), так и номенклатуры ИЮПАК. Для некоторых из них существуют тривиальные названия.
Наиболее часто используется систематическая номенклатура ИЮПАК. В общем виде, используя правила этой номенклатуры, название можно построить в несколько этапов:
• Назвать самую длинную углеродную цепь, содержащую атом углерода, несущий группу —OH. • Отбросить окончание -ан от названия соответствующего алкана и добавить суффикс -ол.
Если гидроксильных групп несколько, до добавить числительное, показывающее количество ОН-групп (-диол, -триол и т.д.) • Найти и пронумеровать самую длинную углеродную цепь, начиная с конца, ближайшего к группе —OH.
• При необходимости указать положение группы -OH.
• Назвать заместители, указать их количество и положение.
Источник: http://zadachi-po-khimii.ru/organic-chemistry/klassifikaciya-stroenie-izomeriya-i-nomenklatura-spirtov.html
Урок 22. Спирты – HIMI4KA
Самоучитель по химии › Органическая химия
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксогруппу ОН.
Если углеводородный радикал обозначить буквой R, то в общем виде формулу молекулы спирта можно изобразить так:
У атома углерода, который соединен с гидроксогруппой, все связи должны быть простыми:

Соединения, у которых гидроксогруппа находится рядом с двойной связью, неустойчивы:

По строению углеводородного радикала спирты делят на:
![]()
в углеводородном радикале, все связи простые;
![]()
в углеводородном радикале, есть кратная связь;

имеется бензольное кольцо, т. е. в углеводородном радикале есть ароматическая связь.
По числу гидроксогрупп спирты делят на:
в состав молекулы входит одна гидроксогруппа ОН;

в состав молекул входит две или более (много) гидроксогрупп.
Рассмотрим строение молекул и свойства предельных одноатомных спиртов.

Гомологический ряд, номенклатура, изомерия
- Для того чтобы вывести общую формулу гомологического ряда предельных одноатомных спиртов, сравним их состав и состав алканов:
- В названиях спиртов гидроксогруппа обозначается суффиксом ОЛ. Этот суффикс прибавляется к названию исходного углеводорода:
- Кроме этих названий (по ИЮПАК) для простейших спиртов используют рациональные названия, которые происходят от названия радикала:
- Начиная с n = 3, для спиртов возможна изомерия. Она связана с положением группы ОН в молекуле:
Вопрос. Как обозначить положение группы ОН в молекуле?
Как всегда, положение группы ОН обозначают цифрой, которая соответствует номеру атома углерода, соединённому с группой ОН. Нумерацию основной цепи начинают с того конца, к которому ближе группа ОН.
Таким образом: название спирта (1) пропанол-1; название спирта (2) пропанол-2.
Поскольку спирты называют «по радикалам», эти спирты можно назвать и так: пропиловый спирт (1) и изопропиловый спирт (2).
Задание 22.1. Составьте молекулярные формулы этих спиртов и убедитесь, что это — изомеры.
Спирты изомерны простым эфирам, в молекулах которых атом кислорода соединяет два углеродных радикала (это изомерия между разными классами веществ):
Простые эфиры — это вещества, в молекулах которых два радикала соединены атомом кислорода. Поэтому их называют, исходя из названий радикалов. Например, простой эфир (3) — это диметиловый эфир.
Задание 22.2. Составьте графическую формулу изомера пропиловых спиртов, который является простым эфиром. Назовите его.
Строение молекул
Если при помощи графической формулы показать строение молекулы этилового спирта, то легко можно увидеть, что атомы водорода в ней неравноценны:
Действительно, пять атомов водорода соединены с атомами углерода, а один — с атомом кислорода. Теория Бутлерова утверждает, что «атомы в молекуле взаимно влияют друг на друга». Поэтому можно ожидать, что этот атом водорода будет отличаться от остальных пяти.
Это отличие заключается в том, что связь О–Н гораздо более полярна, чем связи С–Н. Дело в том, что атом кислорода имеет бОльшую электроотрицательность, чем атом углерода, т. е. способен сильнее смещать к себе общую пару электронов.
В результате, на атомах кислорода и водорода связи О–Н появляются значительные заряды (+) и (–).
Вопрос. На каком атоме появляется (+), а на каком (–)?
Величина этих зарядов меньше единицы, но они способны притягивать к себе молекулы других реагирующих веществ, т. е. активнее участвовать в химических реакциях будут наиболее полярные связи.
Вывод. Самыми полярными связями в молекуле спирта являются связи О–Н и О–С. За счёт их разрыва происходят химические реакции (спирт функционирует). Поэтому ОH — функциональная группа спиртов.
Свойства одноатомных спиртов
Физические свойства
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода).
Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу.
Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
- Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
- Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Задание 22.4. Составьте уравнения таких реакций для пропанола-1 (пропилового спирта). Уравнения реакций составляйте по аналогии с вышеперечисленными.
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
- Пищевой и медицинский спирты получают брожением глюкозы:
- В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
- Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Задание 22.6. Составьте уравнения реакций:
- пропен + вода;
- 1-хлорпропан + NaOH (водный).
Назовите полученные вещества.
Многоатомные спирты
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:
Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
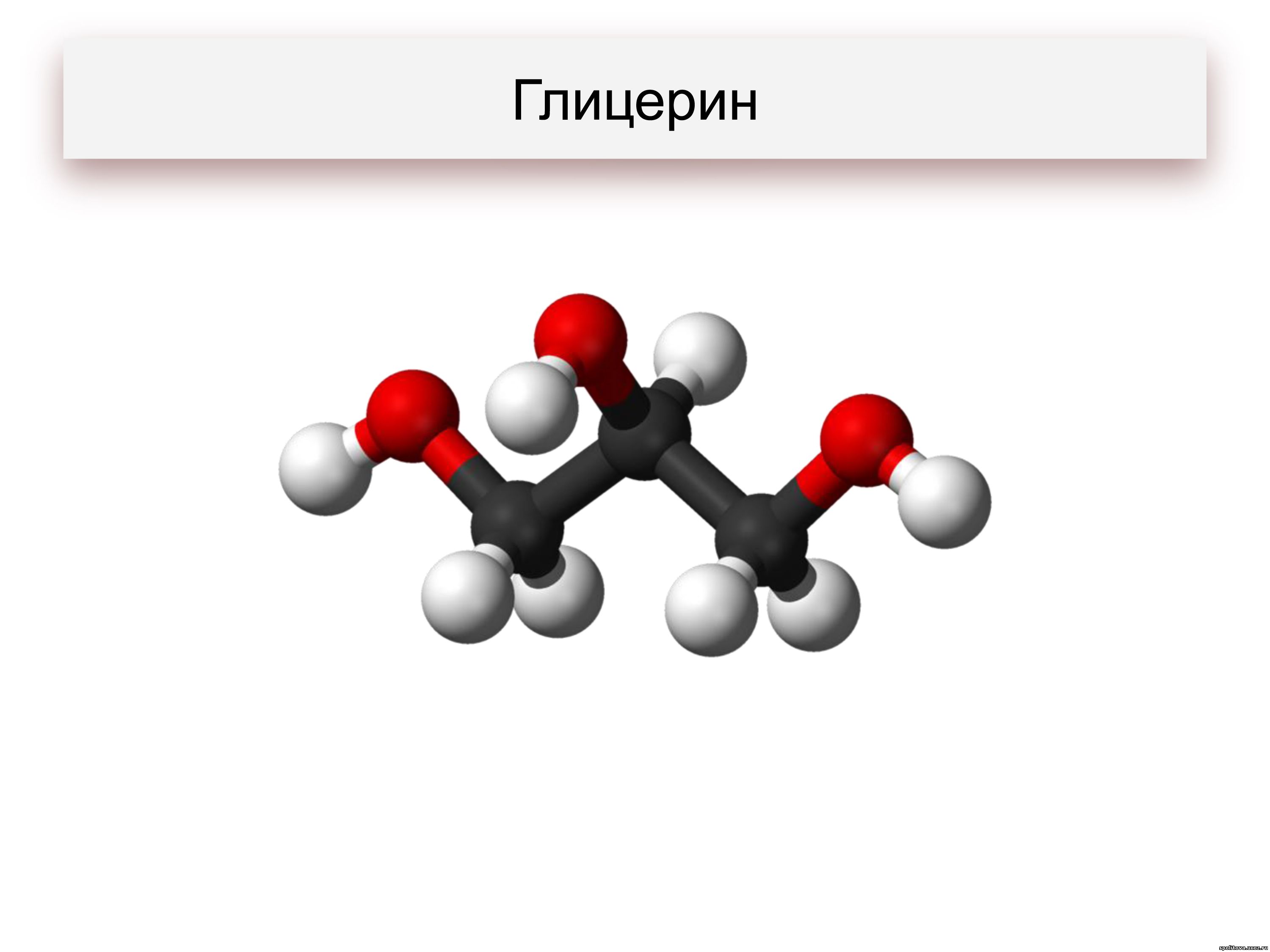
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами.
Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги.
Растворы глицерина, наоборот, смягчают кожу.
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — это качественная реакция на многоатомные спирты.
Задание 22.9. Составьте уравнения реакций этиленгликоля:
- с азотной кислотой;
- с Сu(ОН)2.
Подсказка. При составлении уравнений этих реакций записывайте формулы многоатомных спиртов так, чтобы цепочки атомов углерода располагались вертикально, а группы ОН были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга.
Глицерин находит широкое применение в кожевенной промышленности (смягчает кожу), используется в медицине, входит в состав невысыхающих красок. Кроме того, глицерин, точнее, остаток его молекулы входит в состав любого жира. Поэтому глицерин часто получают из природных жиров (уравнение реакции в уроке 25).
Понятие о фенолах
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
- Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
- или
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом.
В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают.
Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
- Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:
- Фенол применяют для дезинфекции и получения красителей и полимеров.
Выводы
Спирты и фенолы — это производные углеводородов, содержащие функциональную группу ОН. Для таких веществ характерны реакции замещения атома водорода в гидроксогруппе.
Спирты за счёт функциональной группы ОН образуют простые и сложные эфиры (см. урок 25), а фенолы реагируют и за счёт функциональной группы ОН, и за счёт ароматического ядра.
Источник: https://himi4ka.ru/samouchitel-po-himii/urok-22-spirty.html
Химическая формула этилового спирта — Alco-life

Алкогольную зависимость можно считать болезнью, которая может появится у любого человека, вне зависимости от возраста. Зависеть это может и не от окружения, наследственности или особенности личности. На сегодняшний есть множество различных проблем связанных с алкогольной зависимостью например: Химическая формула этилового спирта. К счастью есть клиники которые способны помочь с ними справится.

История открытия спирта
Формула спирта в том или ином виде была открыта практически одновременно во многих регионах земного шара.
В 1334 году французский алхимик Арно де Вильггер изначально получил винный спирт. В 1360 году итальянские и французские монастыри производили такое вещество под названием «вода жизни». Генуэзские купцы в 1386 году привезли спирт в Москву, чтобы продемонстрировать его качества.
Определение
Теперь разберемся с тем, что такое этиловый и метиловый спирт.
Метанол (он же метиловый спирт,он же древесный спирт, он же карбинол, он же метилгидрат, он же гидроксид метила) – одноатомный простейший спирт, ядовитая, бесцветная жидкость. С воздухом образует (в объемных концентрациях от 6,98 до 35,5%) взрывоопасные смеси (при температуре 8 градусов по Цельсию). Молекулярная формула спирта метилового – CH4O или CH3-OH.
Этанол (или же этиловый спирт, или же винный спирт, или же алкоголь, в простонародье просто «спирт», метилкарбинол) — спирт одноатомный с привычной формулой C2H5OH. При стандартных условиях это летучая, бесцветная, горючая прозрачная жидкость. Является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека, и действующим компонентом алкогольных напитков.
Сравнение
С позиции определения и химической формулы достаточно просто определить то, как отличить метиловый от этилового спирта. На практике же все не настолько уж и просто.
Если обратится к химии, то можно получить много информации об этих веществах: применении, получении, свойствах, нахождение в природе и т.п. Но давайте вернемся к бытовым вопросам и рассмотрим подробнее, чем отличается метанол от этанола.
Метанол по виду подобен этанолу: бесцветный, с характерным, но более слабым запахом. Это и есть основные свойства метилового спирта. Просто так, к сожалению, эти два вещества очень трудно отличить друг от друга.
Только профессиональный химик сможет визуально отличить один вид от другого. Цвет, запах, вкус настолько схожи, что часто эти вещества путают. Последствия такой путаницы чреваты: от слепоты до летального исхода.
Отличия
В домашних условиях можно провести несложные опыты для выявления отличий. Приведем три важных способа отличия метанола от этанола. Эти же способы будут носить и сравнительный характер.
1 способ. Поджигание исследуемой жидкости. Один из самых простых и надежных способов: поджигаем наш образец, следим за цветом пламени. Этанол горит синим цветом, а метанол – зеленым. Это же так просто и понятно, но помните, что незнание, к сожалению, не освобождает человека от последствий.
Введем новое понятие в нашей статье – технический спирт. Под понятием «технический спирт» понимаем спирты (метанол, денатурат) и их смеси, не пригодные для употребления человеком, наносящие серьезный и непоправимый урон как здоровью, так и жизни.
Также нужно учесть следующий момент: используя градусник в нашем простом опыте, надо зафиксировать температуру закипания, так как известно из разделов химии, что этанол закипает при температуре 78° по Цельсию, а метанол достигает кипения уже при 64°.
2 способ. Используем обыкновенный картофель. Небольшую дольку картофеля на несколько часов нужно бросить в исследуемую жидкость: если по истечении указанного времени картофель не поменял цвет, то перед вами этанол — вещество, пригодное для употребления. Если же долька картофеля окрасилась в розовый цвет, то исследуемая жидкость является метанолом – сильнейшим ядом для организма человека.
3 способ. Формальдегидная проба. Здесь нам понадобится медная проволока, небольшую часть которой необходимо накалить добела и опустить в жидкость. При нахождении в ней этанола можно почувствовать запах прелых яблок, а там, где находится метанол, вы услышите резкий неприятный запах – запах формальдегида.
Помните, что небольшая доза (хватает и 50 мл) метанола может привести к смертельному исходу. Будьте бдительны, не покупайте алкогольные напитки в сомнительных точках продаж, не рискуйте жизнью и здоровьем, а покупайте алкоголь в специализированных магазинах.

Симптомы отравления метанолом
Симптоматика отравления метанолом очень схожа с алкогольным отравлением, но на общем фоне тошноты, головокружения, опьянения, вялости, рвоты, судорог необходимо выделить потерю зрения. Метанол попадает в организм человека во время дыхания, через кожу и пищеварительный тракт.
Возникает сильнейшая боль в ногах, резкая головная боль. Он поражает нервную систему, разрушает сосуды, приводит к слепоте. Быстро всасывается, медленно выделяется, кумулирует (накапливается).
Окисляясь в организме, образует токсичные соединения — муравьиную кислоту и формальдегид. Формальдегид является очень токсичным, так как это вещество первого класса опасности. Он официально признан концерагеном.
Накопление его в организме приводит к развитию онкологических заболеваний. Муравьиная кислота вызывает повреждение глаз и дыхательных путей. Тяжелое отравление с потерей зрения может вызвать прием внутрь всего лишь 5-10 мл метилового спирта.
Смертельная доза находится в пределах от 30 до 100 мл, но она зависит и от индивидуальных особенностей конкретного организма. Смерть наступает от остановки дыхания. Диагноз может быть подтвержден нахождением в моче пострадавшего такого вещества, как муравьиная кислота.
Первая медицинская помощь
Выше было наглядно показано как отличить метиловый от этилового спирта. Однако бывают в жизни такие ситуации, когда приходится оказывать пострадавшему первую медицинскую помощь.
При отравлении метанолом она направлена на выведение из организма яда, задержку процесса окисления данного вещества. Однако в самую первую очередь будет страдать выделительная система. При употреблении технического спирта внутрь, необходимо промыть желудок в течении пары первых часов.
Обычно назначают обильное питье, прием растворов щелочей (гидрокарбоната натрия 10-15 грамм). Противоядием является этиловый спирт, который понижает процесс окисления метилового спирта и образование токсических продуктов превращения. Статистика по случаям отравления метанолом удручающая.
ГОСТ – это прежде всего документ, регламентирующий какими качествами должны обладать товары, продаваемые на территории определенной страны. Существует несколько ГОСТов на этанол, которые описывают предназначение, условия хранения, транспортировки и многое другое.
Но такой сложный вопрос, как употребление алкогольных напитков, может породить многочасовые дебаты.
Да и не в этом дело, ведь каждый человек должен сам для себя решать вопросы подобного уровня. Но давайте обратимся к ГОСТу 1972 года: «Этиловый спирт – легковоспламеняющаяся, бесцветная жидкость с характерным запахом. Относится к сильнодействующим наркотикам, которые вызывают сначала возбуждение, а затем — паралич нервной системы».
Теперь читаем ГОСТ 1982 года: «Этиловый спирт – легковоспламеняющаяся, бесцветная жидкость с характерным запахом, относящаяся к сильнодействующим наркотикам». И, наконец, 2000 год: «Этиловый спирт – это бесцветная, легковоспламеняющаяся жидкость с характерным запахом». Эти же самые нормативные документы и регламентируют такое вещество, как спирт этиловый технический.
Вред и польза алкоголя
Давайте не будем трогать этот огромный айсберг под названием «пить или не пить». Вспомним слова всеми любимого Семена Семеновича Горбункова о пользе алкоголя.
Алкоголь способен незначительно предотвратить формирование тромбов, снизить содержание в крови холестерина, расширить сосуды, что приведет к более интенсивному кровообращению. А лекарство, как известно, любит четкую дозировку, поэтому 50 мл лечит и бодрит.
Но польза, которую приносит алкоголь, слишком мала по сравнению с его вредом: алкоголь вносит изменения в генетическую структуру человека, что может привести к отклонениям в умственном развитии потомков, оказывает пагубное действие на нравственное поведение человека.
При этом стоит вспомнить, что именно алкоголь побуждает человека совершать необдуманные, глупые и жестокие поступки. Чтобы такого не случилось, следует четко соблюдать норму. Полезным будет и полный отказ от разнообразных алкогольных напитков.
Помните, что если вы превысите норму, то алкоголь станет ядом, который нанесет вред органам и даже целым системам вашего организма.
Собственно на этом и можно закончить рассуждение о том, как отличить метиловый от этилового спирта.
Разновидности спирта
Алкоголь обладает множеством различных модификаций. Некоторые виды спиртов тесно соприкасаются с пищевыми технологиями, другие являются ядовитыми. Чтобы узнать их действие и влияние на человеческий организм, следует понимать их главные характеристики.
Пищевой (или питьевой)
Или спирт этиловый.
Его получают способом ректификации (процесс разделения многокомпонентных смесей с использованием теплообмена между жидкостью и паром). За сырье для его приготовления берутся различные виды зерен. Химическая формула питьевого этилового спирта следующая: С2Н5ОН.
Пищевой спирт, входящий в состав алкоголя, воспринимается в большинстве случаев, как водка. Именно им и злоупотребляют многие личности, доведя себя до стойкой алкогольной зависимости.
Пищевой этанол обладает и собственными разновидностями (они зависят от видов сырья, которое было использовано). Классификация питьевого спирта имеет следующие виды:

Спирт I сорта (или медицинский)
Его не используют для выпуска алкогольной продукции. Данное соединение предназначено для использования исключительно в медицинских целях в качестве антисептика, обеззараживания операционных и хирургических инструментов.
Альфа
Спиртовое соединение высшего сорта.
Для его изготовления берется отборная высококачественная пшеница или рожь. Именно на базе спирта Альфа выпускается элитные алкогольные напитки суперпремиум класса.
Люкс
Для производства питьевого этанола данного уровня используют картофель и зерно, с учетом, что на выходе объем картофельного крахмала не должно превышать 35%.
Спиртовое соединение пропускается через несколько ступеней фильтрации. Из него выпускают водку премиум-класса. Данные водочные напитки обладают несколькими степенями защиты. У них особенная форма бутыли, специально разработанные голограммы, уникальный колпачок.
Экстра
На его основе делают классическую и многим знакомую водку среднеценового сегмента.

Базис
Практически не уступает водочным этанолам Экстра и Альфа.
Обладает такой же высокой крепостью (порядка 95%). Водка, изготовленная из этого питьевого спирта, является самым ходовым товаром, так как она наиболее доступна (средний ценовой сегмент рынка). Производят спирт этой марки из картофеля и зерна, с учетом, что объем картофельного крахмала в получаемой продукции не превышает 60%.
Спирт высшей категории очистки
Изготавливают его на базе смеси следующих продуктов:
Данное соединение при технологическом процессе подвергается минимальной обработке и отфильтровыванию от различных примесей и сивушных масел. Его пускают на изготовление дешевой водки экономкласса, различных настоек и ликеров.
Способы использования этанола
Этиловый спирт используется не только в любимой многими алкогольной индустрии. Его применение разнообразно и довольно любопытно. Кстати, этиловый спирт используется и в качестве антидота при отравлении метанолом. Это эффективное противоядие в случае интоксикации техническим спиртом.
В этом случае следует немедленно звонить в Скорую помощь. Помните, что при неоказании квалифицированной помощи очень велик риск летального исхода.
Подводя итоги, можно понять, что уметь разбираться в видах спирта и отличать ядовитое соединение от питьевого этанола очень важно. Не забывайте, что даже при потреблении мизерного количества ядовитого метанола, вы подвергаете свою жизнь риску и подводите свой организм к фатальной смертельной черте.
Данная проблема: Химическая формула этилового спирта, достаточно популярна на сегодняшний день. Алкоголь может действовать на людей по-разному. Возможно алкоголь и приносит какую то пользу, но чаще всего употребление спиртных напитков пагубны для здоровья. Самым сложным с чем приходится справляться это психологическая зависимость, в этом случае нередко приходится обращаться за помощью.
Источники:
https://dic.academic.ru/dic.nsf/ruwiki/1185150
http://www.xumuk.ru/encyklopedia/2/5437.html
http://fb.ru/article/311779/kak-otlichit-metilovyiy-ot-etilovogo-spirta-formula-spirta
http://vsezavisimosti.ru/alkogolizm/formula-pitevogo-etilovogo-spirta.html
Источник: https://alco-life.ru/obshhee/ximicheskaya-formula-etilovogo-spirta/
Формула технического спирта
История появления формулы водки часто упоминается в связке с именем великого учёного Д. И. Менделеева. Опираясь на информацию из докторской диссертации «О соединении спирта с водой», ему приписывают создание и усовершенствование спиртного напитка.
На самом же деле учёный имеет лишь опосредованное отношение к изобретению алкоголя, так как изучал удельный вес спиртоводных растворов в зависимости от концентрации и температуры.
В диссертации рассматривалось взаимодействие этилового спирта при смешивании с водой, а также последствия таких действий.
Но нет никаких данных, что Д. И. Менделеев изучал какие-либо биохимические свойства подобных спиртоводных растворов разной концентрации. И уж тем более их физиологическое воздействие на человеческий организм. Речь шла об установлении предельной концентрации, при которой происходит максимальное взаимное растворение воды и спирта друг в друге.
Так кто же вывел формулу водки на самом деле? Конкретного имени в источниках не встречается, но следует упомянуть, что в некотором смысле создателем прототипа можно считать персидского врача Ар-Рази, который выделил спирт путём перегонки. Зато известно, что традиционное 40-процентное соотношение спирта к воде – результат изысканий чиновников. До того как своё распространение получили спиртометры, крепость смеси измеряли отжигом.
Для этого вино поджигали. Если выгорала ровно половина, то такое питие называли «полугаром». Его крепость составляла 38° и официально была закреплена в 1843 году. Так как эта цифра была не совсем удобна при подсчётах объёмов произведённого вина и поступающих акцизов, министром финансов
Российской империи М. Х. Рейтерном было предложено округлить значение до сорока. 6 декабря 1886 года норма в 40° была официально закреплена в «Уставе о питейных заведениях».
С2Н5ОН 40 % H2O 60 %
Состав
В 1936 году в СССР был принят первый ГОСТ, по которому крепкий напиток, имеющий 40° и состоящий из этилового спирта и воды, получил своё название – водка. Остальные алкогольные изделия, обогащённые различными добавками, относились к категории винно-водочных изделий. На сегодняшний день формула водки, её крепость в 40 градусов, составляющие по ГОСТу остаются неизменными.
Это спиртное изделие обладает характерным вкусом и запахом, является абсолютно бесцветным.
Спиртное изделие в составе не содержит полиненасыщенных жиров, мононенасыщенных кислот, углеводов, белков и холестерина.
Также в чистом напитке отсутствуют какие-либо витамины, железо, магний, но отмечается присутствие натрия и калия.
Качественный продукт может создаваться только при использовании тщательно очищенной воды и спирта. Для этого используются специальные фильтры.
Если рассматривать состав с физико-химической стороны, он содержит следующие компоненты:
- вода;
- этиловый спирт;
- углеводы;
- минералы – кальций, калий, натрий;
- соляная кислота;
- уксусный альдегид.
Несмотря на то, что основными ингредиентами для качественного продукта являются именно вода и спирт, в «особые» виды спиртного могут добавляться другие компоненты. Некоторые марки содержат в себе концентраты специй, особые травяные экстракты, вытяжки из фруктов и ягод, овсяные хлопья.
Например, линейка водок «Бульбашъ» выпускается с добавлением разнообразных натуральных ингредиентов, среди которых встречаются берёзовые почки, мёд, перец, настой липового цвета и другие. Также спиртные напитки могут производиться на основе кедровых орехов, например «Деревенька», и пряных продуктов.
Для очищения и обогащения вкуса спиртного разрешено использовать следующие составляющие:
- сахар;
- лимонная кислота;
- соляная кислота;
- мёд;
- ванилин;
- активированный уголь;
- соль;
- фруктоза;
- сухое молоко;
- питьевая сода;
- уксусная кислота;
- перманганат калия.

Конечно же, все это должно содержаться в минимальных количествах. Производители крепких спиртных напитков добавляют в состав различные компоненты, руководствуясь разными причинами. Так как конкуренция на алкогольном рынке довольно серьёзная, продукт должен выделяться вкусом и качеством. Естественно, что необычные ингредиенты способны привлечь большее количество покупателей.
Предлагаем ознакомиться: Чем спирт отличается от самогона
Также благодаря дополнительным ингредиентам, например меду, конечный продукт становится более мягким, что также влияет на его конкурентоспособность. «Русская Эскадра», которая относится к сегменту премиум-алкоголя, содержит в составе сахар, помогающий сделать её вкус более лёгким.
Но если одни производители гонятся за качеством, то другие подобными добавками пытаются скрыть недостатки своей продукции. Поэтому, ориентируясь на такие показатели, следует быть очень осторожным.
В большинстве случаев покупатель при выборе алкоголя опирается на личный опыт, рекомендации друзей, рекламу и, конечно же, состав. Имея представление о том, каким образом выглядят составляющие качественного продукта, а также какие добавки могут использоваться, вы сможете более тщательно подойти к выбору спиртного.
Без алкогольных напитков не обходится ни один праздник. И, конечно, всем известно, что в состав любого горячительного входит питьевой этиловый спирт. Именно он и приносит человеку ощущение приятной эйфории и расслабленности и тяжелейшие симптомы интоксикации в случае его чрезмерного употребления. Но некоторый алкоголь несет с собой смерть.
Это связано с производством суррогатного алкоголя, где используется не этиловый, а метиловый спирт, токсичный и чрезвычайно ядовитый продукт. Оба вида соединения практически ничем не отличаются внешне, различен лишь их химический состав. Давайте, разберемся, какая же формула питьевого спирта в химии и в чем разница его со спиртом метиловым.
История этанола
Истоки знакомства с алкоголем уходят корнями еще в легендарное библейское прошлое. Ной, отведав забродивший виноградный сок, впервые познал ощущение похмелья. Именно с этого момента и начинается триумфальное шествие алкогольной продукции, развитие винодельческой культуры и многочисленные спиртные опыты.
Точкой отсчета виноделия и производства алкогольной продукции стал XIV век. Именно с этого времени получением «волшебной» жидкости занялись в различных странах с созданием и развитием многочисленных методик. К важным этапам распространения этанола, как по-научному называется питьевой спирт, и его развития можно отнести следующие года:
- XIV век (30-е годы). Впервые французским алхимиком Арно де’Вилльгер был открыт винный спирт, ученый смог выделить его из вина.
- XIV век (80-е годы). Итальянский купец познакомил с этиловым спиртовым соединением древних славян, привезя это вещество в Москву.
- XVI век (20-е года). Легендарный швейцарский врач, алхимик Парацельс вплотную занялся изучением свойств этанола и выявил его главную способность – усыплять.
- XVIII век. Впервые снотворные способности этилового спирта были испытаны на человеке. С его помощью был впервые усыплен пациент, которого готовили к сложной операции.
С этого момента начался бурный рост спиртоводочной промышленности. На территории одной лишь нашей страны вплоть до начала революции активно функционировало более 3 000 спиртовых заводов. Правда, во время ВОВ их число резко сократилось, почти на 90%. Возрождение началось лишь в конце 40-х годов прошлого века. Стали вспоминать старинные технологии и разрабатывать новые.
Этиловый спирт используется не только в любимой многими алкогольной индустрии. Его применение разнообразно и довольно любопытно. Ознакомьтесь лишь с некоторыми из основных сфер использования этанола:
- топливная (ракетные двигатели внутреннего сгорания);
- химическая (база для изготовления множество различных препаратов);
- парфюмерия (при создании различных парфюмерных композиций и концентратов);
- лакокрасочная (как растворитель, входит в состав антифризов, моющей бытовой химии, стеклоомыватели);
- пищевая (кроме производства алкоголя, успешно применяется при изготовлении уксуса, различных ароматизаторов);
- медицина (самая популярная сфера применения, как антисептик для обеззараживания ран, при искусственной вентиляции легких в качестве пеногасителя, входит в состав анестезии и наркоза, различных лекарственных настоек, антибиотиков и экстрактов).
Предлагаем ознакомиться: Можно ли пить медицинский спирт
Кстати, этиловый спирт используется и в качестве антидота при отравлении метанолом. Это эффективное противоядие в случае интоксикации техническим спиртом. Нелишним будет вспомнить основные признаки отравления алкогольными суррогатами:
- сильнейшая боль головы;
- обильная изнуряющая рвота;
- пронзительная боль в области живота;
- ощущение полнейшей слабости, обездвиживание;
- угнетение дыхания, человек порой не может сделать и вдоха.
Кстати, с точно такими же симптомами можно столкнуться и в случае обычной алкогольной интоксикации. Поэтому следует заострять внимание на количестве принятого алкоголя. Технический спирт дает развитие данной симптоматики, попав в человеческий организм даже в незначительном количестве (от 30 мл, это стандартный объем обычной рюмки).
Подводя итоги, можно понять, что уметь разбираться в видах спирта и отличать ядовитое соединение от питьевого этанола очень важно. Не забывайте, что даже при потреблении мизерного количества ядовитого метанола, вы подвергаете свою жизнь риску и подводите свой организм к фатальной смертельной черте.
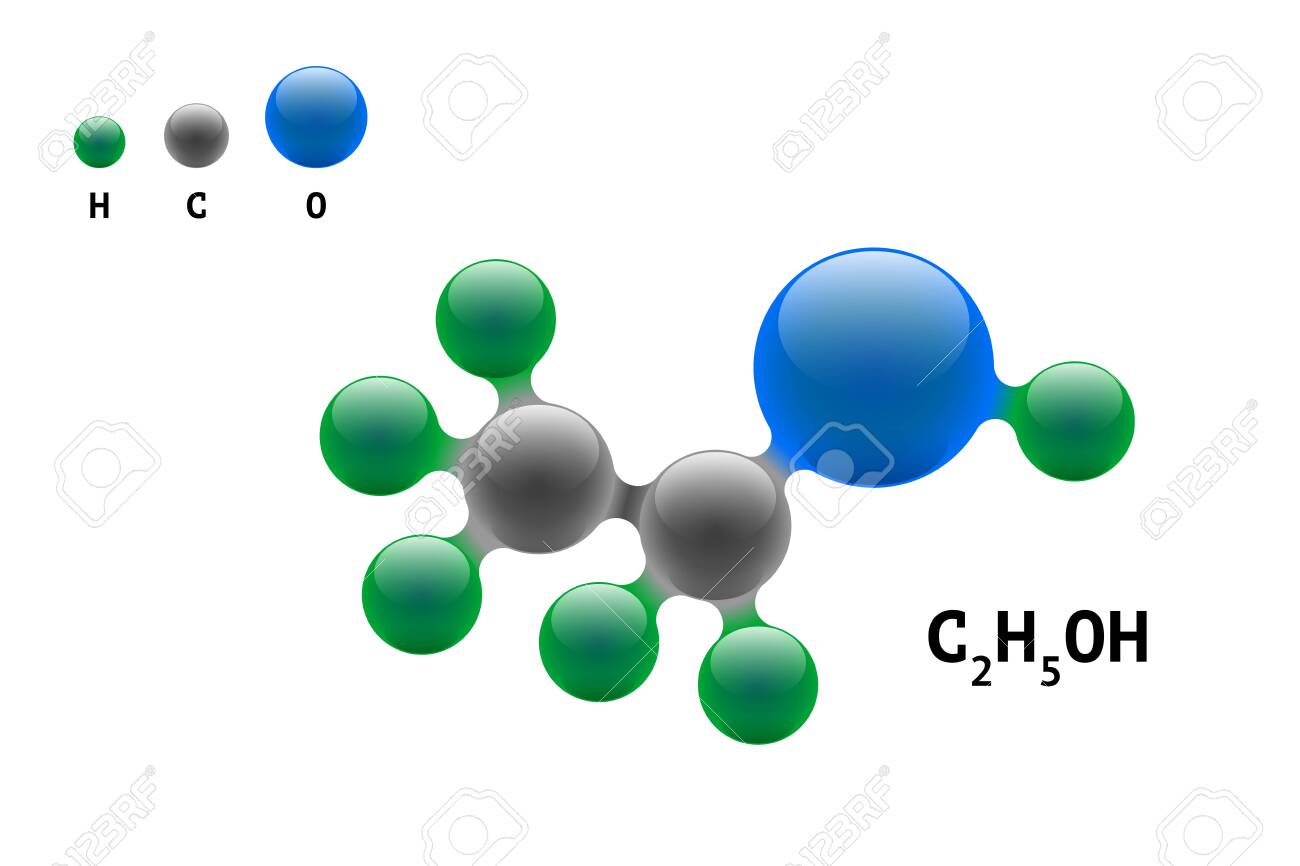
Этиловый спирт, он же этанол, он же винный спирт представляет собой бесцветную жидкость с характерным запахом и не менее своеобразным вкусом. Химическая формула спирта — C2H5OH, и получить это соединение можно двумя способами:
- гидратацией этилена (синтетический);
- брожением (микробиологический).
Первый способ достаточно сложен и редко используется даже в промышленных условиях, а дома так и вовсе не стоит отходить от использования натурального сырья. Мы ведь хотим получить качественный продукт, не правда ли?
Разновидности спирта
Алкоголь обладает множеством различных модификаций. Некоторые виды спиртов тесно соприкасаются с пищевыми технологиями, другие являются ядовитыми. Чтобы узнать их действие и влияние на человеческий организм, следует понимать их главные характеристики.
Или спирт этиловый. Его получают способом ректификации (процесс разделения многокомпонентных смесей с использованием теплообмена между жидкостью и паром). За сырье для его приготовления берутся различные виды зерен. Химическая формула питьевого этилового спирта следующая: С2Н5ОН.
Отличить ядовитый технический спирт от питьевого чрезвычайно трудно. Именно по этой причине и случаются случаи смертельных отравлений. Когда под видом этанола используют для приготовления алкогольной продукции метанол.
Но отличить спиртовые соединения все же можно. Для этого существуют нехитрые способы, применить которые можно и в домашних условиях.
- С помощью огня. Это самый легкий метод проверки. Просто подожгите алкогольный напиток. Этанол при горении горит синим пламенем, а вот цвет горящего метанола зеленый.
- С использованием картофеля. Залейте спиртным кусочек сырой картошки и оставьте на 2—3 часа. Если цвет овоща не поменялся – водка отличного качества и ее смело можно употреблять по назначению. А вот в случае когда картофель приобрел розоватый оттенок – это следствие присутствия в алкоголе технического спирта.
- С применением медной проволоки. Проволочку следует раскалить докрасна и опустить в жидкость. Если при шипении пойдет едкий отталкивающий запах – в спиртном присутствует метанол. Этиловый спирт никак пахнуть не будет.
- Измеряя температуру кипения. Следует при помощи обычного термометра замерять температуру кипения спиртов. При этом учитывайте, что метанол кипит при 64⁰С, а этанол – при 78⁰С.
- Применяя соду и йод. Налейте в прозрачную емкость проверяемый алкоголь. К нему добавьте щепоточку обычной соды. Хорошо размешайте и капните к ней йод. Теперь просмотрите жидкость на просвет. Если в ней присутствует осадок – это свидетельство «чистоты» алкоголя. Этанол при взаимодействии с йодоформом (йод сода) дает желтоватую взвесь. А вот метанол совершенно не меняется и остается прозрачным.
- С помощью марганцовки. В проверяемый алкоголь добавьте несколько кристалликов калия перманганата. Как только он растворится, и жидкость приобретет розовый окрас, нагрейте ее. Если при нагревании станут выделяться газовые пузырьки – перед вами ядовитый метиловый спирт.
Предлагаем ознакомиться: Влияние алкоголя на организм человека
Но стоит учитывать, что все эти и подобные бытовые методы не сработают, если технический спирт изначально в одном продукте будет смешан с этанолом. В данном случае помочь сможет лишь химическая экспертиза. И ответственный подход к покупке спиртного.
Чтобы не приобрести потенциально опасный алкоголь, покупайте спиртное только в проверенных местах, специализированных магазинах, которые вызывают доверие. Избегайте подпольных лавок и небольших ларечков. Именно там очень часто распространяются подделки.
Существует 2 основных способа получения этанола:
- микробиологический (спиртовое брожение);
- синтетический (гидратация этилена).
Синтетический путь получения этанола достаточно сложен, а в нашем случае ещё и мало интересен, так как наша задача получить качественный продукт исключительно из натурального сырья.
C6H12O6={amp}gt; 2C2H5OH 2CO2 тепло
(12×6 1×12 16×6) = 2×(12×2 1×5 16 1) 2×(12 16×2)
Проще говоря, 180 кг сахара после реакции разложатся на 92 кг спирта и 88 кг углекислого газа. С учетом того, что плотность спирта составляет 0,8кг/л, можно подсчитать, что из килограмма сахара получается примерно 0.64 л спирта.
Сырье
Как известно, сырьем для получения спирта чаще всего служит не чистый сахар, а содержащие его продукты. Для того, чтобы рассчитать выход спирта при их брожении необходимо знать сахаристость, которая выражается в процентах. Например, сахаристость яблок 12%, а общая доля сока от массы плода достигает 70%.
(C6H10O5)n n×H2O катализатор = n×C6H12O6
Примечательно, что в данной реакции 1 кг крахмала преобразуется в 1.11 кг сахара, что и обеспечивает популярность именно такой технологии получения сахара. В остальном же расчет получаемого спирта крайне прост.
Проведем его на примере пшеницы, содержащей 60% крахмала: из 1 кг зерен можно получить 600 гр крахмала, который после гидролиза преобразуется в 666 гр сахара, брожение которого позволит выделить 426 мг спирта.
Интересно, что в концентрированном растворе спирта дрожжи быстро погибают, поэтому на практике удается получать лишь 15% раствор. Именно таким образом получают известное всем вино, отсюда и название — винный спирт.
Стоит отметить, что на практике никогда не удается достигнуть теоретических значений, причем потери достигают 10. 15%. Эта ситуация объясняется особенностями протекания химической реакции, в процессе которой могут происходить следующие явления:
- Испарение спирта вместе углекислым газом.
- Вторичные реакции, в результате которых сахар превращается в побочные вещества.
- Неполное протекание основной реакции, в результате чего некоторая часть сахара остается в исходном состоянии.
Также часть драгоценной жидкости теряется во время очистки, которая осуществляется путем перегонки или ректификации. Это обязательное условие получение действительно качественного продукта, и избежать потерь во время очистки не удается даже при изготовлении вина.
Как видите, процесс получения спирта достаточно прост и вполне может быть осуществлен в домашних условиях. В промышленности технология производства несколько сложнее, но каких-то кардинальных отличий все равно нет, разве что на всех стадиях состояние смеси отслеживает электроника.
Книга знаний — уникальный сборник рецептов и научных исследований подготовленных экспертами нашей компании. Здесь вы найдете практические советы о домашнем и коммерческом производстве алкоголя и сыров от ведущих винокуров, пивоваров и сыроделов
- Как делать водку на ректификационной колонне
- Сколько сахара необходимо иметь в 1 литре сусла (водный раствор экстрактивных веществ растительного сырья или солода, предназначенный к сбраживанию)?

Наши магазины в МосквеОстаповский пр.,3; ул. Смольная 63Б/П8, Киевское шоссе дом 1, к. В, 204 Ярославское шоссе 146 к1
Источник: https://drugclinic.ru/formula-tekhnicheskogo-spirta/






