Уксусная кислота (этановая кислота) CH3COOH — органическое соединение, слабая, предельная одноосновная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа».
Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна.
Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами.
Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Физические свойства

Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу.
- Давление паров (в мм. рт. ст.):
- 10 (+17,1 °C)
- 40 (+42,4 °C)
- 100 (+62,2 °C)
- 400 (+98,1 °C)
- 560 (+109 °C)
- 1520 (+143,5 °C)
- 3800 (+180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
2CH3CHO + O2 ⟶ 2CH3COOH
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
2C4H10 + 5O2 ⟶ 4CH3COOH + 2H2O
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
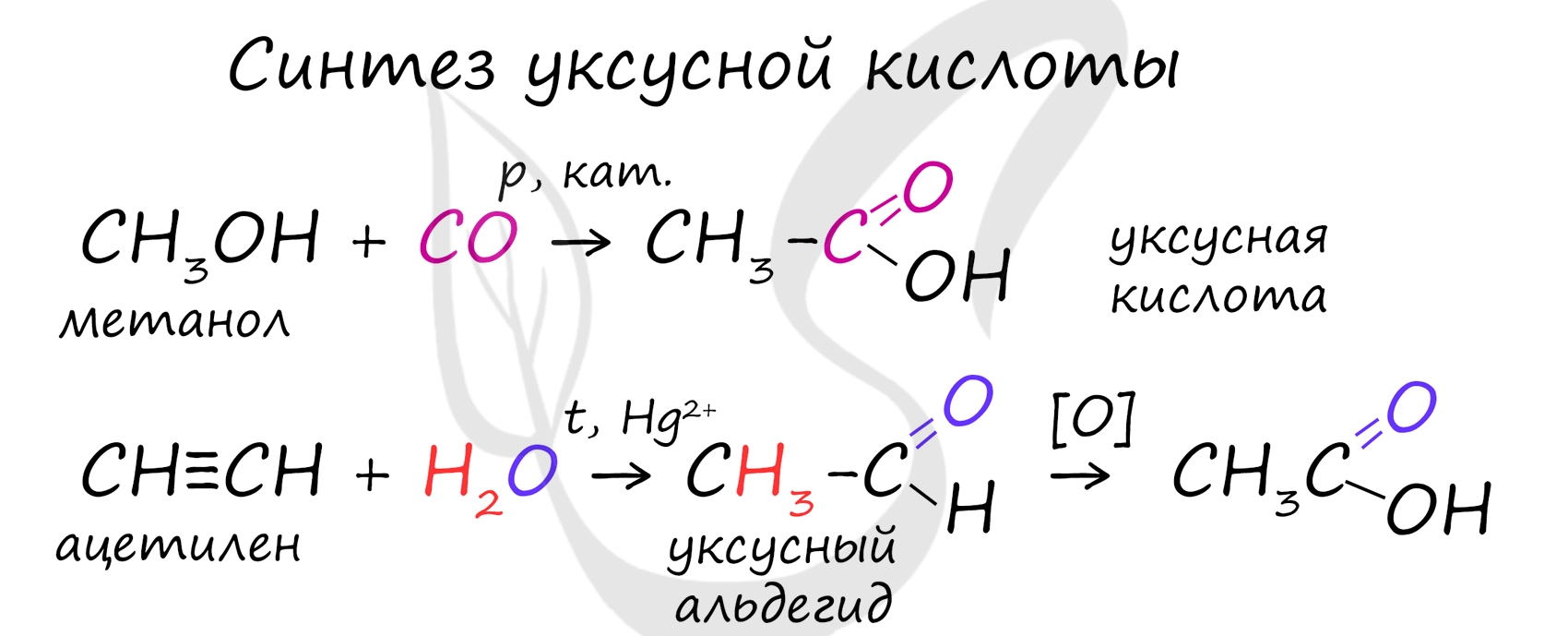
Каталитическое карбонилирование метанола
 Каталитическая схема процесса фирмы Monsanto
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
CH3OH + CO ⟶ CH3COOH
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. Катализатором превращения служил йодид кобальта.
Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт.
Луизиана) и долго оставалась единственным процессом BASF в США.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
CH3CH2OH + O2 → CH3COOH + H2O
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути
C2H2 + H2O → Hg2 + CH3CHO — Реакция КучероваCH3CHO →CrO3,H2SO4 CH3COOH 
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.

В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты).

Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
Mg + 2CH3COOH → (CH3COO)2Mg + H2↑
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
CH3COOH + Cl2 → CH2ClCOOH + HCl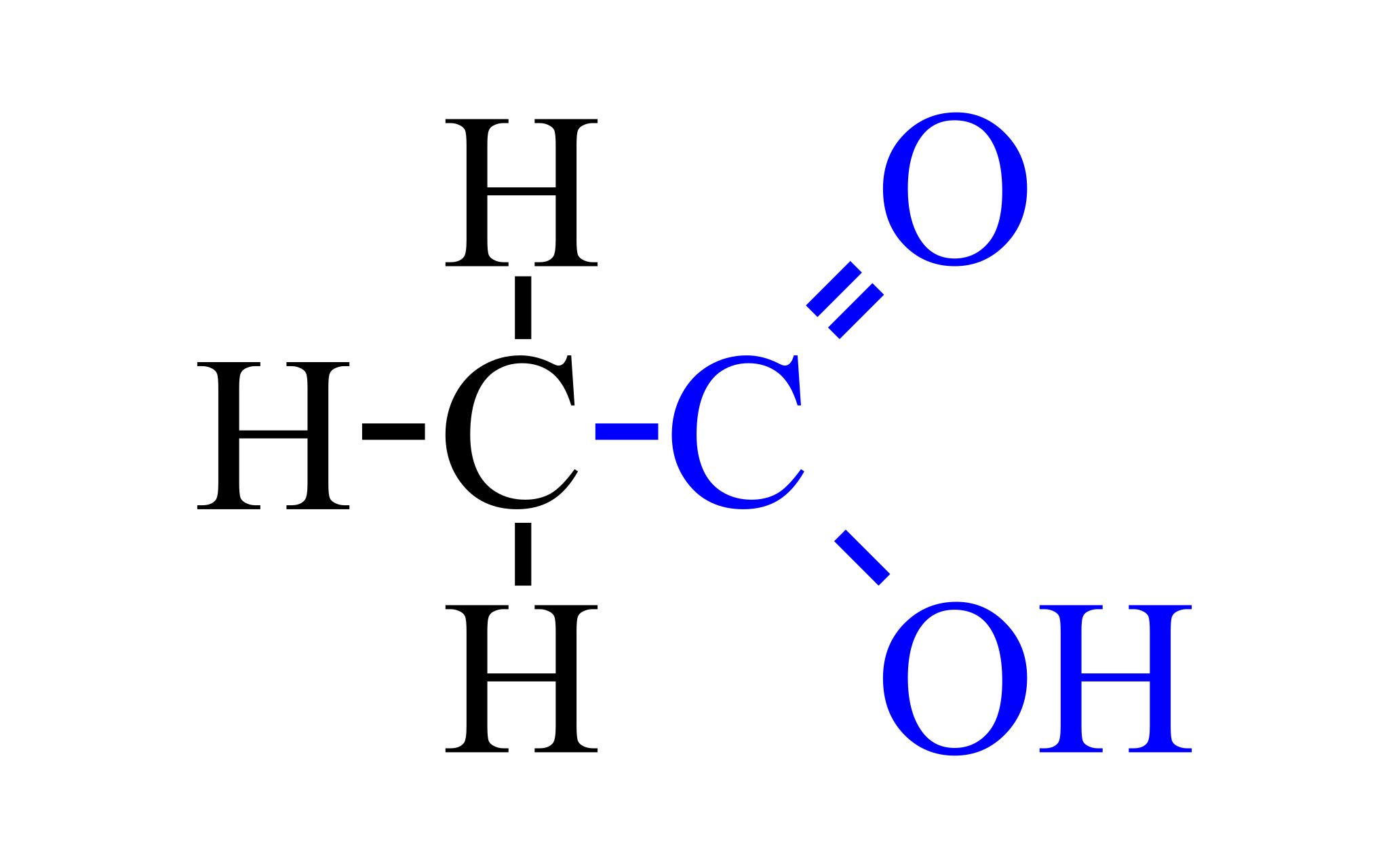
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15 % — уксусом.
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи.
Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность

Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³.
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная доза составляет примерно 20 мл.
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Источник: https://chem.ru/uksusnaja-kislota.html
Уксусная кислота: химическая формула, свойства и применение :
Этановая кислота больше известна как уксусная. Она представляет собой органическое соединение с формулой CH3COOH. Относится к классу карбоновых кислот, молекулы которых содержат функциональные одновалентные карбоксильные группы COOH (либо одну, либо несколько). О ней можно представить много информации, но сейчас вниманием стоит отметить лишь самые интересные факты.
Формула
Как она выглядит, можно понять по приложенному ниже изображению. Химическая формула уксусной кислоты несложная.
Это обуславливается многим: само соединение является одноосновным, да и относится оно к карбоксильной группе, для которой характерно легкое отщепление протонов (стабильная элементарная частица).
Данное соединение – типичный представитель карбоновых кислот, поскольку оно обладает всеми их свойствами.
Связь между кислородом и водородом (−COOH) — сильнополярная. Это обуславливает легкий процесс диссоциации (растворения, распада) данных соединений и проявление их кислотных свойств.
В итоге образуется протон H+ и ацетат-ион CH3COO−.
Что представляют собой эти вещества? Ацетат-ион – это лиганд, связанный с определенным акцептором (объектом, получающим что-то от донорского соединения), образующий устойчивые ацетатные комплексы с катионами многих металлов. А протон – это, как уже говорилось выше, частица, способная захватывать электрон с электронной М-, К- или L- оболочками атома.
Качественный анализ
Он основан именно на диссоциации уксусной кислоты. Качественный анализ, также называемый реакцией, представляет собой совокупность физических и химических методов, которые применяются для обнаружения соединений, радикалов (независимые молекулы и атомы) и элементов (совокупности частиц), которые входят в состав анализируемого вещества.
С помощью данного способа удается обнаружить соли уксусной кислоты. Выглядит все не так сложно, как может казаться. В раствор добавляют сильную кислоту. серную, например.
И если появляется запах уксусной кислоты, то ее соль в растворе присутствует. Как это работает? Остатки уксусной кислоты, которые образуются из соли, связываются в тот момент с катионами водорода от серной.
Каков результат? Появление большего количества молекул уксусной кислоты. Диссоциация так и происходит.
Реакции
Следует отметить, что обсуждаемое соединение способно взаимодействовать с активными металлами. К таковым относится литий, натрий, калий, рубидий, франций, магний, цезий. Последний, кстати, является наиболее активным.
Что происходит в момент таких реакций? Выделяется водород, и происходит образование пресловутых ацетатов. Вот как выглядит химическая формула уксусной кислоты, вступившей в реакцию с магнием: Mg + 2СН3СООН → (СН3СОО)2Mg + Н2↑.

Есть способы получения дихлоруксусной (CHCl2COOH) и трихлоруксусной (CCl3COOH) кислот. В них атомы водорода метильной группы замещены хлорными. Способа их получения всего два. Один заключается в гидролизе трихлорэтилена. И он менее распространен, чем другой, основанный на способности уксусной кислоты хлорироваться действием газообразного хлора. Данный метод проще и эффективней.
Вот как этот процесс выглядит в виде химической формулы уксусной кислоты, взаимодействующей с хлором: СН3СООН + Cl2 → СН2CLCOOH + HCL. Только стоит уточнить один момент: так получается просто хлоруксусная кислота, две вышеупомянутые образуются с участием красного фосфора в небольших количествах.
Другие превращения
Стоит отметить, что уксусная кислота (CH3COOH) способна вступать во все реакции, которые являются характерными для пресловутой карбоновой группы.
Ее можно восстановить до этанола, одноатомного спирта.
Для этого необходимо воздействовать на нее алюмогидридом лития – неорганическим соединением, которое является мощным восстановителем, часто применяемым в органическом синтезе. Его формула – Li(AlH4).

Также уксусную кислоту можно превратить в хлорангидрид – активный ацилирующий агент. Происходит это под воздействием тионилхлорида. Он, кстати, является хлорангидридом сернистой кислоты. Ее формула – H2SO3.
Стоит еще отметить, что натриевая соль уксусной кислоты при нагревании со щелочью декарбоксилируется (молекула диоксида углерода исключается), в результате чего образуется метан (CH₄).
А он, как известно, представляет собой простейший углеводород, являющийся легче воздуха.
Кристаллизация
Ледяная уксусная кислота – нередко рассматриваемое соединение называют именно так. Дело в том, что она при охлаждении всего до 15-16 °C переходит в кристаллическое состояние, как будто бы замерзает. Визуально это действительно очень похоже на лед.
При наличии нескольких ингредиентов можно провести эксперимент, результатом которого станет превращение уксусной кислоты в ледяную. Все просто. Из воды и льда нужно приготовить охлаждающую смесь, а потом опустить в нее подготовленную заранее пробирку с уксусной кислотой. Через несколько минут она кристаллизуется.
Кроме соединения, для этого нужен химический стакан, штатив, термометр и пробирка.
Вред вещества
Уксусная кислота, химическая формула и свойства которой были перечислены выше, является небезопасной. Ее пары оказывают раздражающее действие на слизистые оболочки верхних дыхательных путей.
Порог для восприятия запаха этого соединения, находящегося в воздухе, находится в районе 0,4 мг/л. Но есть еще понятие предельно допустимой концентрации – санитарно-гигиенический норматив, утвержденный в законодательном порядке.
Согласно ему, в воздухе может находиться до 0,06 мг/м³ этого вещества. А если речь идет о рабочих помещениях, то предел возрастает до 5 мг/м3.

Губительность действия кислоты на биологические ткани напрямую зависит от того, как сильно она разбавлена водой. Наиболее опасны растворы с содержанием этого вещества более 30 %.
А если человек случайно вступит в контакт с концентрированным соединением, то ему не удастся избежать химических ожогов.
Этого категорически нельзя допустить, поскольку после этого начинают развиваться коагуляционные некрозы – отмирание биологических тканей. Смертельная доза составляет всего 20 мл.
Последствия
Логично, что чем выше концентрация уксусной кислоты, тем больший вред она окажет в случае попадания ее на кожу или внутрь организма. К общим симптомам отравления относят:
- Ацидоз. Кислотно-щелочной баланс смещается в сторону увеличения кислотности.
- Сгущение крови и нарушение ее свертываемости.
- Гемолиз эритроцитов, их разрушение.
- Поражение печени.
- Гемоглобинурия. В моче появляется гемоглобин.
- Острая почечная недостаточность.
- Токсический ожоговый шок.
Степени тяжести
Принято выделять три:
- Легкая. Характеризуется небольшими ожогами пищевода и ротовой полости. Но сгущение крови отсутствует, а внутренние органы продолжают функционировать нормально.
- Средняя. Наблюдается интоксикация, шок и сгущение крови. Желудок поражен.
- Тяжелая. Сильно страдают верхние дыхательные пути, стенки пищеварительного тракта, развивается почечная недостаточность. Болевой шок максимальный. Возможно развитие ожоговой болезни.

Отравление парами уксусной кислоты тоже возможно. Оно сопровождается сильным насморком, кашлем и слезотечением.
Оказание помощи
Если человек отравился уксусной кислотой, то очень важно быстро действовать для минимизирования последствий от случившегося. Рассмотрим, что надо делать:
- Прополоскать ротовую полость. Воду не проглатывать.
- Сделать зондовое промывание желудка. Потребуется 8-10 литров холодной воды. Даже кровяные примеси – не противопоказание. Потому что в первые часы отравления большие сосуды еще остаются целыми. Так что опасного кровотечения не будет. Перед промыванием нужно сделать обезболивание анальгетиками. Зонд смазывается вазелиновым маслом.
- Рвоту не вызывать! Нейтрализовать вещество можно жженой магнезией или препаратом «Альмагель».
- Нет ничего из перечисленного? Тогда пострадавшему дают лед и подсолнечное масло – надо сделать несколько глотков.
- Допустимо употребление пострадавшим смеси из молока и яиц.
Важно оказать первую помощь в течение двух часов после случившегося. По истечении данного срока слизистые оболочки сильно отекают, и уже уменьшить боль человека будет сложно. И да, ни в коем случае нельзя использовать соду. Сочетание кислоты и щелочи даст реакцию, в ходе которой выработается углекислый газ и вода. А такое образование внутри желудка может привести к летальному исходу.
Применение
Водные растворы этановой кислоты широко используются в пищевой промышленности. Это уксусы. Для их получения кислоту разводят водой, чтобы получился 3-15-процентный раствор. Как добавка они обозначаются маркировкой Е260.
Уксусы входят в состав различных соусов, а еще их используют для консервирования продуктов, маринования мяса и рыбы. В быту они широко применимы для удаления накипи, пятен с одежды и посуды. Уксус – прекрасный дезинфектор. Им можно обработать любую поверхность.
Иногда его добавляют при стирке, чтобы смягчить одежду.

Также уксус применим в получении душистых веществ, лекарственных средств, растворителей, в производстве ацетона и ацетилцеллюлозы, например. Да, и в крашении и книгопечатании уксусная кислота принимает непосредственное участие.
Кроме всего, ее используют как реакционную среду для проведения окисления самых разных органических веществ.
Примером из промышленности можно считать окисление параксилола (углеводород ароматического ряда) кислородом воздуха в терефталевую ароматическую кислоту.
Кстати, так как пары этого вещества имеют резкий раздражающий запах, его можно использовать как замену нашатырного спирта для выведения человека из обморочного состояния.
Синтетическая уксусная кислота
Это легковоспламеняющаяся жидкость, которая относится к веществам третьего класса опасности. Она используется в промышленности. При работе с ней применяются индивидуальные средства защиты. Хранят это вещество в особых условиях и только в определенной таре. Как правило, это:
- чистые железнодорожные цистерны;
- контейнеры;
- автоцистерны, бочки, емкости из нержавеющей стали (вместимость до 275 дм3);
- стеклянные бутыли;
- полиэтиленовые бочки вместимостью до 50 дм3;
- герметичные резервуары из нержавеющей стали.

Если жидкость хранят в полимерной таре, то это как максимум месяц. Также категорически не допускается совместное хранение данного вещества с такими сильными окислителями, как перманганат калия, серная и азотная кислоты.
Состав уксуса
О нем тоже стоит сказать пару слов. В состав традиционного, всем привычного уксуса входят следующие кислоты:
- Яблочная. Формула: НООССН₂СН(ОН)СООН. Является распространенной пищевой добавкой (Е296) природного происхождения. Содержится в незрелых яблоках, малине, рябине, барбарисе и винограде. В табаке и махорке представлена в виде солей никотина.
- Молочная. Формула: CH₃CH(OH)COOH. Формируется при распаде глюкозы. Пищевая добавка (Е270), которую получают молочнокислым брожением.
- Аскорбиновая. Формула: C₆H₈O₆. Пищевая добавка (Е300), применяемая как антиоксидант, предотвращающий окисление продукта.
И конечно же, этановое соединение в состав уксуса тоже входит – это основа данного продукта.
Как разбавить?
Это часто задаваемый вопрос. Все видели в продаже уксусную кислоту 70 %. Ее покупают, чтобы готовить смеси для народного лечения, или для использования в качестве приправы, маринада, добавки в соус или закатку. Но нельзя применять такой мощный концентрат.
Поэтому появляется вопрос о том, как развести до уксуса уксусную кислоту. Для начала нужно себя обезопасить – надеть перчатки. Затем следует подготовить чистую воду. Для растворов различных концентраций понадобится определенное количество жидкости.
Какое? Что ж, смотрим на приведенную ниже таблицу и разводим уксусную кислоту с учетом данных.
| Концентрация уксуса | Начальная концентрация уксуса 70 % |
| 30 | 1:1,5 (соотношение – одна часть уксуса на энную часть воды) |
| 10 | 1:6 |
| 9 | 1:7 |
| 8 | 1:8 |
| 7 | 1:9 |
| 6 | 1:11 |
| 5 | 1:13 |
| 4 | 1:17 |
| 3 | 1:22 |
В принципе, ничего сложного. Чтобы получить 9-процентный раствор, надо взять количество воды в миллилитрах по данной формуле: 100 грамм уксуса умножить на начальный показатель (70 %) и поделить на 9.
Что получается? Цифра 778. Из этого отнимается 100, так как изначально было взято 100 грамм кислоты. Получается 668 миллилитров воды. Это количество и смешивается с 100 г уксуса.
Результат – целая бутылка 9-процентного раствора.
Хотя, действовать можно еще проще. Многих интересует, как сделать уксус из уксусной кислоты. Легко! Главное — помнить, что на одну часть 70-процентного раствора надо взять 7 частей воды.
Источник: https://www.syl.ru/article/365993/uksusnaya-kislota-himicheskaya-formula-svoystva-i-primenenie
Формула уксусной кислоты
ОПРЕДЕЛЕНИЕ
Уксусная кислота (этановая кислота, метанкарбоновая кислота) представляет собой органическое вещество с формулой ( mathrm{CH}_{3} mathrm{COOH} ) . Слабая, маргинальная одноосная карбоновая кислота.
- Химические и структурные формулы уксусной кислоты
- Химическая формула: ( mathrm{CH}_{3} mathrm{COOH} )
- Валовая формула: ( mathrm{C} 2 mathrm{H} 4 mathrm{O} 2 )
- Структурная формула:
Структурно-химическая формула уксусной кислоты
Молярная масса: 60,05 г / моль.
Уксусная кислота является терминальной одноосновной карбоновой кислотой. Соли формы — ацетаты.
Слабая кислота, константа диссоциации Ka = 1,75 • 10-5, pKa = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота представляет собой бесцветную жидкость с острым характерным запахом, кислым вкусом. Гигроскопично, растворим в воде на неопределенный срок. Существует в виде димеров. Безводная уксусная кислота называется льдом, потому что она образует ледяную массу, когда она замерзает.
- Химические свойства уксусной кислоты
- Уксусная кислота обладает всеми основными свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
- ( M g+2 C H_{3} operatorname{COOH}=left(C H_{3} C O O
ight)_{2} M g+H_{2} uparrow ) - Взаимодействует с оксидами металлов:
- ( mathrm{CaO}+2 mathrm{CH}_{3} mathrm{COOH}=left(mathrm{CH}_{3} mathrm{COO}
ight)_{2} mathrm{Ca}+mathrm{H}_{2} mathrm{O} ) - Взаимодействует с гидроксидами металлов:
- ( mathrm{NaOH}+mathrm{CH}_{3} mathrm{COOH}
ightarrow mathrm{CH}_{3} mathrm{COONa}+mathrm{H}_{2} mathrm{O} ) - В присутствии серной кислоты происходит реакция этерификации с образованием сложных эфиров:
- ( mathrm{CH}_{3} mathrm{COOH}+_{2} mathrm{H}_{5}
ightarrow mathrm{CH}_{3} mathrm{COOC}_{2} mathrm{H}_{5}+2 mathrm{H}_{2} mathrm{O} ) - Он входит в реакции галогенирования с образованием галогенуксусных кислот:
- ( mathrm{CH}_{3} mathrm{COOH}+mathrm{Cl}_{2}
ightarrow mathrm{CH}_{2} mathrm{ClCOOH}+mathrm{HCl} ) - Реакция горения:
- ( mathrm{CH}_{3} mathrm{COOH}+mathrm{O}_{2}
ightarrow mathrm{CO}_{2}+2 mathrm{H}_{2} mathrm{O} ) - Качественная реакция на соли уксусной кислоты представляет собой взаимодействие с сильными кислотами. Уксусная кислота слабая и замещается сильными кислотами из солевых растворов, в то время как характерный запах появляется:
- ( mathrm{CH}_{3} mathrm{COO}^{-}+mathrm{H}^{+}
ightarrow mathrm{CH}_{3} mathrm{COOH} ) - Чек. Наиболее экономически выгодным промышленным способом получения уксусной кислоты является карбонилирование метанола монооксидом углерода, катализатором являются родиевые соли, а промотором являются иодидные ионы:
- ( mathrm{CH}_{3} mathrm{OH}+mathrm{CO}
ightarrow mathrm{CH}_{3} mathrm{COOH} ) - Биохимический метод — окисление этанола:
- ( mathrm{CH}_{3} mathrm{CH}_{2} mathrm{OH}+mathrm{O}_{2}
ightarrow mathrm{CH}_{3} mathrm{COOH}+mathrm{H}_{2} mathrm{O} )
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), домашняя кулинария и консервирование. Уксусная кислота используется для получения лекарственных и ароматических веществ в качестве растворителя.
- Концентрированная уксусная кислота (с концентрацией более 30%) может вызвать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей
- Примеры решения проблем
- ПРИМЕР 1
Рассчитать ( mathrm{pH} ) раствора уксусной кислоты с молярной концентрацией 1 моль / л, константа диссоциации которой составляет 1,75 • 10-5.
- Напишите уравнение диссоциации для уксусной кислоты:
- ( mathrm{CH}_{3} mathrm{COOH} leftrightarrow mathrm{CH}_{3} mathrm{COO}^{-}+mathrm{H}^{+} )
- Константа диссоциации кислоты:
- ( K_{a}=frac{left[C H_{3} C O O^{-}
ight]left[H^{+}
ight]}{left[C H_{3} C O O H
ight]} ) - Обозначим через ( x ) концентрацию ионов водорода ( x=[mathrm{H}+] ), то выражение для константы диссоциации принимает вид:
- ( K_{a}=frac{x^{2}}{C-x} )
- Отсюда
- ( x=sqrt{K_{a}(C-x)} )
- Поскольку уксусная кислота слабая, ( x < C ), полученное выражение может быть упрощено:
- ( x=sqrt{K_{a} C}=sqrt{1,75 cdot 10^{-5} cdot 1}=0,004183 моль/л )
- ( mathrm{pH} ) — отрицательный десятичный логарифм равновесной концентрации ионов водорода ( mathrm{H}+ ). Так как ( x=[H+] ), то
- ( p H=-l gleft[H^{+}
ight]=-l g(0,004183)=2,38 ) - ( mathrm{PH} ) раствора составляет 2,38.
- ПРИМЕР 2
Рассчитать ( mathrm{pH} ) раствора, полученного добавлением 5 мл 0,1 М раствора гидроксида натрия до 10 мл 0,1 М раствора уксусной кислоты. Константа диссоциации уксусной кислоты составляет Kа = 1,75 • 10-5.
- Общий объем решения будет равен:
- ( left(C H_{3} C O O H
ight)+Vмл ) - При осушении растворов происходит реакция:
- ( mathrm{CH}_{3} mathrm{COOH}+mathrm{NaOH}=mathrm{CH}_{3} mathrm{COONa}+mathrm{H}_{2} mathrm{O} )
- Рассчитайте количество вещества уксусной кислоты и гидроксида натрия:
- ( n_{mathrm{исх}}left(mathrm{CH}_{3} mathrm{COOH}
ight) =C_{M operatorname{исх}}left(C H_{3} C O O H
ight) .V_{mathrm{исх}}left(C H_{3} C O O H
ight) =0,1 cdot 0,01=0,001 моль ) - ( n_{исх}(N a O H) =C_{M operatorname{исx}}(N a O H) .V_{mathrm{исx}}(mathrm{NaOH}) =0,1 cdot 0,005=0,0005моль )
Согласно уравнению реакции ( mathrm{n}(mathrm{CH} 3 mathrm{COOH})=mathrm{n}(mathrm{NaOH}) ), и в нашем случае ( mathrm{n}(mathrm{CH} 3 mathrm{COOH})>mathrm{n}(mathrm{NaOH}) ), поэтому уксусная кислота берется в избытке. После реакции уксусная кислота и ацетат натрия, то есть мы получили буферную систему.
- Рассчитайте концентрацию ацетата натрия в полученном растворе:
- ( nleft(C H_{3} C O O N a
ight)=n(N a O H)=0,0005моль ) - ( Cleft(C H_{3} C O O N a
ight)=nleft(C H_{3} C O O N a
ight) / V=0,0005 / 0,015=0,033моль/л ) - Концентрация уксусной кислоты в растворе будет равна:
- ( nleft(C H_{3} C O O H
ight)= n_{исх}left(C H_{3} C O O H
ight) -n_{исх}(N a O H) =0,001-0,0005=0,0005моль ) - ( Cleft(C H_{3} C O O
ight)=nleft(C H_{3} C O O
ight) / V=0,0005 / 0,015=0,033 моль/л ) - Концентрация ионов водорода в буферном растворе рассчитывается по формуле:
- ( left[mathrm{H}^{+}
ight]=frac{K_{a} cdot C_{mathrm{CH}, mathrm{COOH}}}{C_{mathrm{CH}_{2} mathrm{COON}_{2}}} ) - где Ka — константа диссоциации уксусной кислоты.
- Затем:
- ( left[H^{+}
ight]=frac{K_{a} cdot C_{C H_{3} C O O H}}{C_{C H_{3} C O O N a}}=frac{1,74 cdot 10^{-5} cdot 0,033}{0,033}=1,74 cdot 10^{-5} моль/л) - Рассчитайте ( mathrm{pH} ) раствора:
- ( p H=-l gleft[H^{+}
ight]=-l gleft(1,74 cdot 10^{-5}
ight)=4,76 )
рН полученного раствора составляет 4,76.
Источник: https://sciterm.ru/spravochnik/formula-uksusnoj-kisloti/
Уксусная кислота — это… Что такое Уксусная кислота?
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа».
«Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна».
Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии.[1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов на самом деле являются двумя разными веществами.
Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреа Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Августом Адэ (фр. Pierre Auguste Adet)[1].
Завод, производящий уксусную кислоту. 1884 год.
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов.
Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена.
Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.[2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.[1][3]
Физические свойства
Ледяная уксусная кислота
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров[4].
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| четыреххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
-
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
- Уксусная кислота образует тройные азеотропные смеси
Получение
- Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
2 CH3CHO + O2 → 2 CH3COOH
В промышленности
Окислительные методы
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[5].
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[5].
Каталитическое карбонилирование метанола
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода[6], которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом.[7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году.[8][9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.[10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта[11].
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением[12]:
СН3СН2ОН + О2 → СН3СООН + Н2О
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.[13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Mg(тв) + 2CH3COOH → (CH3COO)2Mg + H2
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
CH3COOH + Cl2 → CH2ClCOOH + HCl
Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-15 % — уксусом[14]. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³.[4]
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %.[4] Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[15].
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[16]. Смертельная доза составляет примерно 20 мл.
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Примечания
Источник: https://dic.academic.ru/dic.nsf/ruwiki/53250





