

Сахароза — органическое вещество с кристаллической решеткой. Другое название — сахар. Это дисахарид, образованный остатками двух моносахаридов — фруктозы и глюкозы.
Узнаем больше о сахарозе, ее строении, формуле, физических и химических свойствах и о том, какую пользу играет она для живых организмов.
Формула и строение сахарозы
Структурная формула — C12H22O11, хотя она происходит от соединения двух простых сахаров, таких как глюкоза и фруктоза.

Два кольца этих сахаров объединены отдельным атомом кислорода, соединенным с двумя атомами углерода в цепочке. Другое расширение атома в молекуле также присутствует, главным образом, в комбинациях кислорода и водорода.
Связь между моносахаридами имеет O-глюкозидный тип. Кроме того, эта связь является дикарбонильной.
Физические свойства
По своим физическим свойствам она обладает сладким вкусом, может кристаллизоваться и растворима в воде.

Когда сахароза достигает желудка, она подвергается кислотному гидролизу и разлагается на части: на глюкозу и фруктозу. Остальная часть сахарозы переходит в тонкий кишечник, где ферментная сахароза преобразует ее в глюкозу и фруктозу.
Подчеркиваются ее специфические свойства в качестве питательного вещества для организма человека: она легко усваивается и не выделяет токсичных веществ. Это означает, что сахароза обладает как свойствами глюкозы, так и свойствами фруктозы, что означает, что она является источником энергии для организма.

Существует множество противоречий по поводу вреда, наносимого потреблением сахарозы, и несколько теорий по этому поводу. Основные дебаты сосредоточены на развитии кариеса, диабета, ожирения, атеросклероза и других патологий.
Интересно, что сахароза является триболюминесцентной, производящей свет механическим действием.
Благодаря низкой температуре плавления 1860С она очень быстро становится жидкой, очень легко прилипает к контейнеру, в котором она находится, может запросто обжечь кожу, если не соблюдать меры безопасности. Температура кипения раствора равна 101,40С.
Основные свойства описаны в таблице:
| Физические свойства сахарозы | |
| Молярная масса | 342,3 г/моль |
| Температура плавления | 1860С |
| Растворимость | 211,5 г / 100 мл |
| Плотность | 1,587 г/см3 |
Химические свойства
В молекуле сахарозы есть гидроксильные группы. Рассмотрим основные уравнения химических реакций сахарозы.
Реакция гидролиза
- Сахароза способна подвергаться гидролизу, во время которого она распадается на моносахариды (глюкозу и фруктозу):
- C12H22O11 + H2O → C6H12O6 + C6H12O6.

Реакции окисления
Дисахариды, которые сохраняют полуацетальный гидроксил, называются восстанавливающими. Дисахариды без полуацетального гидроксила называются невосстанавлиающими. Сахароза не является альдегидом.
Пример каталитического окисления сахарозы кислородом воздуха:
C12H22O11 + 12 O2 → 12 CO2 + 11 H2O.
Качественная реакция с гидроксидом меди

Как провести лабораторный опыт:
- лабораторное оборудование: пробирка, горелка;
- реагенты: водный раствор сахарозы, гидроксид меди (II);
- действия: залейте раствор сахарозы в пробирку, добавьте гидроксид меди (II), разогрейте пробирку над горелкой:
- C12H22O11 + 2 Cu (OH)2 → ярко-синее окрашивание;
- Замечания: синий осадок не изменил цвет, несмотря на подачу энергии в виде тепла;
- Вывод: сахароза не обладает восстановительными свойствами.
Нахождение сахарозы в природе
Она обычно извлекается из сахарного тростника, свеклы или кукурузы.

- Сахарный тростник
- Другими коммерческими (незначительными) источниками являются сладкий сорго и кленовый сироп.
Получение сахарозы

Сахароза извлекается из сырья, в котором она содержится, а затем очищается и кристаллизуется.
Применение и биологическая роль сахарозы
Широкое применение сахарозы обусловлено ее способностью к подслащению и свойствами функциональной консистенции. По этой причине она важна для структуры некоторых продуктов питания, особенно кондитерских изделий.

- Также является вспомогательным компонентом в сохранении пищи, будучи добавкой, широко используемой в приготовлении так называемой нездоровой пищи.
- В проросших семенах растений жиры и белки, находящиеся на хранении, превращаются в сахарозу для транспортировки в процессе развития растений.
- Главная функция сахарозы в организме человека — она помогает вырабатывать энергию, необходимую для функционирования различных органов.
Источник: https://nauka.club/khimiya/sakharoza.html
Сахароза | Химия онлайн
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11.
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:

Сахароза. Строение
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
- Для сахарозы характерны реакции по гидроксильным группам.
- 1. Качественная реакция с гидроксидом меди (II)
- Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
- Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
- Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):

- 2. Реакция окисления
- Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
- Реакция «серебряного зеркала»

- Реакция с гидроксидом меди (II)
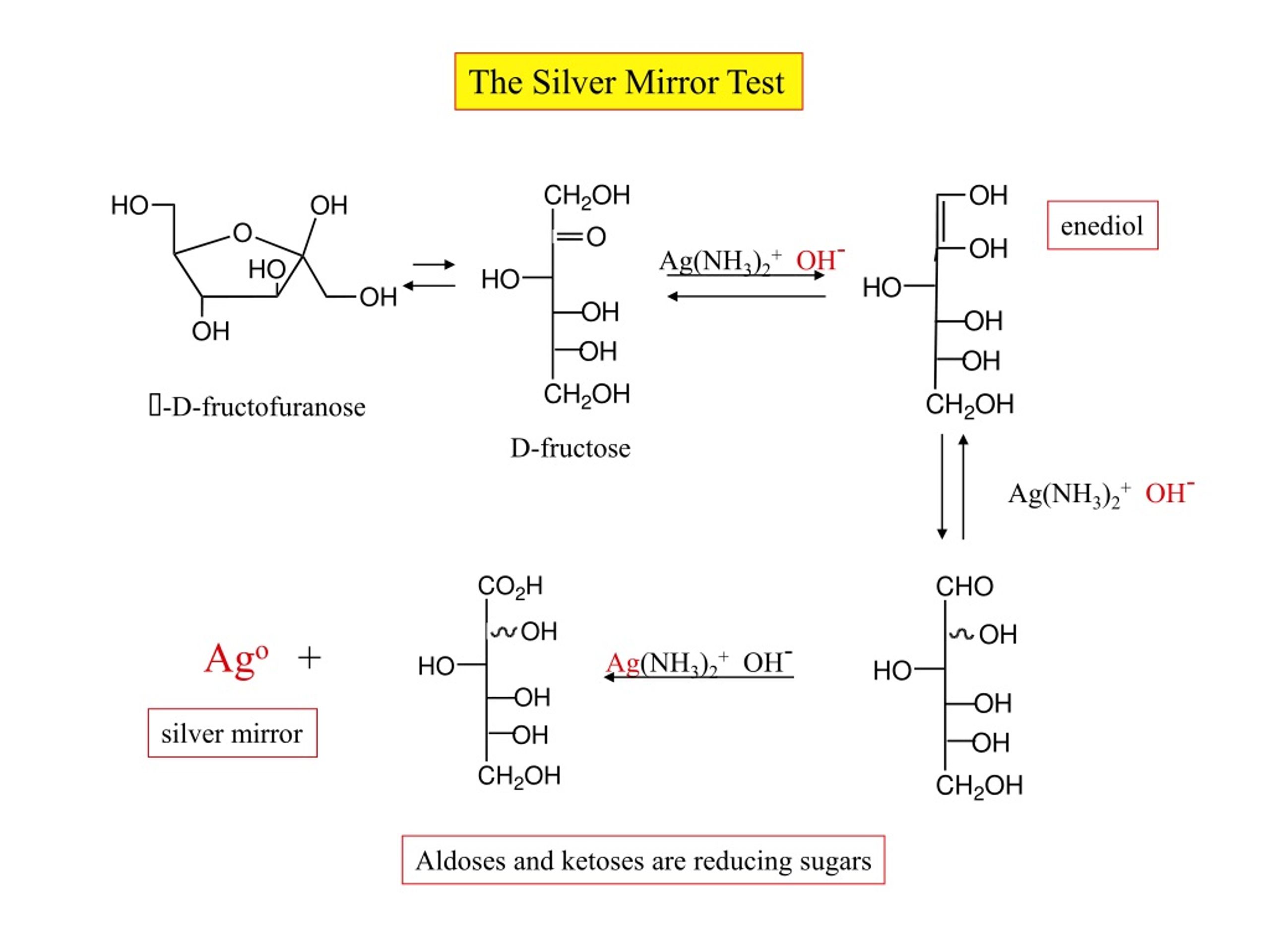
- Невосстанавливающий дисахарид
- Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
- Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
- 3. Реакция гидролиза
- Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
- Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:

- Видеоопыт «Кислотный гидролиз сахарозы»
- Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):

- Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
- В живых организмах гидролиз дисахаридов происходит при участии ферментов.
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.).
чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок.
Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.

Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
- В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).

- Углеводы
- Олигосахариды. Дисахариды
Источник: https://himija-online.ru/organicheskaya-ximiya/uglevody/saxaroza.html
Сахароза, свойства, получение и применение
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
Сахароза, формула, молекула, строение, вещество:
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
В быту сахароза именуется сахаром, тростниковым сахаром или свекловичным сахаром.
Олигосахариды – это углеводы, содержащие от 2 до 10 моносахаридных остатков. Дисахариды – углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Сахароза является весьма распространённым в природе дисахаридом. Она встречается во многих фруктах, плодах, ягодах, в стеблях и листьях растений, в соке деревьев.
Особенно велико содержание сахарозы в сахарной свёкле, сахарном тростнике, сорго, сахарном клене, кокосовой пальме, финиковой пальме, аренге и иных пальмах, которые используются для промышленного производства пищевого сахара.
- Химическая формула сахарозы C12H22O11.
- Аналогичную общую химическую формулу имеют и другие дисахариды: лактоза, состоящая из остатков глюкозы и галактозы, и мальтоза, состоящая из остатков глюкозы.
- Строение молекулы сахарозы, структурная формула сахарозы:
-

- Молекула сахарозы образована из двух остатков моносахаридов – α-глюкозы и β-фруктозы, соединённых между собой атомом кислорода и связанных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных гидроксилов) – (1→2)-гликозидной связью.
- Систематическое химическое наименование сахарозы: (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-дигидрокси-2,5-бис(гидроксиметил)оксолан-2-ил]окси-6-(гидроксиметил)оксан-3,4,5-триол.
- Используется также и другое химическое название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид.
Сахароза по внешнему виду сахароза представляет собой белое кристаллическое вещество. На вкус более сладкая, чем глюкоза.
Сахароза очень хорошо растворяется в воде. Малорастворима в этаноле и метаноле. Не растворима в диэтиловом эфире.
Сахароза, попадая в кишечник, под действием ферментов быстро гидролизуется на глюкозу и фруктозу, после чего всасывается и попадает в кровь.
Температура плавления сахарозы 160 °C. Расплавленная сахароза застывает, образуя аморфную прозрачную массу – карамель.
Если расплавленную сахарозу продолжить нагревать, то при температуре 186 °C сахароза разлагается с изменением окраски – с прозрачной на коричневую.
Сахароза служит источником глюкозы и важнейшим источником углеводов для организма человека.
Физические свойства сахарозы:
| Наименование параметра: | Значение: |
| Цвет | белый, бесцветный |
| Запах | без запаха |
| Вкус | сладкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое кристаллическое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см3 | 1,587 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1587 |
| Температура разложения, °C | 186 |
| Температура плавления, °C | 160 |
| Температура кипения, °C | — |
| Молярная масса сахарозы, г/моль | 342,2965 ± 0,0144 |
Химические свойства сахарозы. Химические реакции (уравнения) сахарозы:
Основные химические реакции сахарозы следующие:
- реакция сахарозы с водой (гидролиз сахарозы):
С12Н22О11 + Н2О → С6Н12O6 + С6Н12O6 (tо, kat = H2SO4, HCl).
При гидролизе (при нагревании в присутствии ионов водорода) сахароза расщепляется на составляющие ее моносахариды за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования сахарозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него сахарозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на глюкозу и фруктозу.
- качественная реакция на сахарозу (реакция сахарозы с гидроксидом меди):
2С12Н22О11 + Cu(OH)2 → Cu(C12H21O11)2 + 2Н2О, или
2C12H20O9(OH)2+Cu(OH)2 → Cu(C12H20O9(O)(OH))2+2H2O.
В молекуле сахарозы имеется несколько гидроксильных групп. Для подтверждения их наличия используют реакцию с гидроксидами металлов, например, с гидроксидом меди.
Для этого к раствору сахарозы добавляют гидроксид меди. В результате образуется сахарат меди, а раствор окрашивается в ярко-синий цвет.
- не дает реакцию «серебряного зеркала»:
Альдегидной группы в сахарозе нет. Поэтому она при нагревании с аммиачным раствором оксида серебра не дает реакцию «серебряного зеркала», т.к. сахароза не способна превращаться в открытую форму, содержащую альдегидную группу.
Кроме того, при нагревании с гидроксидом меди (II) сахароза не образует красного оксида меди (I).
Реакция «серебряного зеркала» и реакция с гидроксидом меди (II) с образованием красного оксида меди (I) характерны для лактозы и мальтозы.
Поэтому сахарозу еще именуют невосстанавливающим дисахаридом, т.к. она не восстанавливает Ag2O и Cu(OH)2.
Получение и производство сахарозы:
Сахароза содержится во многих фруктах, плодах, ягодах, в стеблях и листьях растений, в соке деревьев. Поэтому получение сахарозы связано с выделением ее из ее источников: сахарного тростника, сахарной свеклы и пр.
Получение сахарозы из сахарного тростника:
Сахарный тростник является основной мировой культурой для производства сахара. На его долю приходится до 65 % мирового производства сахара.
Сахарный тростник до начала цветения срезают. Срезанные стебли измельчают и размалывают.
Из полученной массы отжимают сок, в котором содержится до 0,03 % белковых веществ, 0,1 % зернистых веществ (крахмала), 0,22 % азотосодержащей слизи, 0,29 % солей (большей частью органических кислот), 18,36 % сахара, 81 % воды и очень небольшое количество ароматических веществ, придающих сырому соку своеобразный запах.
Для очистки сока к нему добавляют свежегашеную известь – Са(ОН)2 и нагревают. Сахароза вступает в химическую реакцию с гидроксидом кальция, в результате чего образуется растворимый в воде сахарат кальция. Кроме того, другие вещества, содержащиеся в соке, также вступают в реакцию с гидроксидом кальция, образуя малорастворимые и нерастворимые соли, которые выпадают в осадок и отфильтровывают.
Затем через раствор, чтобы разложить сахарат кальция и нейтрализовать избыточный гидроксид кальция, пропускают углекислый газ – СО2. В итоге образуется карбонат кальция – СаСО3, который выпадает в осадок. Выпавший в осадок карбонат кальция отфильтровывают, а раствор выпаривают в вакуумных аппаратах до получения кристаллов сахарозы.
На данной стадии производства сахароза все еще содержит примеси – мелассу и имеет коричневый цвет. Меласса придает сахарозе ярко выраженный естественный аромат и вкус. Полученный продукт именуется коричневым сахаром или тростниковым нерафинированным сахаром. Он (коричневый сахар) пригоден в пищу.
Его можно использовать в пищу как есть либо подвергнуть дополнительной очистке.
На последней стадии производства сахарозу подвергают дополнительной очистке и обесцвечиванию. В конечном итоге получают рафинированный (очищенный) сахар, имеющий белый цвет.
Получение сахарозы из сахарной свеклы:
Сахарная свекла является двухлетним растением. В первый год собирают урожай корнеплодов и отправляют их на переработку.
На перерабатывающей фабрике корнеплоды промываются и измельчаются. Измельченные корнеплоды помещают в диффузоры (большие котлы) с горячей водой температурой 75 оС. Горячая вода вымывает из измельченных корнеплодов сахарозу и прочие компоненты. В итоге получается диффузионный сок, который в дальнейшем подвергается фильтрации от содержащихся в нем частичек мякоти.
На следующих стадиях производства сахара диффузионный сок очищают гидроксидом кальция и углекислым газом, уваривают, выпаривают на вакуумных аппаратах, подвергают дополнительной очистке, отбеливанию и центрифугированию. В итоге получают рафинированный сахар.
Получение сахарозы из сахарного клена:
Сахарозу из сахарного клена получают в восточных провинциях Канады.
В феврале-марте ствол сахарного клена просверливают. Из отверстий вытекает кленовый сок, который собирают. Он содержит до 3 % сахарозы.
Кленовый сок выпаривают, получая «кленовый сироп». Далее «кленовый сироп» очищают гидроксидом кальция и углекислым газом, выпаривают на вакуумных аппаратах, подвергают дополнительной очистке и отбеливанию, тем самым получая готовый продукт – сахар.
Применение сахарозы:
- в качестве продукта питания, а также для приготовления различных продуктов питания (кондитерских изделий, напитков, соусов и пр.)
- в кондитерской промышленности как консервант,
- используется для приготовления искусственного меда,
- в химической промышленности для производства этанола, бутанола, глицерина, лимонной кислоты, декстрана и пр.,
- в фармацевтической промышленности для изготовления различных лекарственных средств.
Ссылка на источник
Источник: https://allbreakingnews.ru/saxaroza-svojstva-poluchenie-i-primenenie/
Олиго- и полисахариды. Сахароза. Гидролиз сахарозы. Крахмал. Видеоурок. Химия 10 Класс
- Данный текст представляет собой неотредактированную версию стенограммы, которая в дальнейшем будет отредактирована.
- InternetUrok.ru
- Химия. 10 класс
Урок 60. Олиго- и полисахариды. Сахароза.
Гидролиз сахарозы. Крахмал
Загорский В.В., д.п.н., проф. Специализированного учебно-научного центра МГУ
(школа им. А.Н. Колмогорова при МГУ),
многократный лауреат грантов «Учитель Москвы»
17.03.2011 г.
При участии:
Морозовой Н.И., к.х.н., ст. преп. СУНЦ МГУ
Менделеевой Н.А., к.х.н., доц. СУНЦ МГУ
Олиго- и полисахариды, сахароза, гидролиз сахарозы, крахмал
Здравствуйте.
Тема сегодняшнего урока – «Олиго- и полисахариды».
Молекулы углеводов моносахаридов способны взаимодействовать друг с другом, образуя цепи различной длины. Посмотрим, как это происходит.
Взаимодействие происходит по механизму образования простых эфиров. Известно, что две молекулы спирта, одинаковые или разные, могут взаимодействовать друг с другом с выделением молекулы воды и образованием связи углерод – кислород, который и называется связью в простом эфире. Точно такие же связи возникают между молекулами моносахаридов.
Например, из глюкозы и фруктозы легко образуется дисахарид – сахароза. Две молекулы моносахарида глюкозы взаимодействуют друг с другом в кислой среде, образуя дисахарид – мальтозу. Самый известный из дисахаридов и наиболее распространенный – это сахароза. В ее состав входят два моносахарида: глюкоза в виде 6 членного цикла и фруктоза в виде 5 членного цикла.
В отличие от составляющих ее моносахаридов сахароза не дает характерных реакций, например, для альдегидов. Все остальные свойства ее обычны. Сладкий вкус, растворимость в воде, способность давать карамели.
- А почему нет альдегидной реакции?
- Потому что, во-первых, глюкоза в сахарозе находится в циклической форме.
- Во-вторых, эта циклическая форма стабилизирована эфирной связью между двумя молекулами моносахаридов, поэтому реакции окисления не идут.
Только одна реакция сахарозы не характерна для составляющих ее моносахаридов. Разумеется, эта реакция обратная, т.е. гидролиз дисахарида в кислой среде или под действием ферментов с образованием исходных моносахаридов – глюкозы и фруктозы.
Кроме дисахарида широко распространены полисахариды, которые нам хорошо известны. Это крахмал и целлюлоза. Их формальный состав одинаков, т.е. это полимеры глюкозы. Тем не менее, свойства их существенно различаются.
Крахмал является составной частью очень многих пищевых продуктов. Он входит в состав хлеба, картофеля, всевозможных зерновых продуктов и ряда растений.
Молекула крахмала состоит из остатков a глюкозы. Структурную единицу одного звена можно представить себе следующим образом: крахмал, как полисахарид, способен гидролизоваться с образованием исходного моносахарида. Гидролиз идет либо в кислой среде при нагревании, либо под действием ферментов. Продуктом гидролиза является глюкоза.
В воде крахмал ведет себя специфически. В холодной воде крахмал практически не растворяется, а при нагревании и кипячении способен образовать вязкий раствор, так называемый крахмальный клейстер.
Рассмотрим эту реакцию на примере хорошо известного природного объекта – картофеля. Берем картофелину, разрезаем и на свежий разрез картофеля наносим рисунок йодом.
Видно, что коричневатая окраска йода постепенно превращается в несколько иной цвет. В разбавленных водных растворах это синеватый оттенок, на природном объекте это может быть почти черный или серо-черный оттенок.
Эта реакция характерна для всех природных продуктов, содержащих крахмал.
На основе этой реакции в химическом анализе используется так называемая йод-крахмальная бумага, которая содержит йодид калия и раствор крахмала.
Сегодня мы разобрали олиго- и полисахариды. На этом наш урок закончен.
До свидания.
Источник: https://interneturok.ru/lesson/chemistry/10-klass/uglevody/oligo-i-polisaharidy-saharoza-gidroliz-saharozy-krahmal
ПОИСК
При связывании двух молекул моносахарида образуются дисахариды. Связывание моносахаридов происходит в результате конденсации, при которой от двух гидроксильных групп, принадлежащих двум молекулам моносахаридов, отщепляется одна молекула воды.
Если у моносахаридов имеется несколько гидроксильных групп, дисахариды могут связываться несколькими различными способами. На рис. 25.10 изображены структуры трех распространенных дисахаридов сахарозы (пищевой сахар), мальтозы (солодовый сахар) и лактозы (молочный сахар). Слово сахар связано в нашем представлении с понятием сладкий .
Все сахара обладают сладким вкусом, но отличаются по интенсивности вызываемого ими вкусового ощущения. Сахароза примерно в шесть раз слаще лактозы, приблизительно в три раза слаще мальтозы, несколько слаще глюкозы, но зато примерно вдвое менее сладкая, чем фруктоза. Дисахариды могут гидролизоваться, т.е.
способны вступать в реакцию с водой, в присутствии какого-либо кислотного катализатора с образованием моносахаридов. Гидролиз сахарозы приводит к образованию смеси глюкозы и фруктозы, в форме называемой инвертированным сахаром, которая имеет более сладкий [c.456] Дисахариды.
— Наиболее распространенными в природе дисахаридами являются сахаро за (тростниковый сахар), лактоза (молочный сахар) и мальтоза, причем последняя в свободном состоянии встречается довольно редко. Большое значение имеют дисахариды мальтоза и целлобиоза, поскольку они представляют собой продукты гидролиза крахмала и целлюлозы соответственно.
По растворимости в воде дисахариды очень сходны с моносахаридами. Сахароза значительно менее устойчива к действию кислот, чем метилгликозиды, и легко расщепляется на О-глюкозу и -фруктозу при кислотном гидролизе, а также под действием фермента инвертазы.
Сахароза не восстанавливает фелингову жидкость и не дает производных с фенилгидразином, откуда следует, что обе ее структурные единицы не содержат свободных гликозидных гидроксилов, являющихся потенциальными карбонильными группами и, следовательно, в сахарозе оба моносахарида связаны друг с другом гликозидными связями.
В отличие от большинства сахаров сахароза легко кристаллизуется, по-видимому, из-за того, что она не подвергается мутаротации в растворе. Циклическая структура обоих моносахаридов сахарозы доказана путем гидролиза ее октаметилового эфира (Хеуорс, 1916). [c.555]
Опыт 115 Кислотный гидролиз сахарозы [c.107]
Опыт 180. Кислотный гидролиз сахарозы. Опыт 181, Наличие восстанавливающей спо [c.183]
Мы уже упоминали об этой реакции, с которой начались все систематические кинетические исследования вообще. При постоянно температуре, давлении и концентрации кислоты по данным поляриметрии, химического анализа, дилатометрии и калориметрии реакция мономолекулярна по сахарозе. Наблюдаемая константа скорости первого порядка растет с повышением концентрации ионов водорода, хотя и не строго пропорционально. Каталитический коэффициент /ск = = /с/сн+ несколько увеличивается с ростом сн+ и концентрации сахара. Скорость гидролиза не зависит от присутствия недиссоциированных кислот и ионов, отличных от ионов водорода. Таким образом, в данном случае мы имеем дело со специфическим катализом ионами водорода. Каталитический коэффициент для ионов дейтерия к Сц+ превышает /с/сн+ в 1,80 раз нри 18,71 °С и в 1,55 раз при 37,13 °С [55, 56], в отличие от реакции мутаротации глюкозы, для которой это отношение равно 0,64 (25 °С). Известно, что последняя из названных реакций относится к случаю общего (неспецифического) катализа. По-видимому, нри экспериментальных отношениях А б+//сн+ < 1 процесс относится к общему кислотно-основному катализу, а прн отношениях, превышающих единицу, имеет место специфический катализ ионами водорода. Для гидролиза сахарозы уже давно был предложен следующий механизм [c.320] В 1970 г. во всем мире было выработано около 70 млн. т сахара, полученного из сахарного тростника и сахарной свеклы. Маточный сироп, остающийся после удаления кристаллов сахара из упаренного раствора тростникового сахара (этот сироп содержит 55% сахара, из них 35—40% сахарозы и 15—20% инвертного сахара, т. е глюкозы и фруктозы), известен под названием черная патока или тростниковая меласса. Высококачественной мелассой является неочищенный сок сахарного тростника, в котором большая часть сахара превращена путем кислотного гидролиза в инвертный сахар она представляет собой 70—80%-ный раствор сахара, содержащий 22—27% сахарозы и 50—55% глюкозы и фруктозы. В свекловичной мелассе присутствует 48—52% сахарозы и практически нет инвертного сахара. Оба вида мелассы можно подвергать ферментации. Полученный при этом этанол, выход которого составляет 90% (считая на сахаристые вещества), очищают дистилляцией. [c.30]
При гидролизе в кислотной среде сахароза переходит вновь в моносахариды [c.226]
Кислотный гидролиз сахарозы [c.85]
Перегруппировка открыта К. Фрисом в 1908. ФРУКТОЗА (плодовый, или фруктовый, сахар левулоза), моносахарид сладкого вкуса (слаще сахарозы в 1,5 раза). В природе распростр. D-Ф. для ее Р-аномера (ф-ла I) t A 102—104 С, [а]г1 —132°, равновесное [а]о —93°.
Содержится в спелых фруктах, меде структурный фрагмент олигосахаридов (напр., сахарозы и раффинозы), полисахаридов (напр., инулина). Фосфаты Ф. — промежут. соед. в энергетич. обмене углеводов. Получ. мягким кислотным или ферментативным гидролизом сахарозы или фрук-танов.
Усваивается больными диабетом лучше, чем глюкоза. [c.635]
Сахароза — это сахар, который употребляют в пищу. Его кислотный гидролиз дает 1 моль О-глюкозы +1 моль О-фруктозы. (+)-Сахароза — не-восстанавливающий гликозид, как и метил-О-глюкозид.
(+)-Сахароза не образует озазон и не подвергается мутаротации, как другие гликозиды.
Это объясняется тем, что в молекуле (+)-сахарозы аномерные центры обоих сахаров соединяет гликозидная связь, а полуацетальная функция отсутствует. [c.492]
При кислотном гидролизе (НС1, H2SO4) сахарных сиропов концентрацией до 30 % СВ при pH около 1 и температуре 95—110°С в течение 10—15 мин сахароза полностью расщепляется до глюкозы и фруктозы, однако прн этом может образоваться от 50 до 440 мг/л оксиметилфурфурола — вещества, вредного для здоровья людей. [c.91]
Получение и применение. М. получают кислотным гидролизом полисахарвдов (напр., D-глюкозу-из крахмала, D-ксилозу-из богатых ксиланами отходов переработки с.-х. растений и древесины). Смесь глюкозы с фруктозой получают гидролизом сахарозы и используют в пшц. пром-сти. D-Глюкоза находит применение в медицине.
Восстановление D-глюкозы в D-сорбит и D-ксилозы в ксилит осуществляют в пром. масштабах водородом над никелевым катализатором. Е>-Сорбит служит исходным соед. в синтезе аскорбиновой к-ты (см. Витамин С) и наряду с ксилитом используется как обладающий сладким вкусом заменитель сахарозы при заболевании диабетом. Разнообразные М.
часто служат удобными хиральными исходными в-вами в синтезе сложных прир. соед. неуглеводной природы. [c.140]
Классификация. — Название гидраты углерода или углеводы возникло давно, поскольку Се-сахара (гексозы)—глюкоза и фруктоза имеют эмпирическую формулу СбН120е или Сб(Н20)б-Как известно, обе эти гексозы являются моносахаридами и образуются при кислотном гидролизе дисахарида сахарозы (химическое название гростникового сахара) [c.523]
Среди моносахаридов ранее других стали известны и были изучены О-глюкоза и О-фруктояа, образующиеся при кислотном гидролизе сахарозы (тростникового сахара) [c.492]
Проведение кислотного гидролиза инулина в мягких условиях сопровождается образованием дисахарида инулино-биозы, по сладости напоминающего сахарозу, с молекулярной массой 336 и углом вращения в воде [а]о =—72,4°. [c.39]
Следует отметить, что значение К из уравнения (5) не зависит от способа выражения концентрации. К имеет размерность, обратную времени, и обычно выражается в обратных секундах. Фактически, если не все, то большинство биохимических реакций, следующих кинетике мономолекулярной реакции, на самом деле бимолекулярны.
Если в бимолекулярной реакции один из видов молекул находится в большом избытке, так что убыль его концентрации относительно мала по сравнению с другими видами молекул, находящимися при более низких концентрациях, то скорость реакции принципиально будет зависеть от концентрации того вида молекул, которые находятся при меньших концентрациях, и, следовательно, реакция будет казаться мономолекулярной. Такой реакцией является кислотный гидролиз сахарозы. Несмотря на то, что эта реакция фактически бимолекуляр-на, она дает кинетику мономолекулярной реакции. Константа скорости, рассчитанная на основе мономолекулярной реакции, является поэтому истинной мерой ее скорости. Все реакции, следующие кинетике мономолекуляр-ных реакций, называются реакциями первого порядка, независимо от того, сколько видов реагирующих молекул в них участвует. [c.55]
Бенедикта. Как при кислотном гидролизе сахарозы, так и нри гидролизе ее под действием фермента са-харазы образуются одна молекула глюкозы и одна молекула фруктозы [c.298]
Ферментативная активность. При изучении биохимических особенностей культуры определяют активность протеиназ по разжижению желатины (скорость и характер разжижения при уколе столбика желатины, рис.
12) свертывание и пептонизацию молока (отмечается кислотное свертывание по покраснению синей лакмусовой бумаги с образованием устойчивого сгустка и коагуляции с последующей пептонизацией), а также пептонизацию без предварительного свертывания и скорость изменения молока активность амилазы по величине зоны гидролиза крахмала (проба с раствором Люголя на 3—4-е сутки посева культуры штрихом на крахмалоаммиачном агаре) активность целлюлозы по степени распада клетчатки на среде Гетчинсона активность р-фруктофуранозидазы (инвертазы) по гидролизу сахарозы (с помощью реактива Фелинга ) активность уреа-зы по накоплению аммиака (используется реактив Нес-слера), нитратредуктазы по восстановлению нитрата (на среде Гильтая) до нитрита (нитрит проверяют в кислой среде реактивом цинк-йод-крахмалом). [c.82]
Трегалоза химически более инертна, чем сахароза, и, в частности, очень устойчива к кислотному гидролизу. Путь биосинтеза трега лозы [уравнение (12-10)] полностью аналогичен таковому сахарозы. Трегалоза содержится в грибах, а акже у многих насекомых [8]. В ге [c.531]
В результате кислотного (даже под действием СОг и Н2О) или ферментативного (инвертаза) гидролиза сахарозы образуется смесь Д-глюкозы и -фруктозы (искусственный мед), называемая также инвертным сахаром, поскольку такая смесь в целом становится левовращающей из-за относительно большей величины удельного вращения плоскости поляризации света фруктозы (левовращающая), то есть инверсии (от лат lnversla — переворачива1ше) [c.786]
РАФФИНОЗА (6-0-а-0-галактопиранозил-а-П-глюкопи-ранозил-0-О-фруктофуранозид галактозилсахароза),- невосстанавливающий трисахарид (ф-ла I в ст. Олигосахариды) tn.1 118—120°С [аЬ -Ь 123° . раств. в воде, сп., уксусной к-те.
При мягком кислотном гидролизе образуется фруктоза и мелибиоза, при гидролизе ферментом а-галак-тозидазой галактоза и сахароза. Самый распространенный после сахарозы олигосахарид, встречается в своб. виде в сахарной свекле и др. растениях. Полупродукт в синтезе др.
углеводов, компонент питат. сред в микробиологии. [c.496]
При варке плодов с большим количеством сахара (на 1 часть плодов — 1 часть сахара) получают продукты с высокой концентрацией сахара (60—65% и выше) — варенье, джем, повидло и др.
При такой концентрации сахара в варенье не могут развиваться патогенные микроорганизмы, что предохраняет его от порчи, даже если банка не закрыта герметичесди. Варенье, особенно изготовленное из плодов с малой кислотностью, недостаточной для гидролиза сахарозы, может иногда засахариваться.
Для предупреждения этого добавляют при варке немного лимонной кислоты. В промышленном производстве варенья пользуются обязательно инвертным сахаром. [c.213]
Реакция кислотной инверсии сахарозы может ускоряться или замедляться при повышении давления в зависимости от природы катализатора [69, 70]. Если катализатор — сильная кислота (НС1, HgSOj), то инверсия незначительно замедляется при повышении давления если же катализатор — слабая кислота ( HjGOOH, Н3РО4), давление несколько ускоряет инверсию.
На инверсию сахарозы, катализируемую инвертазой, в отличие от кислотного гидролиза, давление практически не влияет [71, 72]. Таким образом, эффект давления в рассматриваемой реакции зависит от характера электролита, применяемого в качестве катализатора. Можно предположить, следовательно, что в данном случае катализатор входит в состав активированного комплекса.
[c.129]
Примером может служить гидролиз сахарозы, скорость которого зависит от кислотности раствора.
Эта зависимость не прямолинейна и различна для различных сильных кислот, если в качестве меры кислотности принимают концентрацию ионов водорода, вычисленную условно исходя из общей концентрации кислоты.
Если же оценивать кислотность на основе функции Гаммета, то экспериментальные точки для различных кислот (например, НСЮ , H2S0 , НС1, HNO3) лягут на одну прямую, указывая на точную пропорциональнасть между скоростью реакции и Aq. [c.160]
Смотреть страницы где упоминается термин Кислотный гидролиз сахарозы: [c.238] [c.96] [c.150] [c.219] [c.496] [c.62] [c.546] [c.547] [c.97] [c.150] [c.219] [c.135] [c.338] [c.563] [c.137] [c.31] [c.563] [c.271] [c.49] Смотреть главы в:
Практикум по органической химии -> Кислотный гидролиз сахарозы
Лабораторный практикум по органической химии Издание 2 -> Кислотный гидролиз сахарозы
Биохимия Издание 2 (1962) — [ c.68 ]
Сахароза
© 2019 chem21.info Реклама на сайте
Источник: https://www.chem21.info/info/1307166/
Опыт № 4 кислотный гидролиз сахарозы
- Реактивы:
- 1) Сахароза, 1 % раствор
- 2) Соляная кислота, 2 н. раствор
- 3) Сернокислая медь,
- 0,2 н. раствор
- 4) Резорцин
- Оборудование:
- 1) Пробирка
- 2) Спиртовка
- ХОД ОПЫТА
В пробирку помещают раствор сахарозы, и добавляют раствор соляной кислоты и воду и осторожно нагревают на пламени спиртовки 20-30 минут.
Половину раствора отливают пробирку и добавляют в не раствор щелочи (до щелочной среды по лакмусу) и воду. Затем добавляют раствор сернокислого меди и нагревают верхнюю часть синего раствора до кипения. Появляется оранжево – желтое окрашивание, доказывающее образование глюкозы.
К оставшейся части гидролизованого раствора сахарозы (первая проба) прибавляют кристаллик резорцина, соляной кислоты и нагревают до кипения. Появляется красноватое окрашивание, указывающее на образование фруктозы (реакция Селиванова).
Написать уравнения реакции.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Соляная кислота – так как серная кислота, вызывает сильный химический ожог вследствие обезвоживания тканей: сильный химический ожог глаз, слизистой желудка. Обмыть пораженное место водой не менее 5 минут: глаза промыть чистой водой не менее 10 минут: желудок промыть чистой водой не менее 3 – х раз. После промывания кожи примочить ее 2 % раствором гидрокарбоната натрия.
- МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
- К ЛАБОРАТОРНОЙ РАБОТЕ № 15
- ТЕМА 4.2 Крахмал и клетчатка
- ЦЕЛЬ РАБОТЫ: Исследование свойств крахмала и целлюлозы.
- ОПЫТ № 1 Реакция крахмал с йодом
- Реактивы:
- 1) Крахмальный клейстер,
- 2 % раствор
- 2) Йод, 0,1 н. раствор
- Оборудование:
- 1) Пробирки
- 2) Спиртовка
- ХОД ОПЫТА
В пробирку помещают (2:1) крахмального клейстера и раствор йода. Содержимое пробирки окрашивается в синий цвет. Полученную темно-синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь. Крахмал является неоднородным соединением. Он представляет собой смесь двух полисахаридов – амилозы (20 %) и амилопектозы (80 %).
Амилоза растворима в теплой воде и дает с йодом синее окрашивание. Состоит амилоза из почти неразветвленных цепей глюкозных остатков, обладающих структурой винта или спирали (примерно 6 глюкозных остатков в одном витке). Внутри спирали остается свободный канна около 5 мкм, в который могут внедряться посторонние молекулы, например, соединения амилозы с йодом.
Амилопектин в теплой воде не растворим, набухает в ней. Образуя крахмальный клейстер. В его состав входят разветвления цепи глюкозных остатков. Амилопектин с йодом дает красновато-фиолетовое окрашивание.
- ОПЫТ № 2 Кислотный гидролиз крахмала
- Реактивы:
- 1) Крахмальный клейстер
- 2) Серная кислота, 2 н. раствор
- 3) Едкий натр, 2 н. раствор
- 4) Реактив Фелинга
- 5) Раствор йода в калии йодистом, 0,1 н. раствор
- Оборудование:
- 1) Пробирки – 7шт
- 2) Спиртовка
- 3) Лакмусовая бумага с капиллярным отверстием
- 4) Водяная баня
- ХОД ОПЫТА
В 7 пробирок помещают очень разбавленной, почти бесцветной воды йода.
В отдельную пробирку приливают крахмального клейстера, раствор серной кислоты, взбалтывают содержимое и помещают пробирку в кипящую водяную баню.
Каждые 30 секунд пипеткой с капиллярным отверстием одну каплю раствора и переносят в очередную пробирку с водой йода. Последовательные пробы обнаруживают постепенное изменение окраски при реакции с йодом.
- Пробы:
- Первая
- Вторая
- Третья
- Четвертая
- Пятая
- Шестая
- Седьмая
- Окраска
- Синяя
- Сине-фиолетовая
- Красно-фиолетовая
- Красно-оранжевая
- Оранжевая
- Оранжево-желтая
- Светло-желтая
Раствор охлаждают, нейтрализуют раствором щелочи, на проб красной лакмусовой бумагой до сильно-щелочной реакции, добавляют реактив Фелинга и нагревают. Появляется красное окрашивание. Это доказывает, что конечным продуктом гидролиза является глюкоза.
Написать уравнение реакции.
При нагревании с разбавленными минеральными кислотами, а также подавлением и влиянием анзимов крахмал подвергается гидролизу. Гидролиз крахмала происходит ступенчато, с образованием все более простых углеводов.
Источник: https://infopedia.su/17x9b51.html




