Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH ® K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
| fЭ (формульная единица вещества) º эквивалент |
- В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
- Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
- H3PO4 + 3KOH ® K3PO4 + 3H2O fЭ(H3PO4) = 1/3
- H3PO4 + KOH ® KН2PO4 + H2O fЭ(H3PO4) = 1.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
| Частица | Фактор эквивалентности | Примеры |
| Элемент | , где В(Э) – валентность элемента | |
| Простое вещество | , где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента |
|
| Оксид | , где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента |
|
| Кислота | , где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) |
|
| Основание | , где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) |
|
| Соль | |
fЭ(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку) |
| Частица в окислительно-восстановительных реакциях | , где – число электронов, участвующих в процессе окисления или восстановления |
|
| Ион | , где z – заряд иона | fЭ(SO42–) = 1/2 |
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
- а) ZnCl2 (средняя соль):
-
 .
. - fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
- б) КНСО3 (кислая соль):
-
 .
. - fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
- в) (MgOH)2SO4 (основная соль):
-
 .
. - fЭ( (MgOH)2SO4 ) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
|
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента (или VЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». При н.у. получаем:
| |
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
| nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
| или или , |
- где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
- , – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
- V1, V2 – объемы реагентов и (или) продуктов реакции, л;
- ,– молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
Л.А. Яковишин
Источник: http://sev-chem.narod.ru/spravochnik/teoriya/eq.htm
Эквиваленты и эквивалентные массы
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов:массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы. Математическое выражение закона эквивалентов:
- где Мэк,1 и Мэк,2 — эквивалентные массы.
- Эквивалент — это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом или ионом водорода.
- Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
В одном атоме, одной молекуле или формульной единице вещества (В) может содержаться Z эквивалентов этого вещества. Число Z называют эквивалентным числом (или показателем эквивалентности). Обратная величина этого числа называется фактором эквивалентности. Фактор эквивалентности (f) — доля частицы, составляющая эквивалент.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 5. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода H2 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквиваленты одних и тех же элементов в различных химических соединениях могут различаться, т.к. величина эквивалента зависит от характера превращения, претерпеваемого им.
Так, в соединении SO2 эквивалентная масса серы равна 8 г/моль, что составляет 1/4 от атомной массы, а в соединении SO3 — 5,3 г/моль, что составляет 1/6 от атомной массы серы. Эквивалентное число серы в этих оксидах равно 4 и 6, т.е.
оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом, относительная эквивалентная масса и численно равная ей молярная масса элемента в соединении вычисляется по формуле:
- Мэк (элемента)= , (1.7)
- где А — атомная масса, w — степень окисления элемента в данном соединении.
- Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn) = = 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn) = = 18,3 г/моль.
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какой химической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
- 1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
- Мэк кислоты =

- 2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
- Мэк основания =

- Пример 6. Определить эквивалентную массу H2SO4 в реакциях:
- 1) H2SO4 + KOH = KHSO4 + H2O
- 2) H2SO4 + 2KOH = K2SO4 + 2H2O
Решение.В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(H2SO4) = 1, Мэк(H2SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(H2SO4) = 2, а Mэк(H2SO4) = 49 г/моль эк.
- Пример 7. Определить эквивалентную массу гидроксида висмута в реакциях:
- 1) Bi(OH)3 + HCl = Bi(OH)2Cl + H2O
- 2) Bi(OH)3 + 3HCl = BiCl3 + H2O
Решение.1)Z(Bi(OH)3) = 1, а Mэк(Bi(OH)3) = 260 г/моль эк, т.к. из трех гидроксид-ионов заместился один; 2) Z(Bi(OH)3) = 3, a Mэк(Bi(OH)3) = 260:3 = 86,3 г/моль эк, т.к. заместились все три иона ОН-).
- 3. Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
- Мэк. соли =

- или Мэк соли =

Например. в сульфате алюминия Al2(SO4)3 произведение заряда катиона на их число равно 3×2 = 6. Но эквивалентное число соединения в реакции может быть меньше (неполное замещение катионов) или больше (комплексообразование). Если, например, это соединение участвует во взаимодействии
- Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4,
- то при этом три сульфат-аниона с суммарным зарядом 6 замещаются двенадцатью гидроксид-ионами ОН-, следовательно, в этой реакции Z(Al2(SO4)3) = 12.
- 4. Эквивалентная масса оксида в реакциях полного замещения равна
- Мэк оксида =

- Например, Z(Fe2O3) = 3×2 = 6, Мэк = М(Fe2O3) = 160:6 = 26,6 г/моль эк. Но в реакции
- Fe2O3 + 4HCl = 2FeOHCl2 + H2O
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160:4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1 г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 8. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):

- Отсюда
- (г/моль), + ,
- следовательно
- г/моль эк.
Пример 9. Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17 °С и Р = 750 мм рт. ст.).
- Решение. 1) По уравнению Клапейрона–Менделеева вычисляем массу водорода:
- г
- Согласно закону эквивалентов
- ,
- следовательно
- = 32,6 г/моль эк.
Дата добавления: 2016-07-05; просмотров: 13909;
Источник: https://poznayka.org/s29315t1.html
Молярная масса эквивалента вещества
Вычислить молярные массы эквивалента вещества: хлорида цинка (ZnCl2), карбоната натрия (Na2CO3), гидроксида алюминия (Al(OH)3).
Решение задачи
Хлорид цинка (ZnCl2)относится к классу солей, в своем составе содержит один атом металла со степенью окисления +2. Эквивалентное число для соли находим по формуле:
![]()
- Получаем:
- z (ZnCl2 )= 1 ⋅ 2 = 2
- Молярная масса хлорида цинка (ZnCl2) равна:
- М (ZnCl2 ) = 65 + 2 ⋅ 35,5 = 136 (г/моль).
- Теперь можно вычислить молярную массу эквивалента вещества хлорида цинка (ZnCl2) по формуле:
![]()
- Получаем:
- M (1/2 ZnCl2) = 136 / 2 = 68 (г/моль).
- Карбонат натрия (Na2CO3) относится к классу солей, в своем составе содержит два атома металла со степенью окисления +1. Эквивалентное число для соли находим по формуле:
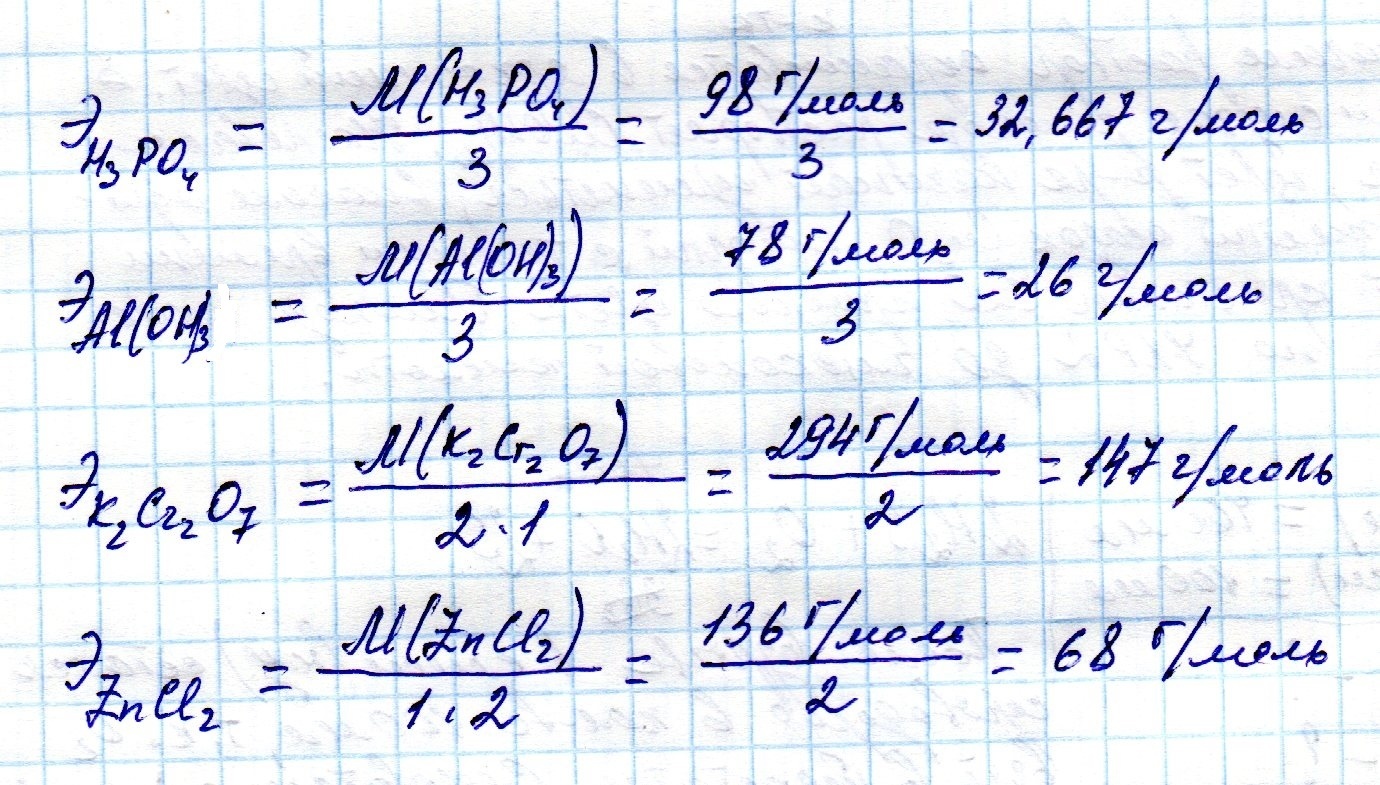
- Получаем:
- z (Na2CO3)= 2 ⋅ 1 = 2
- Молярная масса карбоната натрия (Na2CO3) равна:
- М (Na2CO3) = 2 ⋅ 23 + 12 + 3 ⋅ 16 = 106 (г/моль).
- Теперь можно вычислить молярную массу эквивалента вещества карбоната натрия (Na2CO3) по формуле:
![]()
Получаем:
M (1/2 Na2CO3) = 106 / 2 = 53 (г/моль).
Гидроксид алюминия (Al(OH)3)относится к классу оснований, в своем составе содержит три группы ОН–, эквивалентное число z (Al(OH)3) = 3. Таким образом, химический эквивалент данного соединения – это условная частица, составляющая 1/3 часть реально существующей молекулы гидроксида алюминия (Al(OH)3).
- Молярная масса гидроксида алюминия (Al(OH)3) равна:
- М (Al(OH)3) = 27 + 3 ⋅ (16 + 1) = 78 (г/моль).
- Теперь можно вычислить молярную массу эквивалента вещества гидроксида алюминия (Al(OH)3) по формуле:
![]()
Получаем:
M (1/3 Al(OH)3) = 78 / 3 = 26 (г/моль).
Ответ:
- молярная масса эквивалента вещества хлорида цинка 68 г/моль;
- молярная масса эквивалента вещества карбоната натрия 53 г/моль;
- молярная масса эквивалента вещества гидроксида алюминия 26 г/моль.
Источник: https://himik.pro/osnovnyie-zakonyi-himii-i-stehiometricheskie-raschetyi/molyarnaya-massa-ekvivalenta-veshhestva
Эквивалентный вес использует и как рассчитать его (с примерами) / химия
эквивалентный вес (PE) вещества — это вещество, которое участвует в химической реакции и используется в качестве основы для титрования. В зависимости от типа реакции его можно определить так или иначе.
Для кислотно-основных реакций PE представляет собой массу вещества в граммах, которое требуется для подачи или реакции с одним молем H+ (1 008 г); для окислительно-восстановительных реакций — вес в граммах вещества, которое требуется для подачи или реакции с одним молем электронов.

- Для реакций осаждения или комплексообразования — масса вещества, которое требуется для подачи или реакции с одним молем одновалентного катиона, 1/2 моля двухвалентного катиона, 1/3 моля трехвалентного катиона , И так далее.
- Хотя на первый взгляд это может показаться немного сложным, некоторые вещества всегда ведут себя химически одинаково; следовательно, нетрудно узнать значения PE с учетом случаев.
- индекс
- 1 Происхождение эквивалентного веса
- 2 использования
- 2.1 Использование в общей химии
- 2.2 Использование в объемном анализе
- 2.3 Использование в гравиметрическом анализе
- 2.4 Использование в химии полимеров
- 3 Как рассчитать это? примеров
- 3.1 — Эквивалентная масса химического элемента
- 3.2 — Эквивалентная масса оксида
- 3.3 Эквивалентный вес основания
- 3.4 — Эквивалентный вес кислоты
- 3.5 — Эквивалентный вес соли
- 4 Ссылки
Происхождение эквивалентного веса
Джон Далтон (1808) предложил эквивалентный вес водорода в качестве единицы массы. Однако возник ряд возражений против этого подхода. Например, было указано, что большинство элементов не реагируют непосредственно с водородом с образованием простых соединений (XH).
Кроме того, элементы с различными степенями окисления, например перманганат, имеют более чем эквивалентную массу. Это препятствовало принятию эквивалентного веса в качестве единицы массы.
Представление Дмитрием Менделеевым (1869) его периодической таблицы, в которой химические свойства элементов были связаны с упорядоченным порядком их атомных весов, представляло собой сильный аргумент тех, кто возражал против использования эквивалентного веса в качестве единицы масса.
На самом деле, нет необходимости использовать термин «эквивалент», так как любой стехиометрический расчет может быть сделан в терминах молей. Однако этот термин часто используется, и его не удобно игнорировать.
Для удобства был введен термин «эквивалент»: эквивалент любой кислоты реагирует с эквивалентом любого основания; Эквивалент любого окислителя реагирует с эквивалентом любого восстановителя и т. Д..
приложений
Использование в общей химии
металлы
Использование ПЭ в элементах и химических соединениях было заменено использованием его молярной массы. Основной причиной является наличие элементов и соединений с более чем эквивалентным весом.
Например, железо (Fe), элемент с атомным весом 55,85 г / моль, имеет две валентности: +2 и +3. Следовательно, он имеет два эквивалентных веса: когда он работает с валентностью +2, его эквивалентный вес составляет 27,93 г / экв; в то время как при использовании валентности +3 ее эквивалентный вес составляет 18,67 г / экв..
Конечно, мы не можем говорить о существовании эквивалентного веса Веры, но мы можем указать на существование атомного веса Веры..
кислоты
Фосфорная кислота имеет молекулярную массу 98 г / моль. Эта кислота при диссоциации в H+ + H2ПО4-, Его эквивалентная масса составляет 98 г / экв., Поскольку он выделяет 1 моль H.+. Если фосфорная кислота диссоциирует в H+ + HPO42-, его эквивалентный вес составляет (98 г.моль-1) / (2 экв / моль-1) = 49 г / экв. В этой диссоциации Н3ПО4 выпускает 2 моля H+.
Хотя он не титруем в водной среде, Н3ПО4 может диссоциировать в 3 H+ + ПО43-. В этом случае эквивалентный вес равен (98 г.моль-1) / (3 экв.моль-1) = 32,7 г / экв. H3ПО4 Доставка в этом случае 3 моля H+.
Тогда фосфорная кислота имеет до 3 эквивалентных весов. Но это не единичный случай, например, серная кислота имеет два эквивалентных веса, и углекислота также представлена.
Использовать в объемном анализе
-Чтобы уменьшить ошибки, которые могут быть допущены во время взвешивания веществ, использование вещества с более высокой эквивалентной массой является предпочтительным в аналитической химии. Например, при оценке растворов гидроксида натрия с кислотами разной эквивалентной массы. Рекомендуется использовать кислоту с большей эквивалентной массой.
-При использовании массы твердой кислоты, которая может реагировать с гидроксидом натрия, у вас есть возможность выбора между тремя твердыми кислотами: дигидрат щавелевой кислоты, фталевая кислота калия и гидройодат калия, с эквивалентными весами соответственно 63,04 г / экв, 204,22 г / экв и 389 г / экв.
В этом случае предпочтительно использовать перекись водорода калия при оценке гидроокиси натрия, так как относительная погрешность, которая допускается при ее взвешивании, ниже при наличии большей эквивалентной массы..
Использование в гравиметрическом анализе
Эквивалентный вес определяется по-своему в этой методике для анализа веществ. Здесь масса осадка соответствует одному грамму аналита. Это элемент или соединение, представляющее интерес в проводимом исследовании или анализе.
В гравиметрии часто называют результаты анализов в виде доли массы аналита, часто выражаемой в процентах..
Коэффициент эквивалентности объясняется как численный коэффициент, на который умножается масса осадка для получения массы аналита, обычно выражаемой в граммах..
Гравиметрическое определение никеля
Например, при гравиметрическом определении никеля содержащий его осадок представляет собой бис (диметилглиоксилат) никеля с молярной массой 288,915 г / моль. Молярная масса никеля составляет 58,6934 г / моль.
Молярная масса осадка между молярной массой никеля дает следующий результат:
288,915 гмоль-1/ 58,6934 г.моль-1 = 4,9224. Это означает, что 4,9224 г соединения равно 1 г никеля; или, другими словами, 4,9224 г осадка содержат 1 г никеля.
Коэффициент эквивалентности рассчитывается путем деления молярной массы никеля на молярную массу осадка, который его содержит: 58,693 г.моль-1/ 288,915 гмоль-1 = 0,203151. Это говорит нам о том, что на грамм никельсодержащего осадка приходится 0,203151 г никеля..
Используется в химии полимеров
В химии полимеров эквивалентный вес реагента для полимеризации представляет собой массу полимера, который имеет эквивалент реакционной способности.
Это особенно важно в случае ионообменных полимеров: один эквивалент ионообменного полимера может обменивать один моль заряженных ионов; но только половина моль двухзарядных ионов.
Обычно реакционную способность полимера выражают в виде обратной величины эквивалентной массы, которая выражается в единицах ммоль / г или мэкв / г..
Как рассчитать это? примеров
-Эквивалентный вес химического элемента
- Он получается путем деления его атомного веса на его валентность:
- Peq = Pa / v
- Есть элементы, которые имеют только эквивалентный вес, и элементы, которые могут иметь 2 или более.
Эквивалентный вес кальция
Атомный вес = 40 г / моль
Валенсия = +2
Peq = 40 г.моль-1/2eq.mol-1
20 г / экв
Эквивалентный вес алюминия
Атомный вес = 27 г / моль
Валенсия = +3
Peq = 27 г.моль-1/ 3 экв.моль-1
9 г / экв
Никель эквивалентный вес
- Атомный вес = 58,71 г / моль
- Валенсия = +2 и +3
- Никель имеет два эквивалентных веса, соответствующих тому, когда он реагирует с валентностью +2 и когда он реагирует с валентностью +3.
- Peq = 58,71 г моль-1/ 2 экв.моль-1
- 29,35 г / экв
- Peq = 58,71 г моль-1/ 3 экв.моль-1
- 19,57 г / экв
-Эквивалентная масса оксида
- Один из способов расчета эквивалентной массы оксида состоит в делении его молекулярной массы на произведение валентности металла на индекс металла.
- Peq = Pm / V · S
- Pm = молекулярная масса оксида.
- V = снос металла
- S = металлический индекс
Продукт V · S называется общим или чистым зарядом катиона..
Эквивалентная масса оксида алюминия (Al2О3)
- Молекулярный вес = Al (2 х 27 г / моль) + O (3 х 16 г / моль)
- 102 г / моль
- Валенсия = +3
- Субиндекс = 2
- Peq Al2О3 = Пм / В · С
Peq Al2О3 = 102 г.моль-1/ 3 эквмоль-1. 2
17 г / экв
Существует еще один способ решения этой проблемы, основанный на стехиометрии. В 102 г оксида алюминия содержится 54 г алюминия и 48 г кислорода..
Peq del Al = Атомный вес / Валенсия
27 г.моль-1/ 3 экв.моль-1
9 г / экв
На основании эквивалентного веса алюминия (9 г / экв.) Рассчитано, что в 54 г алюминия содержится 6 эквивалентов алюминия..
Тогда из свойств эквивалентов: 6 эквивалентов алюминия будут реагировать с 6 эквивалентами кислорода с образованием 6 эквивалентов оксида алюминия..
В 102 г. оксида алюминия есть 6 эквивалентов.
- Поэтому:
- Peq of Al2О3 = 102 г / 6 экв
- 17 г / экв
-Эквивалентный вес базы
Эквивалентный вес получают путем деления его молекулярного веса на количество оксигидрильных групп (ОН).
Эквивалентная масса гидроксида железа, Fe (ОН)2
Молекулярный вес = 90 г / моль
ОН число = 2
Peq Fe (OH)2 = 90 г.моль-1/ 2 экв.моль-1
45 г / экв
-Эквивалентный вес кислоты
Как правило, его получают путем деления его молекулярной массы на количество водорода, который выделяется или выделяется. Однако полипротонные кислоты могут диссоциировать или высвобождать Н в различных формах, поэтому они могут иметь более чем эквивалентную массу..
Эквивалентная масса соляной кислоты, HCl
Эквивалентная масса HCl = молекулярная масса / водородное число
Peq HCl = г.моль-1/ 1 экв.моль-1
36,5 г / экв
Эквивалентная масса серной кислоты
- Серная кислота (ч2SW4) может быть разделена двумя способами:
- H2SW4 => H+ + HSO4-
- H2SW4 => 2 H+ + SW42-
- Когда вы выпускаете H+ Ваш PE это:
- Молекулярный вес = 98 г / моль
Peq = 98 г.моль-1/ 1 экв.моль-1
- 98 г / пек
- И когда он выпускает 2H+:
- Молекулярный вес = 98 г / моль
Peq = 98 г.моль-1/ 2 экв.моль-1
49 г / экв
По той же причине фосфорная кислота (H3ПО4) с молекулярной массой 98 г / моль, может иметь до трех эквивалентных масс: 98 г / экв, 49 г / экв и 32,67 г / экв.
-Эквивалентный вес соли
И, наконец, вы можете рассчитать эквивалентную массу соли, разделив ее молекулярную массу на произведение валентности металла на индекс металла.
PE = PM / V · S
Fe железный сульфат2(SO4)3
- Молекулярный вес = 400 г / моль
- Валенсия железа = +3 экв / моль
- Железный индекс = 2
Peq = 400 г.моль-1/ 3 экв.моль-1 х 2
66,67 г / экв
ссылки
- Дей, Р. А. JR. А Андервуд А. Л. Количественная аналитическая химия. Перевод 5в Английское издание. Редакция Прентис Холл Интеримериана
- Неорганическая химия (Н.Д.). Определение эквивалентной массы оксидов. Получено с: fullquimica.com
- Wikipedia. (2018). Эквивалентный вес. Получено с: en.wikipedia.org
- Редакция Британской энциклопедии. (26 сентября 2016 г.) Эквивалентный вес. Энциклопедия Британника. Получено с: britannica.com
- Ори, Джек. (30 апреля 2018 г.) Как рассчитать эквивалентный вес. Sciencing. Получено от: sciencing.com
- Эквивалентный вес кислоты. Часть 2. Титрование образца неизвестной кислоты. (Н.Д.). Получено с: faculty.uml.edu
- Бергстрессер М. (2018). Эквивалентный вес: определение и формула. Исследование. Получено с: study.com
Источник: https://ru.thpanorama.com/articles/qumica/peso-equivalente-usos-y-cmo-calcularlo-con-ejemplos.html
МОЛЬ. КОЛИЧЕСТВО ВЕЩЕСТВА ЭКВИВАЛЕНТА (ЭКВИВАЛЕНТ) И МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА (ЭКВИВАЛЕНТНАЯ МАССА) ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ. ЗАКОН ЭКВИВАЛЕНТОВ
Моль — количество вещества системы, содержащей столько же структурных элементов (молекул, атомов, ионов, электронов и т.д.), сколько атомов содержится в 0,012 кг углерода-12 массой.
При использовании термина «моль» структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Например, моль молекул водорода, моль атомов водорода, моль ионов водорода.
0,012 кг углерода-12 содержит 6,02∙1023 атомов углерода (постоянная Авогадро Na = 6,022045∙1023 моль-1). Следовательно, моль – это такое количество вещества, которое соответствует постоянной Авогадро, т.е. содержит 6,02∙1023 структурных элементов.
Масса одного моля вещества называется молярной массой (М). Единицей измерения молярной массы является г/моль или кг/моль.
Относительная молекулярная масса Mr – это молярная масса вещества, отнесенная к молярной массы атома углерода – 12.
Относительная атомная масса Аr – это молярная масса атома вещества, отнесенная к молярной массы атома углерода – 12.
Пример 1. Выразите в молях: а) 6,02∙1021 молекул СО2; б) 1,20∙1024 атомов кислорода; в) 2,00∙1023 молекул воды. Чему равна молярная масса указанных веществ?
Решение. Моль- это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро Na = 6,02∙1023 моль-1. Отсюда а) 6,02∙1021, т.е. 0,01 моль; б) 1,20∙1024, т.е. 2 моль; в) 2,00∙1023, т.е. 1/3 моль.
Масса моля вещества выражается в кг/моль или г/моль. Молярная масса вещества в граммах численно равна его относительной молекулярной (атомной) массе.
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44; 18 и 16, то их молярные массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и молярную массу эквивалента m Э азота, серы и хлора в соединениях NH3, H2S и НС1.
Решение. Масса вещества и количество вещества — понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества — в молях.
Эквивалент элемента (Э) — это такое количество вещества, которое взаимодействует с 1 моль атомов водорода в химических реакциях. Масса эквивалента элемента называется молярной массой эквивалента (тЭ). Таким образом, эквиваленты (количество вещества эквивалента) выражаются в молях, а молярная масса эквивалента — в г/моль.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота, 1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) = 1/2 моль, Э(С1) = 1 моль.
Исходя из молярных масс этих элементов, определяем их молярные массы эквивалентов: mЭ(N) = ∙14= 4,67 г/моль; mЭ(S) = ∙32 = 16 г/моль;
mЭ(С1) = 1∙35,45 = 35,45 г/моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалента оксида и молярную массу эквивалента металла. Чему равна атомная масса металла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013 • 105 Па (760 мм рт. ст. = 1 атм), температура 273 К или 0° С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объемам) (уравнения 1 и 2):

Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, л, м3).
Объем, занимаемый при данных условиях молярной массой эквивалента газообразного вещества, называется молярным объемом эквивалента этого вещества. Молярный объем любого газа при н.у. равен 22,4 л.
Отсюда эквивалентный объем водорода, молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен = 22,4 / 2 = 11,2 л. В формуле (2) отношение заменяем равным ему отношением , где — объем водорода, — эквивалентный объем водорода:
- (3)
- Из уравнения (3) находим молярную массу эквивалента оксида металла :
- ; г/моль.
- Согласно закону эквивалентов mЭ(МеО)=mЭ(Me)+mЭ(О2). Отсюда
- mЭ(Ме) = mЭ(МеО) – mЭ(О2 ) =35,5 – 8 =27,45 г/моль.
- Молярная масса металла определяется из соотношения mЭ = А/В, где mЭ — молярная масса эквивалента, А — молярная масса металла, В – стехиометрическая валентность элемента;
- А = mЭ∙В = 27,45∙2 = 54,9 г/моль.
- Так как относительная атомная масса численно равна относительной молярной массе, выраженной в г/моль, то искомая атомная масса металла равна 54,9.
Пример 4. Сколько г металла, эквивалентная масса которого равна 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 л, то объем молярной массы эквивалента кислорода (8 г/моль) будет равен 22,4 : 4 = 5,6 л = 5600 см3. По закону эквивалентов
- или ,
- откуда г.
- Пример 5. Вычислите количество вещества эквивалентов и молярные массы эквивалентов H2SO4 и А1(ОН)3 в реакциях:
- H2SО4 + КОН = KHSО4 + Н2О (1)
- H2SO4 + Mg = MgSO4 + Н2 (2)
- А1(ОН)3 + НС1 = Al(OH)2C1 + H2O (3)
- Al(ОН)3 + 3 HNO3 = A1(NO3)3 + 3 H2O (4)
Решение. Молярная масса эквивалента сложного вещества, как и молярная масса эквивалента элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество.
Молярная масса эквивалента кислоты (основания) равна молярной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп).
Следовательно, эквивалентная масса H2SO4 в реакции (1) = 98 г/моль, а в реакции (2) /2 = 49 г/моль. Эквивалентная масса А1(ОН)3 в реакции (3) = 78 г/моль, а в реакции (4)
/3 = 26 г/моль .
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной молярной массой эквивалента КОН и двумя молярными массами эквивалента магния, то ее молярная масса эквивалента равна в реакции (1) (М/1) г/моль и в реакции (2) (M/)2г/моль.
А1(ОН)3 взаимодействует с одной молярной массой эквивалента НС1 и тремя молярными массами эквивалента НNОз, поэтому его молярная масса эквивалента в реакции (3) равна (М/1) г/моль, a в реакции (4) (М/3) г/моль.
Количество вещества эквивалента H2SO4 в уравнениях (1) и (2) сoответственно равны 1 моль и 1/2 моль, количество вещества эквивалента А1(ОН)3 в уравнениях (3) и (4) соответственно равны 1 моль и 1/3 моль.
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла mЭ(Mе).
Решение. При решении задачи следует иметь в виду: а) молярная масса эквивалента гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы; б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Вообще молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
- Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
- откуда mЭ(Me) = 15 г/моль.
Пример 7. В какой массе Са(ОН)2 содержится столько же эквивалентных масс, сколько в 312 г А1(ОН)3?
Решение. Молярная масса эквивалента А1(ОН)3 равна 1/3 его молярной массы, т.е. 78/3 = 26 г/моль. Следовательно в 312 г А1(ОН)3 содержится 312/26 = 12 эквивалентов. Молярная масса эквивалента Са(ОН)2 равна 1/2 его молярной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль x 12 моль = 444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро NAструктурных единиц (в нашем примере молекул). Молярная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02∙1023) = 1,63∙10-22г.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Определите количество вещества эквивалента и молярную массу эквивалентов фосфора, кислорода и брома в соединениях РН3, Н2О, НВг.
2. В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г КОН.
Ответ: 100 г.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла. Ответ: 32,5 г/моль.
4. Из 1,3 гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалента этого металла.
Ответ: 9 г/моль.
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите молярную массу эквивалента, молярную и атомную массы этого элемента.
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите молярную массу эквивалента металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32,68 г/моль.
7. Вычислите в молях: а) 6,02∙1022 молекул С2Н2; б) 1,80∙1024 атомов азота; в) 3,01∙1023 молекул NH3. Какова молярная масса указанных веществ?
8. 8. Вычислите количество вещества эквивалента и молярную массу эквивалента Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла?
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите молярную массу эквивалента, молярную массу и относительную атомную массу этого металла.
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла. Ответ: 103, 6 г/моль.
12. Напишите уравнение реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите количество вещества эквивалента и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций.
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнение реакций этих веществ с КОН и определите количество вещества эквивалентов и молярные массы эквивалента.
14. В каком количестве Сг(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Mg(OH)2?
Ответ: 205,99 г.
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НС1 и определите количество вещества эквивалентов и молярные массы эквивалента.
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалента металла и его оксида. Чему равны молярная и относительная атомная массы металла? Ответ: 27,9 г/моль; 35,9 г/моль; 55,8г/моль; 55,8.
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента, молярную и относительную атомную массы металла.
18. Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Ответ: 2,0∙10-23 г; 3,0∙10-23 г.
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность НзРО4 в этой реакции. На основании расчета напишите уравнение реакции.
Ответ: 0,5 моль; 49 г/моль; 2.
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность кислоты. На основании расчета напишите уравнение реакции.
Ответ: 0,5 моль; 41 г/моль; 2.
2. СТРОЕНИЕ АТОМА
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме имеет вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО).
Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n , l , ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные), значения. Соседние значения квантовых чисел различаются на единицу.
Квантовые числа определяют размер (п), форму (/) и ориентацию (m l) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму (рис. 1). Формы электронных облаков аналогичны АО.
Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя числами (п, l , ml ms). Эти квантовые числа связаны с физическими свойствами электрона.
Число п(главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) — момент количества движения (энергетический подуровень); число ml (магнитное) — магнитный момент; ms — спин.
Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, различающихся своими спинами (ms = ± 1/2). В табл. 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне.
Таблица 1. Значение квантовых чисел и максимальное число
Дата добавления: 2018-11-24; просмотров: 138;
Источник: https://studopedia.net/10_2672_mol-kolichestvo-veshchestva-ekvivalenta-ekvivalent-i-molyarnaya-massa-ekvivalenta-ekvivalentnaya-massa-prostih-i-slozhnih-veshchestv-zakon-ekvivalentov.html
Вычисление количества вещества эквивалента, молярной массы эквивалента веществ и эквивалента
Задание 12. Напишите уравнение реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите количество вещества эквивалента и молярную массу эквивалента Fе(ОН)3 в каждой из этих реакций.Решение:
- а); Fe(OH)3 + HCl = Fe(OH)2Cl + H2O;
- б) Fe(OH)3 + 2HCl = FeOHCl2 + 2H2O;
- в) Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Молярная масса эквивалента сложного вещества, как и молярная масса эквивалента эле-мента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество.
Молярная масса эквивалента основания равна молярной массе (М), делённой на число гидроксильных групп, замещённых в данной реакции на металл (на число вступающих в реакцию гидроксильных групп).
Следовательно, эквивалентная масса Fe(OH)3 в реакции (а) М(Fe(OH)3)/1 = 106,84/1 = 106,84 г/моль, в реакции (б) — М(Fe(OH)3)/2 = 106,84/2 = 53,42 г/моль, а в реакции (в) — М(Fe(OH)3)/3 = 106,84/3 = 35,61 г/моль.
Задача 13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; 6) нитрата дигидроксовисмута (III). Напишите уравнение реакций этих веществ с КОН и определите количество вещества эквивалентов и молярные массы эквивалента.
- Решение:а) Уравнение реакции имеет вид:
- 2КОН + КН2РО4 = К3РО4 + 2Н2О
Молярная масса эквивалента КОН равна М(КОН)/1 = 56/1 = 56 г/моль. В данной реакции 2 моль КОН реагируют с 1 моль КН2РО4, значит, число веществ эквивалентов КН2РО4 равно 2. Так как КН2РО4 взаимодействует с двумя молекулярными массами эквивалента (молекулами) КOH в реакции (а), то её молярная масса эквивалента равна М(КН2РО4)/2 = 136/2 = 68 г/моль.
б) Уравнение реакции имеет вид:
КОН + Bi(OH)2NO3 = KNO3 + Bi(OH)3
В данной реакции 1 моль КОН реагируют с 1 моль Bi(OH)2NO3, значит, число веществ эквивалентов Bi(OH)2NO3 равно 1. Так как Bi(OH)2NO3 взаимодействует с одной молекулярной массой эквивалента (молекулой) КOH в реакции (б), то её молярная масса эквивалента равна М(Bi(OH)2NO3)/1 = 304,98/1 = 304,98 г/моль.
Задача 14.
В каком количестве Сг(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Решение:Молярная масса эквивалента основания численно равна молярной массе делённой на число гидроксильных групп, содержащихся в молекуле основания. Значит молярная масса эквивалента Мg(ОН)2 равна 1/2М(Мg(ОН)2), т. е. МЭ(Мg(ОН)2) = 58,32/2 = 29,16 г/моль. Следовательно, в 174,96 г Мg(ОН)2 содержится 6 эквивалентов (174,96 /29,16 = 6).
Молярная масса эквивалента Сг(ОН)3 равна 1/3М(Сг(ОН)3), т. е. МЭ(Сг(ОН)3) = 103/3 = 34,33 г/моль. Тогда 6 эквивалентов Сг(ОН)3 составляют 34,33 . 6 = 205,98 г.
Ответ: 205,98 г.
Источник: http://buzani.ru/zadachi/khimiya-shimanovich/888-kolichestvo-veshchestva-ekvivalenta-molyarnaya-massa-ekvivalenta-zadachi-12-14
1.4. Эквивалент. Эквивалентные массы
- Закон эквивалентов
- Количественный подход к
изучению химических явлений и установление
закона постоянства состава показали,
что вещества вступают во взаимодействие
в определенных соотношениях масс, что
привело к введению такого важного
понятия, как “эквивалент”,
и установлению закона
эквивалентов. - Эквивалент
—
это
частица или часть частицы, которая
соединяется (взаимодействует) с одним
атомом водорода или с одним электроном. - Из
этого определения видно, что понятие
“эквивалент” относится к конкретной
химической реакции; если его относят к
атому в химическом соединении, то имеют
в виду реакцию образования этого
соединения из соответствующего простого
вещества и называют эквивалентом
элемента в соединении.
В
одной формульной единице вещества (В)
может содержаться Zв
эквивалентов этого вещества. Число Zв
называют показателем
эквивалентности.
Фактор
эквивалентности (f)
—
доля частицы, составляющая эквивалент;
f
£
1 и может быть равным 1, 1/2, 1/3 и т.д.
fВ
=
. (1.7)
Масса
1 моль эквивалентов, выраженная в граммах,
называется молярной
эквивалентной массой (Мэк)
(г/моль); численно она равна относительной
молекулярной массе эквивалента (кратко
ее называют эквивалентной массой).
Мэк
=
fВ·М. (1.8)
Закон
эквивалентов: массы
взаимодействующих без остатка веществ
соотносятся как их эквивалентные массы.
Математическое выражение закона
эквивалентов:
где Мэк,1
и Мэк,2 —
эквивалентные массы.
Пример
8. Определить эквивалент
и эквивалентную массу кислорода в Н2О.
Решение.
Такая формулировка вопроса предполагает
реакцию образования молекулы воды из
кислорода и водорода:
H2
+ ½O2
= Н2О, то есть с 1 атомом водорода
соединяется ½
атомов кислорода.
Следовательно, Z(О)
= 2. Масса 1 моль атомов кислорода равна
16 г, отсюда Мэк(O)
= М (О)·
=
= 8 г/ моль.
Эквиваленты
одних и тех же элементов в различных
химических соединениях могут различаться,
так как величина эквивалента зависит
от характера превращения, претерпеваемого
им.
Так, в соединении SO2
эквивалентная масса серы равна 8 г/моль,
что составляет 1/4 от атомной массы, а в
соединении SO3
—
5,3 г/моль, что составляет 1/6 от атомной
массы серы (ZS
= 4 и 6, соответственно).
Практический
расчет эквивалентной массы элемента в
соединении ведут по формуле
Мэк
(элемента) = Аэк
=
, (1.10)
где
А —
атомная масса, ω —
степень окисления элемента в данном
соединении. (Ниже будет показано, что
для реакции образования соединения из
простых веществ ZВ
= |ω|).
Например,
ZВ
(Mn) в соединении KMnO4
(ω = +7) составляет 7, а Мэк
(Mn)
=
=
= 7,85 г/моль; в соединении Mn2O3
(ω = +3) – ZВ
= 3 и Мэк
(Mn)
=
=
= 18,3 г/моль. (55-
масса 1-го моля атомов марганца или
атомная масса).
Эквивалентная
масса вещества в химических реакциях
имеет различные значения в зависимости
от того, в каком взаимодействии это
вещество участвует. Если во взаимодействии
сложного вещества участвует его известное
количество или известно количество
реагирующих групп, то для расчета
эквивалентных масс можно пользоваться
следующими правилами и формулами.
- а)
Вещества друг с другом реагируют
одинаковыми количествами эквивалентов. Например,
в реакции - 2Al
+ 3/2O2
= Al2O3 - 6
моль эквивалентов Al
реагируют с таким же количеством
кислорода (ZВ
(Al)
= 3, ZВ
(O)
= 2). - б)
Эквивалентная масса кислоты в реакциях
замещения ионов водорода равна:
М
эк.
кислоты=
(1.11)
Пример
9. Определить эквивалент
и эквивалентную массу H2SO4
в реакциях:
-
H2SO4 + KOH = KHSO4 + H2O ;
-
H2SO4 + 2KOH = K2SO4 + 2H2O .
Решение.
В первой реакции
заместился один ион водорода, следовательно,
эквивалент серной кислоты равен 1, ZВ
(H2SO4)
= 1, Мэк(H2SO4)
= М1
= 98 г/моль. Во второй реакции заместились
оба иона водорода, следовательно,
эквивалент серной кислоты равен двум
молям, ZВ
(H2SO4)
= 2, а Mэк
(H2SO4)
= 98·½
= 49 г/моль.
в)
Эквивалентная масса основания в реакции
замещения ионов гидроксила равна:
Мэк.
основания
= .(1.12)
- Пример
10. Определить эквивалент и эквивалентные
массы гидроксида висмута в реакциях: - 1)
Bi(OH)3
+ HCl = Bi(OH)2Cl
+ H2O; - 2)
Bi(OH)3
+ 3HCl = BiCl3
+ H2O.
Решение. 1)ZВ
Bi(OH)3
= 1, Mэк Bi(OH)3
= 260 г/моль (т. к. из трех ионов гидроксила
заместился один);
2) ZВ
Bi(OH)3
= 3, a Mэк Bi(OH)3
= 260·= 86,3 г/моль (т. к. из трех ионов ОН-
заместились все три).
- г)
Эквивалентная
масса соли в реакциях полного замещения
катиона или аниона равна: - Мэк.
соли
= - или (1.13)
- Мэк
соли=
.
Так,
ZВ
Al2(SO4)3
= 3∙2 = 6. Однако в реакции эта величина
может быть больше (неполное замещение)
или меньше (комплексообразование). Если,
например, это соединение участвует во
взаимодействии по реакции
Al2(SO4)3
+ 12KOH
= 2K3[Al(OH)6]
+ 3K2SO4
,
то
при этом три аниона с суммарным зарядом
6 замещаются 12 ОН-
ионами, следовательно, 12 эквивалентов
этого вещества должно вступать в реакцию.
Таким образом, ZВ
Al2(SO4)3
=
12, а Мэк
= М·fВ
= 342/12 = 28,5 г/моль.
д)
Эквивалентная
масса оксида в реакциях полного замещения
равна:
Мэк
оксида
= .(1.14)
Например,
ZВ
(Fe2O3)
= 3·2 = 6. Мэк
= М(Fe2O3)·fВ
= 160×1/6
= 26,6 г/моль. Однако в реакции
Fe2O3
+ 4HCl
= 2FeOHCl2
+ H2O
ZВ
(Fe2O3)
= 4, Мэк
= М(Fe2O3)∙fВ
= 160×1/4
= 40 г/моль, так как Fe2O3
взаимодействует с четырьмя эквивалентами
HCl (fВ
= 1).
При
решении задач, связанных с газообразными
веществами, целесообразно пользоваться
значением эквивалентного
объема.
Это объем, занимаемый одним молем
эквивалентов газообразного вещества.
Пример
11. Рассчитайте эквивалентные объемы
газообразных водорода и кислорода при
н.у.
Решение.
Для водорода при н.у. этот объем равен
11,2 литров (молярный объем Н2составляет 22,4 л, а так как Мэк(Н)
= 1г (т.е.
в 2 раза меньше, чем молярная
масса), то эквивалентный объем будет в
2 раза меньше молярного, т. е. 11,2 л),для
кислорода – 5,6л (молярный объем О2составляет 22,4 л, а так как Мэк(О)
= 8г (т.е.
в 4 раза меньше, чем молярная
масса О2), то эквивалентный
объем будет в 4 раза меньше, чем молярный.
Пример
12.На
восстановление 1,80 г оксида металла
израсходовано 883 мл водорода (н.у.).
Вычислить эквивалентные массы оксида
и металла.
Решение.
Согласно закону эквивалентов (1.9) массы
(объемы) реагирующих веществ пропорциональны
их эквивалентным массам (объемам):
(г/моль);
+ ,
Пример
13. Вычислить эквивалентную
массу цинка, если 1,168 г Zn вытеснили из
кислоты 438 мл Н2
(t = 17 оС
и Р = 750 мм рт. ст.).
Решение.
Согласно закону эквивалентов (1.9): ;
Из
уравнения Менделеева-Клапейрона
(1.4):
- д)
Эквивалентная масса окислителя и
восстановителя определяются
делением молярной массы на изменение
степени окисления в соответствующей
реакции на 1моль. - Пример
14. Определить эквивалентные массы
окислителя и восстановителя в реакции: - +6 +4 +3 +6
- K2Cr2O7
+ 3Na2SO3
+ 4H2SO4
= Cr2(SO4)3
+ 3Na2SO4
+ K2SO4
+ 4H2O.
Решение.
Окислителем в этой реакции являетсяK2Cr2O7,
а восстановителем –Na2SO3.
Суммарное изменение степени окисления
хрома вK2Cr2O7Dw(2Cr)
= 2.(+3) – 2.(+6) = – 6;
Поэтому
Суммарное
изменение степени окисления серы в
Na2SO3:Dw(S)
= +6 – (+4) = +2;
Поэтому
Источник: https://studfile.net/preview/4246233/page:11/




