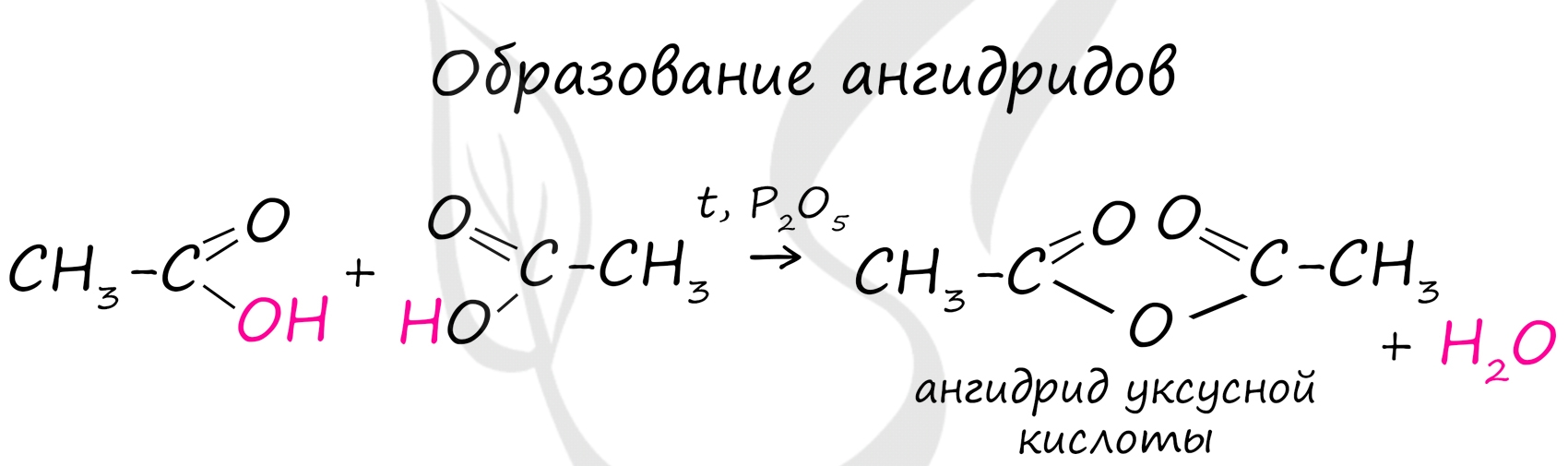
Уксусная кислота (этановая кислота) CH3COOH — органическое соединение, слабая, предельная одноосновная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа».
Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна.
Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами.
Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Физические свойства
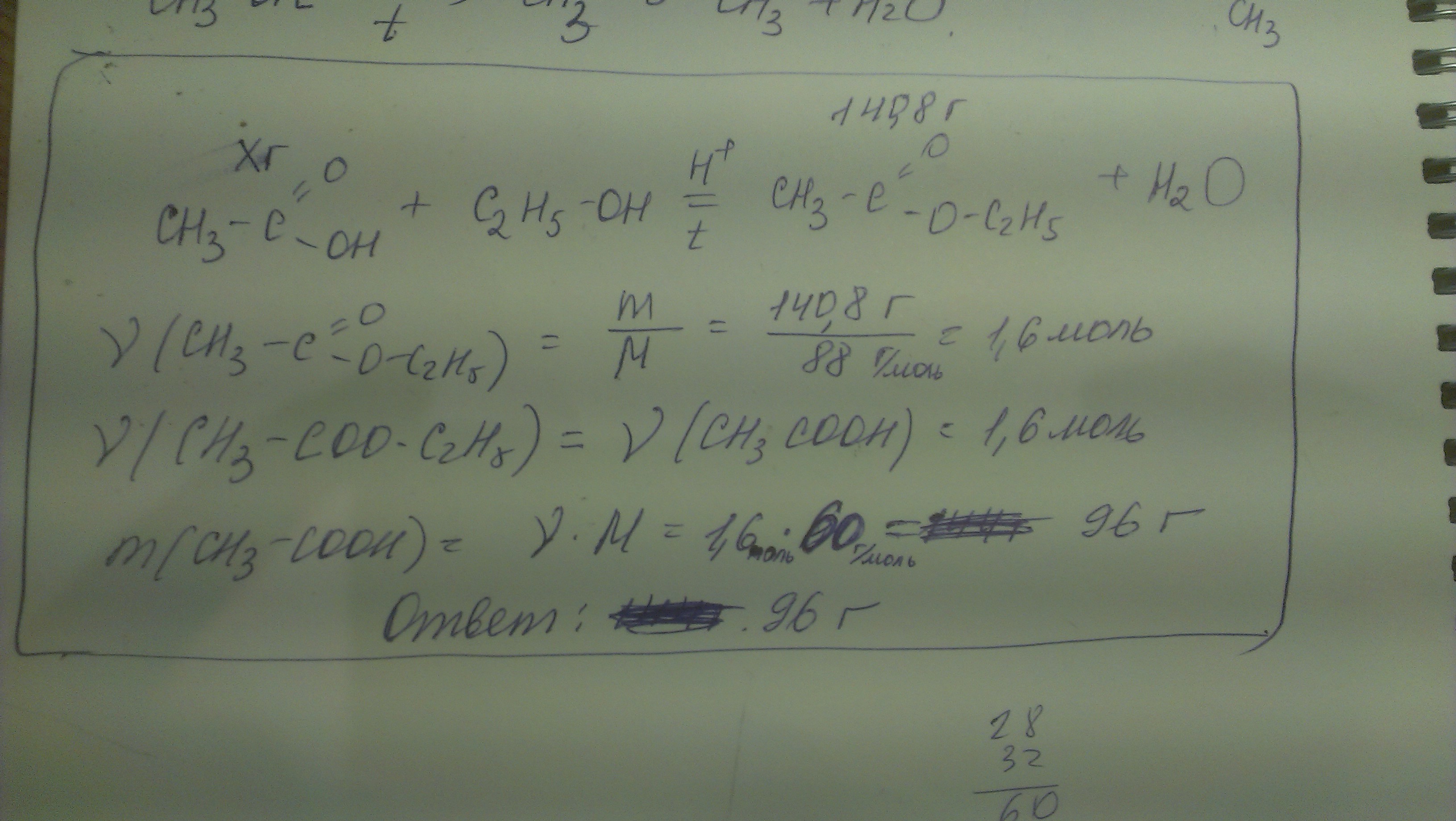
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу.
- Давление паров (в мм. рт. ст.):
- 10 (+17,1 °C)
- 40 (+42,4 °C)
- 100 (+62,2 °C)
- 400 (+98,1 °C)
- 560 (+109 °C)
- 1520 (+143,5 °C)
- 3800 (+180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
2CH3CHO + O2 ⟶ 2CH3COOH
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
2C4H10 + 5O2 ⟶ 4CH3COOH + 2H2O
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
Каталитическое карбонилирование метанола
 Каталитическая схема процесса фирмы Monsanto
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
CH3OH + CO ⟶ CH3COOH
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. Катализатором превращения служил йодид кобальта.
Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт.
Луизиана) и долго оставалась единственным процессом BASF в США.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
CH3CH2OH + O2 → CH3COOH + H2O
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути
C2H2 + H2O → Hg2 + CH3CHO — Реакция КучероваCH3CHO →CrO3,H2SO4 CH3COOH 
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты).

Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
Mg + 2CH3COOH → (CH3COO)2Mg + H2↑
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
CH3COOH + Cl2 → CH2ClCOOH + HCl
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15 % — уксусом.
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи.
Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность

Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³.
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная доза составляет примерно 20 мл.
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Источник: https://chem.ru/uksusnaja-kislota.html
Что такое уксусная кислота и из чего ее делают
Уксусная кислота – вещество, относящееся к органическим соединениям и группе карбоновых. Представлена в виде бесцветной жидкости с наличием резкого специфического запаха. Хорошо растворяется в воде. В кислоте отсутствуют инородные примеси. Используют в медицине, косметологии, промышленности.
Что такое уксусная кислота
Вещество получают биогенным или синтетическим путем.
Формула
Органическое соединение имеет свою химическую формулу – CH3COOH. На его основе получают другие вещества – производные уксусной кислоты, имеющие название «ацетаты».

Из чего и как получают уксусную кислоту
Возможен биогенный способ производства вещества. Источник – бактериальные закваски. Однако существует и синтетический метод приготовления органического соединения – выделение реагента из нефтепродуктов или древесины. Из таковых производится ацетилен, при переработке образующий уксусный альдегид, который впоследствии подвергают окислению.
Метод химического производства разработан известным ученым Михаилом Кучеровым, который предложил способ получения вещества из альдегида. Доказано, что органическое соединение образуется в природе, а ацетилен нет. Однако больше выгоды возникает при добыче кислоты из последнего, чем ее выделение из окружающей среды.
Концентрация
Исходя из объема содержания органического соединения, различают уксусную кислоту, эссенцию и чистый уксус. При смешивании кислоты с водой до образования 70-80%-го раствора можно получить эссенцию, до 3-6% – уксус. Вещество в чистом виде, без взаимодействия с иной жидкостью, именуют кислотой.
Важно! В пищевой промышленности, медицине, быту и с другими целями используют именно растворы соединения.
Химические свойства
Для вещества характерны свойства, которыми обладают карбоновые кислоты. Например, при распаде органического соединения образуются протон H+ и ацетат-ион CH3COO−.
Уксусная кислота – это слабое одноосновное соединение (pKa). Водное значение (рН) раствора с концентрацией 1.0 М (что приблизительно характерно для пищевого уксуса – яблочного, столового и др.) – 2,4. Степень распада – 0,4%.
Возможно реагирование органического соединения с активными металлами. В таком случае образуется водород и соли (ацетаты). Хлорирование кислоты происходит под действием газообразного хлора, что обуславливает образование хлоруксусной кислоты.
Рекомендуем: Как избавиться от тли в саду — горчица и уксус помогут
Восстановление вещества до этанола возможно под действием алюмогидрида лития. Превращение органического соединения в хлорангидрид происходит при контакте с тионилхлоридом. Метан образуется в результате нагревания натриевой соли со щелочью.
Влияние уксусной кислоты на организм человека
Органическое соединение используют в различных отраслях, в том числе в лечебных целях. Однако помимо пользы оно может нанести вред организму, если пренебрегать правилами применения.
Польза
Применение в кулинарии слабого раствора возможно в процессе приготовления блюд.
Это позволяет легче усваиваться пище в желудочно-кишечном тракте, так как уксус ускоряет расщепление белков, содержащихся в продуктах.
Раствор способствует размягчению волокон пищи, делает ее нежной и улучшает вкусовые качества. Используют в процессе консервации, при мариновании мяса, для добавления в салаты и холодные закуски.
Уксус способствует выведению токсических веществ и шлаков из организма, очищая его. Полезно добавление в блюда за счет способности жидкости подавлять аппетит. Это важно для лиц, имеющих лишний вес и ожирение. Внутрь рекомендуется употреблять только натуральное средство, предварительно разведенное с водой. Это может быть яблочный, винный, бальзамический уксус.
Раствор задействуют не только в приготовлении блюд и для приема внутрь. Полезно обертывание, которое ускоряет обменные процессы, повышает упругость и эластичность кожного покрова. Поэтому такую методику применяют при наличии целлюлита.
За счет полезного состава яблочного уксуса, который также содержит кислоту, его принимают внутрь для снижения интенсивности симптомов мигрени, при алкогольной интоксикации. Средство способствует ликвидации патогенных микроорганизмов, поэтому его рекомендуется принимать при желудочно-кишечном расстройстве.
Совет! Уксус – незаменимый состав для снижения повышенной температуры тела. Даже грудничкам разрешается проводить обтирание туловища, которое быстро снимает жар.
Вред
Сильную опасность для организма представляет нерастворимая жидкость. Также может нанести вред средство с концентрацией органического соединения в 30% и более. Если высококонцентрированное вещество попало на слизистую оболочку или кожный покров, возникает химический ожог.

Негативные последствия возникают в случае пренебрежения противопоказаниями. Ограничения к приему:
- язвенная болезнь желудка и 12-перстной кишки;
- гастрит, повышенная кислотность среды;
- возраст до 6 лет.
Уксус способствует увеличению кислотности органов желудочно-кишечного тракта, поэтому ее противопоказано принимать внутрь при соответствующих заболеваниях (панкреатите и др.).
Вещество оказывает мочегонное действие. В связи с этим его нельзя употреблять лицам, страдающим циститом и патологиями, протекающими с учащением позывов к мочеиспусканию. Противопоказано использование уксусной кислоты при нарушении функционирования печени.
Органическое соединение разрушает ткани десен и зубную эмаль. Поэтому после приема средств с его добавлением рекомендуется прополоскать ротовую полость. Для снижения нагрузки на структуры рта при употреблении растворов с присутствием кислоты можно использовать трубочку.
Чем опасна передозировка
Если систематически превышать рекомендуемую дозировку, разрушается и сворачивается белок в организме, возникают участки с некротическими изменениями тканей желудочно-кишечного тракта.
После всасывания уксусной кислоты в кровоток и его окисления начинают видоизменяться эритроцитарные клетки.
В итоге в кровь свободно выбрасывается гемоглобин, провоцирующий сбои в работе почек и печени, в том числе недостаточность органов.
Важно! За счет сильного химического ожога слизистых оболочек пищевода и других внутренних органов возможет летальный исход.
Особенности применения уксусной кислоты
Для снижения риска возникновения негативных последствий нужно изучить правила использования. В первую очередь – это соблюдение рекомендуемой дозировки средства. Для детей, взрослых и лиц пожилого возраста суточный объем варьируется. Поэтому перед применением составов внутрь нужно проконсультироваться с врачом.
В народной медицине
Приготовление средств на основе уксусной кислоты отличается в зависимости от цели применения:
- в лечении гинекологических патологий, бессонницы и головной боли: взять 1 ст.л. 5%-го уксуса, развести в 1 л воды, делать спринцевание влагалища разово в день или принимать внутрь по 1 ст.л. трижды в день;
 для устранения неприятного запаха изо рта при заболеваниях желудочно-кишечного тракта: взять 2 капли 70%-й уксусной кислоты, смешать с 200 мл настоя мяты, проводить полоскания ротовой полости после очищения зубов пастой;
для устранения неприятного запаха изо рта при заболеваниях желудочно-кишечного тракта: взять 2 капли 70%-й уксусной кислоты, смешать с 200 мл настоя мяты, проводить полоскания ротовой полости после очищения зубов пастой;- в лечении геморроидальных узлов и варикозной болезни: взять по 60 г кардамона, мальвового листа, плодов шиповника, тимьяна, 9%-ый уксус в объеме 100 мл и 300 мл воды, смешать, настоять в течение недели, делать аппликации на больную зону перед сном, выдерживая до утра;
- при ожогах кожного покрова и после укуса насекомого: развести в воде 9%-ый уксус в соотношении 2:1, смазывать полученным составом пораженные участки несколько раз в день;
- в терапии заболеваний суставов: взять 70%-ую кислоту (50 мл), скипидар и растительное масло по 1 ст.л., 1 куриное яйцо, воду в объеме 300 мл, смешать, наносить под компресс на больные области на ночь;
Рекомендуем: Избавляемся от муравьев уксусом — советы по обработке
При атеросклерозе делают следующий состав: смешать лимонный, чесночный сок по 1 ст.л., добавить 50 мл 6%-го яблочного уксуса и 500 г меда, употреблять внутрь по 1 ст.л., предварительно растворяя в 200 мл теплой воды (трижды в день).
В косметологии
Для придания блеска и здоровья волосам рекомендуется проводить ополаскивания уксусом. После такой процедуры расчесывание проходит легко, локоны не путаются.
Уксус добавляют в косметические средства, в частности, в кремы. Это обеспечивает антивозрастной уход за кожей лица, оказывает омолаживающее действие. Нормализуется деятельность сальных желез, устраняется блеск, разглаживаются морщины.
В промышленности
Уксусная кислота – это растворитель, поэтому ее используют в производстве ацетона, различных искусственных пигментов, негорючих пленок, а также в книгопечатании, крашении.
Совет! В сельскохозяйственной деятельности кислота эффективно помогает избавиться от агрессивных сорняков.
Другое
В пищевой промышленности органическое соединение – это консервант, натуральная добавка к пище, регулирующая кислотный баланс продуктов. Его используют в процессе приготовления майонеза и кондитерских изделий.
В бытовых условиях кислоту применяют для удаления накипи из посуды, сантехники, бытовой техники, пятен на одежде, домашнем текстиле. За счет способности дезинфицировать, веществом проводят обработку различных поверхностей.
Итоги
Уксусная кислота – комплексное средство, используемое в различных отраслях. Однако злоупотреблять применением составов на ее основе не рекомендуется. Перед приемом внутрь и обработкой кожных покровов нужно обратиться к врачу и получить консультацию.
Источник: https://ProUksus.ru/chto-takoe-uksusnaya-kislota.html
Разница между Муравьиной и Уксусной кислотой
Основное различие между Муравьиной кислотой и Уксусной кислотой заключается в том, что Муравьиная кислота (или метановая кислота, HCOOH) содержит группу карбоновой кислоты, присоединенную к атому водорода, тогда как Уксусная кислота (или этановая кислота, CH3COOH) содержит метильную группу, присоединенную к карбоновой кислоте. кислота.
И муравьиная кислота, и уксусная кислота являются простыми карбоновыми кислотами. Однако муравьиная кислота является простейшей карбоновой кислотой, тогда как уксусная кислота является второй простейшей карбоновой кислотой. Оба эти соединения являются кислотными соединениями.
Содержание
- Обзор и основные отличия
- Что такое Муравьиная кислота
- Что такое Уксусная кислота
- Сходство между Муравьиной и Уксусной кислотой
- В чем разница между Муравьиной и Уксусной кислотой
- Заключение
Что такое Муравьиная кислота?
Муравьиная кислота — это простейшая карбоновая кислота, в которой группа карбоновых кислот присоединена к атому водорода. Химическая формула этой кислоты HCOOH или CH2O2. Химическое название этого соединения — метановая кислота. Это соединение встречается в природе у некоторых муравьев, пчел и крапиве.
 Химическая структура Муравьиной кислоты
Химическая структура Муравьиной кислоты
Химические свойства муравьиной кислоты:
- Химическая формула — CH2O2/НСООН
- Молярная масса — 46,03 г/моль
- Физическое состояние — жидкость при комнатной температуре
- Цвет — бесцветный
- Запах — острый запах
- Температура плавления — 8,4 °С
- Точка кипения — 100,8 °С
- Растворимость в воде — смешивается с водой
Паровая фаза муравьиной кислоты имеет димеры из-за водородных связей между ее молекулами. Две молекулы муравьиной кислоты могут образовывать две водородные связи друг с другом, образуя димер. Из-за этой способности образовывать водородные связи с молекулами воды он смешивается с водой.
Производство муравьиной кислоты
В производстве муравьиной кислоты в основном используются метилформиат и формамид. Гидролиз метилформиата дает муравьиную кислоту.
Метилформиат является результатом реакции между метанолом и углекислым газом в присутствии сильного основания, такого как метоксид натрия.
Иногда метилформиат сначала превращается в формамид (путем взаимодействия метилформиата с аммиаком), который затем гидролизуется серной кислотой для получения муравьиной кислоты.
Что такое Уксусная кислота?
Уксусная кислота является второй простейшей карбоновой кислотой, которая имеет метильную группу, присоединенную к группе карбоновой кислоты. Химическое название этого соединения — этановая кислота. Химическая формула уксусной кислоты — CH3COOH.
 Химическая структура Уксусной кислоты
Химическая структура Уксусной кислоты
Химические свойства уксусной кислоты:
- Химическая формула — CH3COOH
- Молярная масса — 60,05 г/моль
- Физическое состояние — жидкость при комнатной температуре
- Цвет — бесцветный
- Запах — уксусоподобный запах
- Температура плавления — 16,6 °C
- Точка кипения — 118,1 °С
- Растворимость в воде — смешивается с водой
Уксусная кислота является основным компонентом уксуса. Обладает характерным кислым вкусом и резким запахом. Атом водорода группы карбоновой кислоты в уксусной кислоте может отделяться от молекулы посредством ионизации молекулы.
Следовательно, это кислая молекула. Кроме того это слабое монопротонное соединение. Твердая уксусная кислота имеет молекулы, расположенные в виде цепочек из-за присутствия водородных связей между молекулами.
Но в её паровой фазе имеются димеры.
Производство уксусной кислоты
Производят уксусную кислоту двумя способами: синтетическим и с помощью бактериального брожения. Процесс, используемый при синтезе уксусной кислоты — это карбонилирование метанола. Этот метод включает реакцию между метанолом и окисью углерода.
Каковы сходства между Муравьиной кислотой и Уксусной кислотой?
- Муравьиная кислота и уксусная кислота являются карбоновыми кислотами
- Обе являются бесцветными жидкостями при комнатной температуре
- Обе кислоты имеют сильный запах
- Они обе способны образовывать димеры
- С молекулами воды обе могут образовывать водородные связи
- Кроме того, обе кислоты смешиваются с водой
В чем разница между муравьиной и уксусной кислотой?
| Муравьиная кислота против Уксусной кислоты |
|
| Муравьиная кислота является простейшей карбоновой кислотой, которая имеет группу карбоновой кислоты, присоединенную к атому водорода | Уксусная кислота является второй простейшей карбоновой кислотой, которая имеет метильную группу, присоединенную к группе карбоновой кислоты |
| Химическое Название |
|
| Метановая кислота | Этановая кислота |
| Химическая формула |
|
| CH3COOH | НСООН |
| Химическая структура |
|
| Содержит атом водорода, связанный с карбоксильной группой | Содержит метильную группу, связанную с карбоксильной группой |
| Молярная масса |
|
| 46,03 г/моль | 60,05 г/моль |
| Температура кипения |
|
| 100,8 °С | 118,1 °С |
| Температура плавления |
|
| 8,4 °С | 16,6 °С |
Разница между Фениламином и Аминобензолом
Муравьиная кислота и Уксусная кислота являются простейшими соединениями карбоновых кислот. Ключевое различие между Муравьиной кислотой и Уксусной кислотой состоит в том, что Муравьиная кислота содержит группу карбоновой кислоты, присоединенную к атому водорода, тогда как Уксусная кислота содержит метильную группу, присоединенную к карбоновой кислоте.
Источник: https://raznisa.ru/raznica-mezhdu-muravinoj-i-uksusnoj-kislotoj/
Кислота уксусная
Главная → Продукция → Химическое сырье и реактивы → Химреактивы полный перечень → Кислота уксусная
Описание
Цена
Уксусная кислота (этановая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
Физические свойства
- Молярная масса 60,05 г/моль
- Плотность 1,0492 г/см³
- Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
- Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу.
Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Получение
- Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
- Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре 50—60 °С.
- Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
![]()
Химические свойства
- Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом каброксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
- В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
- На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты).
- Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
- Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
- Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
- Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
- Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
- Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
| Скачать прайс-лист | в PDF формате |
| Кислота уксусная |
Источник: http://www.lab.kh.ua/products/sewerage/ximreaktivy-polnyj-perechen/kislota-uksusnaya
Химические свойства уксусной кислоты
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.

Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Рис. 1. Уксусная кислота.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
| Взаимодействие | Что образуется | Пример |
| С металлами | Соль, водород | Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
| С оксидами | Соль, вода | CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
| С основаниями | Соль, вода | CH3COOH + NaOH → CH3COONa + H2O |
| С солью | Соль, углекислый газ, вода | 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
| С неметаллами (реакция замещения) | Органическая и неорганическая кислоты |
|
| С кислородом (реакция окисления) | Углекислый газ и вода | CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
Рис. 3. Использование уксусной кислоты.
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус.
Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом.
Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Средняя оценка: 4.2. Всего получено оценок: 206.
Источник: https://obrazovaka.ru/himiya/himicheskie-svoystva-uksusnoy-kisloty-poluchenie.html
Формула уксусной кислоты
ОПРЕДЕЛЕНИЕ
Уксусная кислота (этановая кислота, метанкарбоновая кислота) представляет собой органическое вещество с формулой ( mathrm{CH}_{3} mathrm{COOH} ) . Слабая, маргинальная одноосная карбоновая кислота.
- Химические и структурные формулы уксусной кислоты
- Химическая формула: ( mathrm{CH}_{3} mathrm{COOH} )
- Валовая формула: ( mathrm{C} 2 mathrm{H} 4 mathrm{O} 2 )
- Структурная формула:
Структурно-химическая формула уксусной кислоты
Молярная масса: 60,05 г / моль.
Уксусная кислота является терминальной одноосновной карбоновой кислотой. Соли формы — ацетаты.
Слабая кислота, константа диссоциации Ka = 1,75 • 10-5, pKa = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота представляет собой бесцветную жидкость с острым характерным запахом, кислым вкусом. Гигроскопично, растворим в воде на неопределенный срок. Существует в виде димеров. Безводная уксусная кислота называется льдом, потому что она образует ледяную массу, когда она замерзает.
- Химические свойства уксусной кислоты
- Уксусная кислота обладает всеми основными свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
- ( M g+2 C H_{3} operatorname{COOH}=left(C H_{3} C O O
ight)_{2} M g+H_{2} uparrow ) - Взаимодействует с оксидами металлов:
- ( mathrm{CaO}+2 mathrm{CH}_{3} mathrm{COOH}=left(mathrm{CH}_{3} mathrm{COO}
ight)_{2} mathrm{Ca}+mathrm{H}_{2} mathrm{O} ) - Взаимодействует с гидроксидами металлов:
- ( mathrm{NaOH}+mathrm{CH}_{3} mathrm{COOH}
ightarrow mathrm{CH}_{3} mathrm{COONa}+mathrm{H}_{2} mathrm{O} ) - В присутствии серной кислоты происходит реакция этерификации с образованием сложных эфиров:
- ( mathrm{CH}_{3} mathrm{COOH}+_{2} mathrm{H}_{5}
ightarrow mathrm{CH}_{3} mathrm{COOC}_{2} mathrm{H}_{5}+2 mathrm{H}_{2} mathrm{O} ) - Он входит в реакции галогенирования с образованием галогенуксусных кислот:
- ( mathrm{CH}_{3} mathrm{COOH}+mathrm{Cl}_{2}
ightarrow mathrm{CH}_{2} mathrm{ClCOOH}+mathrm{HCl} ) - Реакция горения:
- ( mathrm{CH}_{3} mathrm{COOH}+mathrm{O}_{2}
ightarrow mathrm{CO}_{2}+2 mathrm{H}_{2} mathrm{O} ) - Качественная реакция на соли уксусной кислоты представляет собой взаимодействие с сильными кислотами. Уксусная кислота слабая и замещается сильными кислотами из солевых растворов, в то время как характерный запах появляется:
- ( mathrm{CH}_{3} mathrm{COO}^{-}+mathrm{H}^{+}
ightarrow mathrm{CH}_{3} mathrm{COOH} ) - Чек. Наиболее экономически выгодным промышленным способом получения уксусной кислоты является карбонилирование метанола монооксидом углерода, катализатором являются родиевые соли, а промотором являются иодидные ионы:
- ( mathrm{CH}_{3} mathrm{OH}+mathrm{CO}
ightarrow mathrm{CH}_{3} mathrm{COOH} ) - Биохимический метод — окисление этанола:
- ( mathrm{CH}_{3} mathrm{CH}_{2} mathrm{OH}+mathrm{O}_{2}
ightarrow mathrm{CH}_{3} mathrm{COOH}+mathrm{H}_{2} mathrm{O} )
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), домашняя кулинария и консервирование. Уксусная кислота используется для получения лекарственных и ароматических веществ в качестве растворителя.
- Концентрированная уксусная кислота (с концентрацией более 30%) может вызвать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей
- Примеры решения проблем
- ПРИМЕР 1
Рассчитать ( mathrm{pH} ) раствора уксусной кислоты с молярной концентрацией 1 моль / л, константа диссоциации которой составляет 1,75 • 10-5.
- Напишите уравнение диссоциации для уксусной кислоты:
- ( mathrm{CH}_{3} mathrm{COOH} leftrightarrow mathrm{CH}_{3} mathrm{COO}^{-}+mathrm{H}^{+} )
- Константа диссоциации кислоты:
- ( K_{a}=frac{left[C H_{3} C O O^{-}
ight]left[H^{+}
ight]}{left[C H_{3} C O O H
ight]} ) - Обозначим через ( x ) концентрацию ионов водорода ( x=[mathrm{H}+] ), то выражение для константы диссоциации принимает вид:
- ( K_{a}=frac{x^{2}}{C-x} )
- Отсюда
- ( x=sqrt{K_{a}(C-x)} )
- Поскольку уксусная кислота слабая, ( x < C ), полученное выражение может быть упрощено:
- ( x=sqrt{K_{a} C}=sqrt{1,75 cdot 10^{-5} cdot 1}=0,004183 моль/л )
- ( mathrm{pH} ) — отрицательный десятичный логарифм равновесной концентрации ионов водорода ( mathrm{H}+ ). Так как ( x=[H+] ), то
- ( p H=-l gleft[H^{+}
ight]=-l g(0,004183)=2,38 ) - ( mathrm{PH} ) раствора составляет 2,38.
- ПРИМЕР 2
Рассчитать ( mathrm{pH} ) раствора, полученного добавлением 5 мл 0,1 М раствора гидроксида натрия до 10 мл 0,1 М раствора уксусной кислоты. Константа диссоциации уксусной кислоты составляет Kа = 1,75 • 10-5.
- Общий объем решения будет равен:
- ( left(C H_{3} C O O H
ight)+Vмл ) - При осушении растворов происходит реакция:
- ( mathrm{CH}_{3} mathrm{COOH}+mathrm{NaOH}=mathrm{CH}_{3} mathrm{COONa}+mathrm{H}_{2} mathrm{O} )
- Рассчитайте количество вещества уксусной кислоты и гидроксида натрия:
- ( n_{mathrm{исх}}left(mathrm{CH}_{3} mathrm{COOH}
ight) =C_{M operatorname{исх}}left(C H_{3} C O O H
ight) .V_{mathrm{исх}}left(C H_{3} C O O H
ight) =0,1 cdot 0,01=0,001 моль ) - ( n_{исх}(N a O H) =C_{M operatorname{исx}}(N a O H) .V_{mathrm{исx}}(mathrm{NaOH}) =0,1 cdot 0,005=0,0005моль )
Согласно уравнению реакции ( mathrm{n}(mathrm{CH} 3 mathrm{COOH})=mathrm{n}(mathrm{NaOH}) ), и в нашем случае ( mathrm{n}(mathrm{CH} 3 mathrm{COOH})>mathrm{n}(mathrm{NaOH}) ), поэтому уксусная кислота берется в избытке. После реакции уксусная кислота и ацетат натрия, то есть мы получили буферную систему.
- Рассчитайте концентрацию ацетата натрия в полученном растворе:
- ( nleft(C H_{3} C O O N a
ight)=n(N a O H)=0,0005моль ) - ( Cleft(C H_{3} C O O N a
ight)=nleft(C H_{3} C O O N a
ight) / V=0,0005 / 0,015=0,033моль/л ) - Концентрация уксусной кислоты в растворе будет равна:
- ( nleft(C H_{3} C O O H
ight)= n_{исх}left(C H_{3} C O O H
ight) -n_{исх}(N a O H) =0,001-0,0005=0,0005моль ) - ( Cleft(C H_{3} C O O
ight)=nleft(C H_{3} C O O
ight) / V=0,0005 / 0,015=0,033 моль/л ) - Концентрация ионов водорода в буферном растворе рассчитывается по формуле:
- ( left[mathrm{H}^{+}
ight]=frac{K_{a} cdot C_{mathrm{CH}, mathrm{COOH}}}{C_{mathrm{CH}_{2} mathrm{COON}_{2}}} ) - где Ka — константа диссоциации уксусной кислоты.
- Затем:
- ( left[H^{+}
ight]=frac{K_{a} cdot C_{C H_{3} C O O H}}{C_{C H_{3} C O O N a}}=frac{1,74 cdot 10^{-5} cdot 0,033}{0,033}=1,74 cdot 10^{-5} моль/л) - Рассчитайте ( mathrm{pH} ) раствора:
- ( p H=-l gleft[H^{+}
ight]=-l gleft(1,74 cdot 10^{-5}
ight)=4,76 )
рН полученного раствора составляет 4,76.
Источник: https://sciterm.ru/spravochnik/formula-uksusnoj-kisloti/