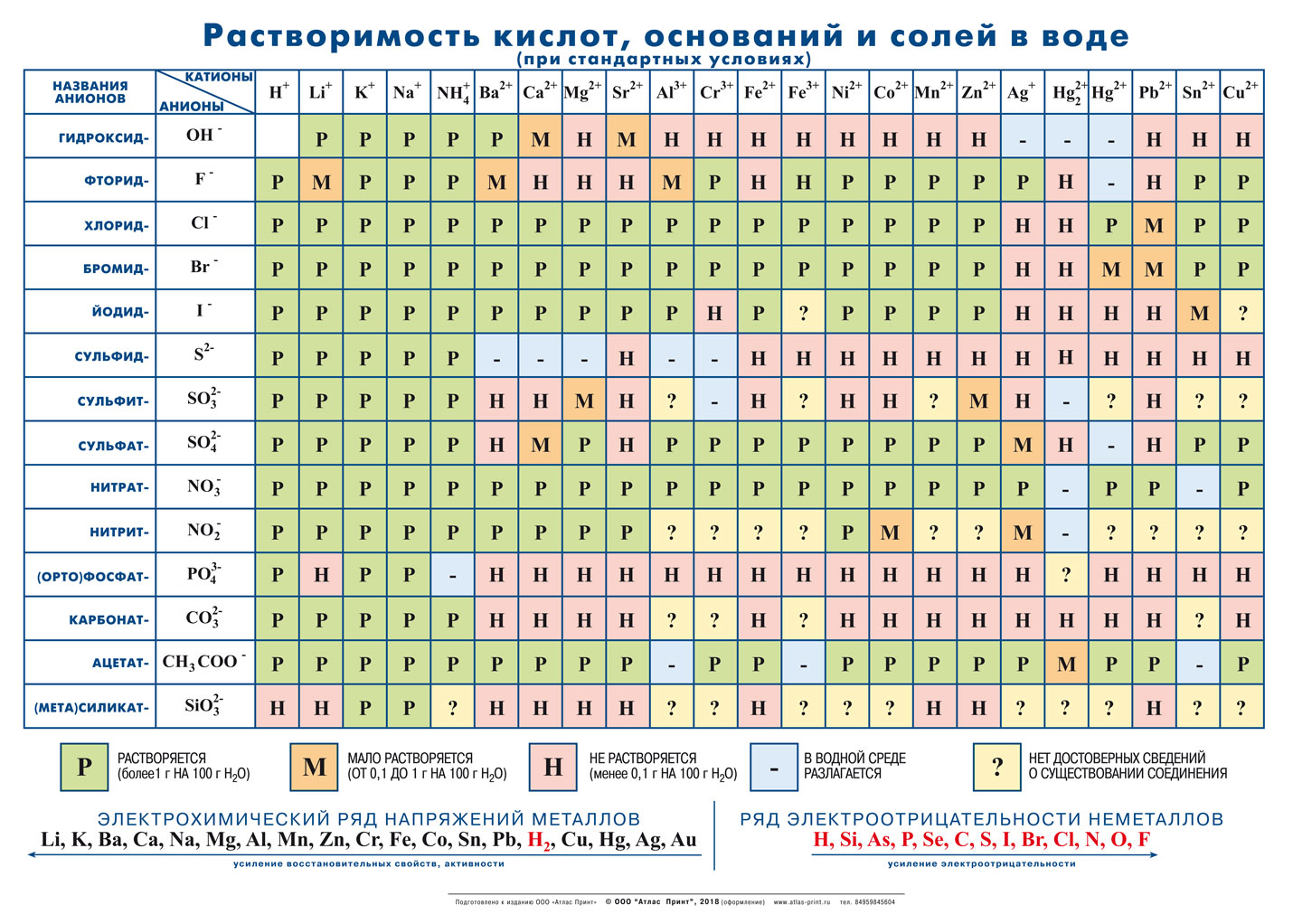
Гидроксид калия (лат. Kalii hydroxidum) — неорганическое соединение с формулой KOH.
Тривиальные названия: едкое кали, каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь, калиевый щёлок.
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Содержание
- 1 Химические свойства
- 2 Применение
- 3 Производство
- 4 Опасность

Химические свойства
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
KOH + HCl ⟶ KCl + H2O 2KOH + H2SO4 ⟶ K2SO4 + 2H2O
- Взаимодействие с кислотными оксидами с образованием соли и воды:
2KOH + CO2 ⟶ K2CO3 + H2O2KOH + SO3 ⟶ K2SO4 + H2O
- Взаимодействие с некоторыми непереходными металлами в растворе с образованием комплексной соли и водорода:
2Al + 2KOH + 6H2O ⟶ 2K[Al(OH)4] + 3H2↑
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов:
2KCl + 2H2O ⟶ 2KOH + H2↑ + Cl2↑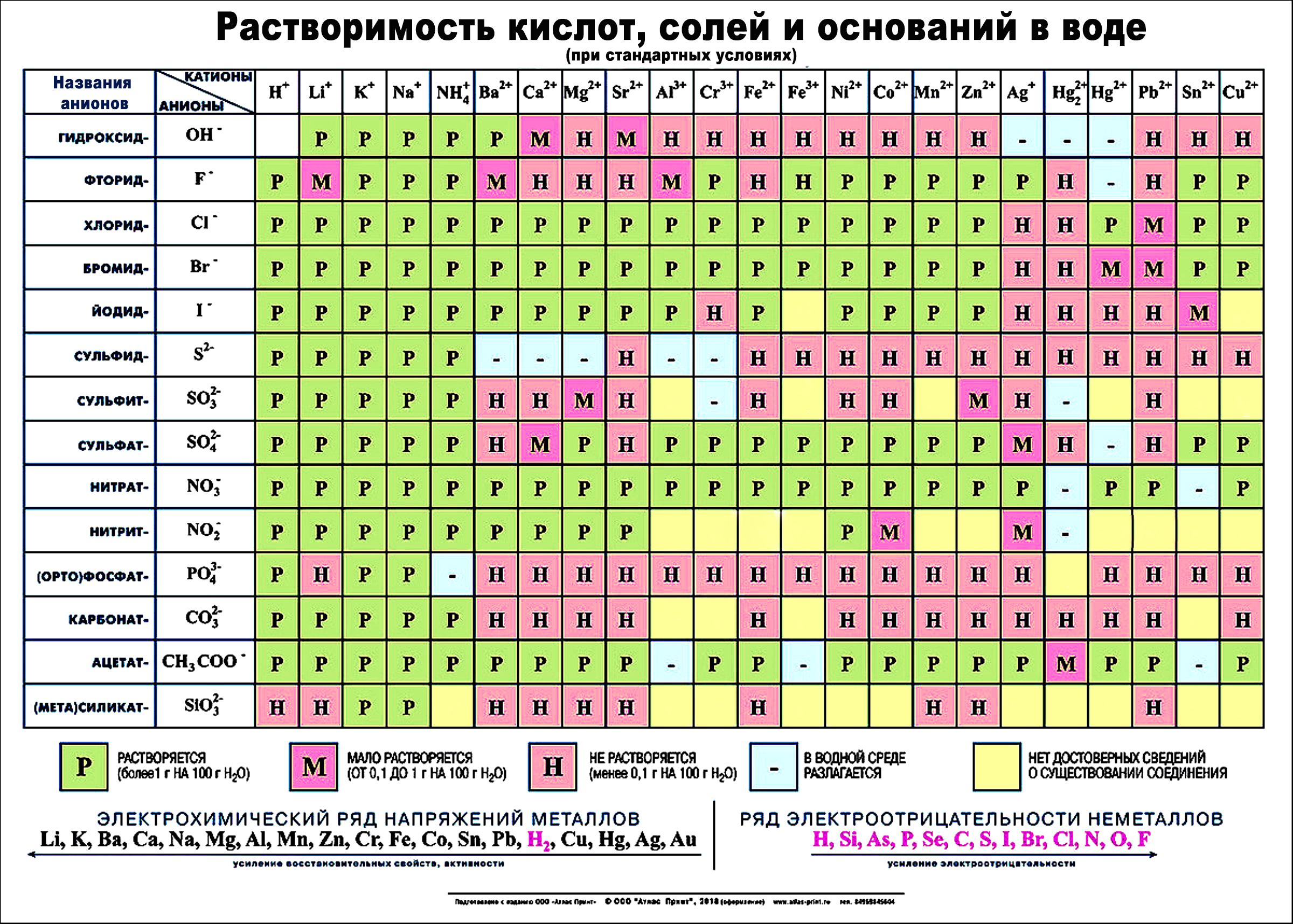
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- щелочные элементы,
- катализ
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- переработка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
- Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
- Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами расщепляется и омыливает при этом масла.
- В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
- В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
- Используется в качестве электролита в щелочных (алкалиновых) батарейках.
- Также применяется в ресомации — альтернативном способе «захоронения» тел.
- 5 % раствор гидроксида калия используется в медицине для лечения бородавок.
- В фотографии используется как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов.
Производство
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
- электролиз с твердым асбестовым катодом (диафрагменный метод производства),
- электролиз с полимерным катодом (мембранный метод производства),
- электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза.
Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути.
Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
- исключается стадия сжижения и испарения хлора,
- водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется мембранным (ООО «Сода-Хлорат») методом.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду.
Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется.
При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.
Опасность
Очень сильная щёлочь. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.
Источник: https://chem.ru/gidroksid-kalija.html
Средняя соль кислая соль
Какого состава средняя соль кислая соль образуется и какова ее массовая доля в растворе, полученном при пропускании 28 литров углекислого газа (CO2) (при нормальных условиях) через 300 грамм раствора гидроксида калия (KOH) с массовой долей этого вещества 23,3%?
Решение задачи
Напомню, что при взаимодействии углекислого газа со щелочью, в зависимости от их количественного соотношения, может протекать одна из двух реакций образования средней соли кислой соли:

- Из уравнений реакции следует, что при молярном соотношении n (CO2) : n (KOH) = 1 : 2 образуется средняя соль – карбонат калия (K2CO3), при соотношении 1 : 1 образуется кислая соль – гидрокарбонат калия (KHCO3).
- Чтобы определить какого состава средняя соль кислая соль образуется, вычислим число молей вступивших в реакцию углекислого газа (CO2) и гидроксида калия (KOH) и их молярное соотношение.
- Так как, углекислый газ (CO2) – это газ, для нахождения химического количества вещества используем формулу, устанавливающую связь между объемом и химическим количеством вещества:
- n (CO2) = 28 л / 22,4 л/моль = 1,25 (моль).
- Вычислим, сколько гидроксида калия (KOH) (в граммах) содержится в 300 грамм 23,3-процентного раствора гидроксида калия (KOH) по формуле:
![]()
- m (KOH) = 300 г ⋅ 0,233 = 69,9 (г).
- Если раствор 23,3-процентный, то массовая доля гидроксида калия (KOH) в нем 0,233.
- Учитывая, что молярная масса гидроксида калия (KOH) равна 56 г/моль (смотри таблицу Менделеева), найдем химическое количество гидроксида калия (KOH) по формуле, устанавливающей связь между массой и химическим количеством вещества:
- Получаем:
- n (KOH) = 69,9 г / 56 г/моль = 1,25 (моль).
Определим какого состава средняя соль кислая соль образуется, отношение n (CO2) : n (KOH) = 1,25 : 1,25 = 1 : 1. Следовательно, образуется гидрокарбонат калия (KHCO3).
- Учитывая, что молярные массы гидрокарбоната калия (KHCO3) и углекислого газа (CO2) соответственно равны 100 и 44 г/моль (смотри таблицу Менделеева), вычислим массы веществ по формуле:
- Получаем:
- m (KHCO3) = 1,25 моль ⋅ 100 г/моль = 125 (г),
- m (CO2) = 1,25 моль ⋅ 44 г/моль = 55 (г).
- Масса полученного раствора равна сумме масс раствора гидроксида калия (KOH) и углекислого газа (CO2):
- m (раствора) = 300 г + 55 г = 355 (г).
- Найдем массовую долю соли гидрокарбоната калия (KHCO3) в полученном растворе по формуле нахождения массовой доли вещества:

w (KHCO3) = 125 г / 355 г = 0,35 или 35%.
Ответ:
образуется кислая соль;
массовая доля соли гидрокарбоната калия равна 0,35.
Источник: https://himik.pro/rastvory/srednyaya-sol-kislaya-sol
Разница между гидроксидом калия и гидроксидом натрия
Натрий и калий являются высокореактивными химическими элементами, которые можно найти в группе 1 периодической таблицы, а также известны как щелочные металлы. Они являются блочными элементами, потому что у них есть валентный электрон на самой внешней орбитали.
И натрий, и калий являются очень полезными химическими элементами, потому что они образуют самые разные химические соединения. Гидроксид калия и гидроксид натрия являются двумя такими соединениями. Они принадлежат к группе, известной как гидроксид щелочного металла.
Гидроксиды щелочных металлов представляют собой химические соединения, содержащие катион металла группы 1 и анион -ОН. Это ионные соединения. Эти гидроксиды являются сильными основаниями и очень едкими.
Основное различие между гидроксидом калия и гидроксидом натрия заключается в том, что Гидроксид калия имеет катион калия и анион -ОН, тогда как гидроксид натрия имеет катион натрия и анион -ОН.
Ключевые области покрыты
1. Что такое гидроксид калия — определение, химические свойства, применение 2. Что такое гидроксид натрия — определение, химические свойства, применение 3.
Сходство между гидроксидом калия и гидроксидом натрия — Краткое описание общих черт 4.
В чем разница между гидроксидом калия и гидроксидом натрия — Сравнение основных различий
Ключевые слова: щелочь, анион, основание, катион, едкий калий, едкий натр, деликатес, KOH, гидроксид металла, NaOH, калий, гидроксид калия, натрий, гидроксид натрия

Что такое гидроксид калия
Гидроксид калия представляет собой щелочной металл, имеющий химическую формулу KOH, Общее название гидроксида калия едкий калий, При комнатной температуре это бесцветное твердое вещество и прочная основа. Поэтому он имеет много промышленных и лабораторных приложений.
Молярная масса гидроксида калия составляет 56,11 г / моль. Это очень твердое вещество без запаха. (Деликатесные вещества — это твердые вещества, которые могут раствориться при поглощении водяного пара.
Полученный раствор представляет собой водный раствор. Этот процесс известен как расплывание, Эти распадающиеся вещества имеют высокое сродство к воде).
Температура плавления гидроксида калия составляет 360 ° С, а температура кипения составляет 1327 ° С.

Рисунок 1: Пеллеты с гидроксидом калия
Гидроксид калия коммерчески доступен в виде полупрозрачных гранул, и когда эти гранулы подвергаются воздействию открытого воздуха, они становятся липкими.
Растворение гидроксида калия в воде является сильно экзотермическим. Более высокие концентрации гидроксида калия вызывают коррозию, тогда как умеренные концентрации могут вызывать раздражение кожи.
Гидроксид калия проявляет высокую термическую стабильность.
Приложения
- В качестве чистящего средства (гидроксид калия можно найти во многих мылах, шампунях и т. Д.
)
- В качестве регулятора pH (это сильная щелочь и может контролировать кислотность)
- Лекарственные применения (для диагностики грибковых заболеваний)
- В обычных бытовых изделиях (щелочные батареи содержат гидроокись калия)
- В качестве пищевой добавки (в качестве стабилизатора)
Что такое гидроксид натрия
Гидроксид натрия представляет собой щелочной металл, имеющий химическую формулу NaOH,, Общее название для гидроксида натрия каустическая сода, Это ионное соединение, содержащее катионы натрия и анионы -ОН. Это сильная база.
Молярная масса гидроксида натрия составляет 39,99 г / моль. При комнатной температуре он выглядит как белые восковые кристаллы, которые непрозрачны. Гидроксид натрия не имеет запаха. Температура плавления гидроксида натрия составляет 318 ° С, а температура кипения составляет 1388 ° С.

Рисунок 2: Гранулы гидроксида натрия
Гидроксид натрия очень щелочной и может вызвать серьезные ожоги. Он хорошо растворим в воде и гигроскопичен. Это означает, что гидроксид натрия может поглощать водяной пар и углекислый газ из атмосферы. Растворение гидроксида натрия в воде является сильно экзотермическим.
Приложения
- Чистящие и дезинфицирующие средства (используются при производстве многих мыл и моющих средств)
- Фармацевтическое и медицинское применение (используется в производстве лекарств, таких как аспирин)
- Водоподготовка (для контроля кислотности воды)
- Древесина и бумажные изделия (для растворения нежелательного материала в древесине)
- Пищевые продукты (например: используется для удаления кожуры с помидоров)
Сходство между гидроксидом калия и гидроксидом натрия
- Оба являются гидроксидами щелочных металлов.
- Оба являются сильными основаниями.
- Оба могут вызвать раздражение кожи;
- Оба растворимы в воде.
- Реакция с водой является сильно экзотермической для обоих соединений.
- Оба могут поглощать пары воды из воздуха.
Определение
Гидроксид калия: Гидроксид калия представляет собой щелочной металл, имеющий химическую формулу KOH.
Едкий натр: Гидроксид натрия представляет собой щелочной металл, имеющий химическую формулу NaOH.
Молярная масса
Гидроксид калия: Молярная масса гидроксида калия составляет 56,11 г / моль.
Едкий натр: Молярная масса гидроксида натрия составляет 39,99 г / моль.
Точка плавления и точка кипения
Гидроксид калия: Температура плавления гидроксида калия составляет 360 ° С, а температура кипения составляет 1327 ° С.
Едкий натр: Температура плавления гидроксида натрия составляет 318 ° С, а температура кипения составляет 1388 ° С.
Катион
Гидроксид калия: Гидроксид калия содержит ион калия в качестве катиона.
Едкий натр: Гидроксид натрия содержит ион натрия в качестве катиона.
Растворение воды
Гидроксид калия: Гидроксид калия менее растворим в воде.
Едкий натр: Гидроксид натрия хорошо растворяется в воде.
Заключение
Гидроксид калия и гидроксид натрия являются сильными основаниями. Оба являются гидроксидами щелочных металлов. Основное различие между гидроксидом калия и гидроксидом натрия состоит в том, что гидроксид калия имеет катион калия и анион -ОН, тогда как гидроксид натрия имеет катион натрия и анион -ОН.
Ссылка:
1. «Гидроксид натрия | Использование, преимущества и факты химической безопасности. ”ChemicalSafetyFacts.org, 22 сентября 2017 г.,
Источник: https://ru.strephonsays.com/difference-between-potassium-hydroxide-and-sodium-hydroxide
Гидроксид кальция
Гидроксид кальция – химическое вещество имеющее сильное основание. Каковы его особенности и химические свойства рассмотрим в данной статье.
Кристаллический гидроксид кальция – это порошок белого цвета, который разлагается при нагревании, но практически нерастворимый в воде. Формула гидроксида кальция – Ca(OH)2 . В ионном виде уравнение образования гидроксида кальция выглядит так:
Рис. 1. Уравнение образование гидроксида кальция.
Гидроксид кальция имеет и другие названия: гашеная известь, известковое молоко, известковая вода
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.
Рис. 2. Гидроксид кальция.
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Ca(OH)2 (гидроксид кальция)+H2SO4 (серная кислота)=CaSo4 (соль – сульфат кальция)+2H2 O (вода).
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:
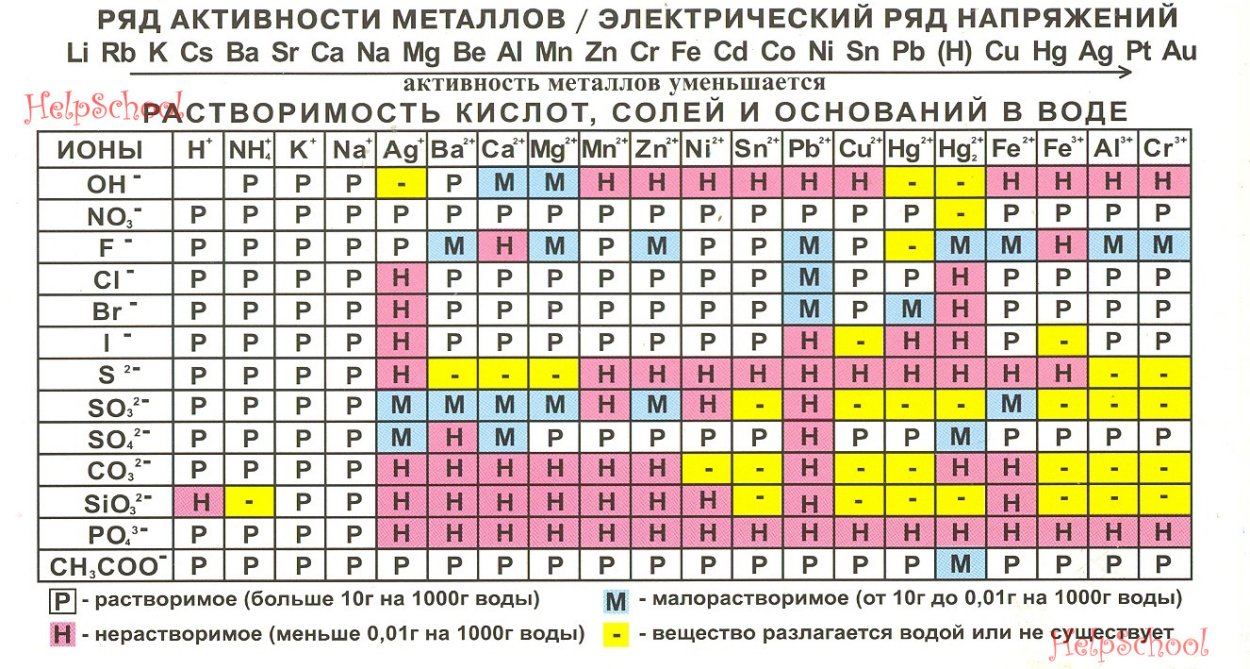
Рис. 3. Гашеная известь.
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).
Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом:
CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Средняя оценка: 4.3. Всего получено оценок: 184.
Источник: https://obrazovaka.ru/himiya/gidroksid-kalciya-formula.html
Свойства гидроксида калия и его кристаллогидратов — Химия

- Неорганическое соединение.
- Альтернативное название
- Едкое кали, калия гидроокись
- Формула
- KOHKOHKOH
Физические свойства
СвойствоОписание
| Внешний вид | Белая гигроскопичная масса |
| Молярная масса | 56,11 г/моль |
| Плотность | при 25°С – 2,044 г/см3 |
| Температура плавления | 405°C |
| Температура кипения | 1325°C |
Химические свойства
- В водном растворе диссоциирует на ионы:
- KOH⟶OH−+K+KOH longrightarrow OH- + K+KOH⟶OH−+K+
- Среда раствора сильно щелочная.
- При взаимодействии с кислотами происходит нейтрализация:
- 2KOH+H2SO4=2H2O+K2SO42KOH + H_2SO_4 =2H_2O + K_2SO_42KOH+H2SO4=2H2O+K2SO4
- Гидроксид калия вступает в реакции обмена с образованием нерастворимых гидроксидов или оксидов:
- 2KOH+2AgNO3=Ag2O↓+H2O+2KNO32KOH + 2AgNO_3 = Ag_2O↓ + H_2O + 2KNO_32KOH+2AgNO3=Ag2O↓+H2O+2KNO3,
- 2KOH+FeCl3=Fe(OH)3↓+3KCl2KOH + FeCl_3 = Fe(OH)_3↓ + 3KCl2KOH+FeCl3=Fe(OH)3↓+3KCl
- Расплавленный KOHKOHKOH реагирует с BeBeBe, AlAlAl, GaGaGa, ZnZnZn, SnSnSn, PbPbPb, SbSbSb и их оксидами и гидроксидами с образованием солей (напр., KAlO2KAlO_2KAlO2, K2ZnO2K_2ZnO_2K2ZnO2) и выделением соответственно H2H_2H2 или H2OH_2OH2O:
- 2KOH+Sn=K2SnO2+H2↑2KOH + Sn = K_2SnO_2 + H_2↑2KOH+Sn=K2SnO2+H2↑,
- 2KOH+Al2O3=2KAlO2+H2O2KOH + Al_2O_3 = 2KAlO_2 + H_2O2KOH+Al2O3=2KAlO2+H2O,
2KOH+Be(OH)2=K2BeO2+2H2O2KOH + Be(OH)_2 = K_2BeO_2 + 2H_2O2KOH+Be(OH)2=K2BeO2+2H2O.
- В водных растворах образуются гидроксокомплексы:
- 2KOH+Sn+2H2O=K2[Sn(OH)4]+H2↑2KOH + Sn + 2H_2O = K2[Sn(OH)4] + H2↑2KOH+Sn+2H2O=K2[Sn(OH)4]+H2↑,
- 2KOH+Al2O3+2H2O=2K[Al(OH)4]2KOH + Al_2O_3 + 2H_2O = 2K[Al(OH)_4]2KOH+Al2O3+2H2O=2K[Al(OH)4],
- 2KOH+Be(OH)2=K2[Be(OH)4]2KOH + Be(OH)_2 = K_2[Be(OH)_4]2KOH+Be(OH)2=K2[Be(OH)4].
Водные растворы KOHKOHKOH и его расплав взаимодействует с BBB, SiSiSi, GeGeGe и их оксидами и кислотами с образованием соотв. KBO2KBO_2KBO2, K[B(OH)4]K[B(OH)_4]K[B(OH)4], K2B4O7K_2B_4O_7K2B4O7, полисиликатов и полигерманатов:
2KOH+2B=2KBO2+H2↑2KOH + 2B = 2KBO_2 + H_2↑2KOH+2B=2KBO2+H2↑ (расплав);
2KOH+B+2H2O=K2[B(OH)4].+H2↑2KOH + B + 2H_2O= K_2[B(OH)_4]. + H_2↑2KOH+B+2H2O=K2[B(OH)4].+H2↑ (водный р-р);
- 2KOH+2SiO2=K2Si2O5+H2O2KOH + 2SiO_2 = K_2Si_2O_5 + H_2O2KOH+2SiO2=K2Si2O5+H2O (водный р-р).
- При взаимодействии с углекислым и сернистым газом образуются гидрокарбонаты и гидросульфиты:
- KOH+CO2=KHCO3KOH + CO_2 =KHCO_3KOH+CO2=KHCO3,
- KOH+SO2=KHSO3KOH + SO_2 = KHSO_3KOH+SO2=KHSO3.
- При взаимодействии с диоксидом азота образуется смесь нитрита и нитрата калия:
KOH+2NO2=KNO2+KNO3+H2OKOH + 2NO_2 = KNO_2 + KNO_3 + H_2OKOH+2NO2=KNO2+KNO3+H2O.
При взаимодействии с угарным газом образуется формиат калия:
KOH+CO=HCOOKKOH + CO = HCOOKKOH+CO=HCOOK
Определить присутствие ионов калия можно по фиолетовому окрашиванию пламени, правда, обычно перебивает цвет всегда присутствующий рядом натрий. Тогда пламя нужно рассматривать через синий светофильтр.
Получение в лаборатории
Гидроксид калия в лаборатории получают пропусканием раствора сульфата калия через анионит или взаимодействием раствора поташа K2CO3K_2CO_3K2CO3 и известковой воды Ca(OH)2Ca(OH)_2Ca(OH)2:
K2CO3+Ca(OH)2=CaCO3↓+2KOHK_2CO_3 + Ca(OH)_2 = CaCO_3↓ + 2KOHK2CO3+Ca(OH)2=CaCO3↓+2KOH.
Получение в промышленности
Калия гидроксид получают электролизом водных растворов KClKClKCl или K2CO3K_2CO_3K2CO3 с железным катодом:
KCl+H2O=KOH+HCl.KCl + H_2O = KOH + HCl.KCl+H2O=KOH+HCl.
Также его производят взаимодействием раствора поташа K2CO3K_2CO_3K2CO3 и известковой воды Ca(OH)2Ca(OH)_2Ca(OH)2:
K2CO3+Ca(OH)2=CaCO3↓+2KOHK_2CO_3 + Ca(OH)_2 = CaCO_3↓ + 2KOHK2CO3+Ca(OH)2=CaCO3↓+2KOH
Применение
- Гидроксид калия применяют:● для производства жидкого мыла и соединений калия;
- ● для очистки газов от COCOCO, CO2CO_2CO2, SO2SO_2SO2, NO2NO_2NO2, H2SH_2SH2S;
- ● для осушения NH3NH_3NH3, PH3PH_3PH3, N2ON_2ON2O;● в щелочных аккумуляторах.
Пример решения задачи
- Сколько водорода выделится при растворении избытка цинка в 1 л 50% раствора гидроксида калия (ρ=1,516
ho=1,516ρ=1,516 г/см3)? - Решение
- Вес раствора
- mp=ρV=1,516⋅1000=1516m_p=
ho V =1,516cdot1000 =1516mp=ρV=1,516⋅1000=1516 г. - Вес KOHKOHKOH
- mKOH=1516⋅50%/100%=758m_{KOH}=1516cdot50\%/100\% =758mKOH=1516⋅50%/100%=758 г
- 758758758 г ext{г}г — xxx л ext{л}л
- 2KOH+Zn+2H2O=K2[Zn(OH)4]+H2↑2KOH + Zn + 2H_2O = K_2[Zn(OH)_4] + H_2↑2KOH+Zn+2H2O=K2[Zn(OH)4]+H2↑
- 2 моля — 1 моль
- 2⋅56,112cdot56,112⋅56,11 г ext{г}г — 22,422,422,4 л ext{л}л112,22112,22112,22 г ext{г}г — 22,422,422,4 л ext{л}л
- Составляем пропорцию:
- 112,22112,22112,22 г ext{г}г KOHKOHKOH — 22,422,422,4 л ext{л}л H2H_2H2,
- 758758758 г ext{г}г KOHKOHKOH — xxx л ext{л}л H2H_2H2.
- Отсюда
- x=758∗22,4112,22=567x=frac{758ast22,4}{112,22} = 567x=112,22758∗22,4=567 г.
- 1 моль KOHKOHKOH – 74,55574,55574,555 г ext{г}г,
- xxx молей KOHKOHKOH – 567567567 г ext{г}г.
- Отсюда
- x=567∗174,555=151,3x=frac{567ast1}{74,555} = 151,3x=74,555567∗1=151,3 л.
Ответ: 151,3151,3151,3 л. ext{л}.л.
Гидроксид калия

Гидроксид калия, калий гидроксид — неорганическое соединение ряда гидроксидов состава KOH. Белые, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем в гидроксида натрия. Водные растворы КОН имеют сильнощелочную реакцию.
Гидроксид получают электролизом растворов KCl. Вещество применяются в производстве стекла, жидкого мыла, для получения различных соединений калия.
Ртутный метод
- В ртутном методе применяется особо чистый раствор хлорида калия, потому что даже незначительные примеси металлов (хрома, вольфрама, молибдена, ванадия), вплоть до миллионных долей, могут привести к появлению побочных процессов на катоде.
- В водном растворе хлорид калия распадается на ионы и ионы K + мигрируют к ртутного катода (жидкая ртуть в железной трубке), где образуют жидкие амальгамы переменного состава:
- Амальгамы выделяются из реакционной системы и переводятся в другую, где происходит разложение их водой с образованием гидроксида калия:
По этому методу образуется раствор KOH концентрацией более 50% и практически свободен от загрязняющих примесей (хлора, хлорида калия). Дальнейшее концентрирование раствора происходит путем упаривания в вакууме при высокой температуре. Образована в результате разложения ртуть возвращается в электрод.
На аноде (графитовом или другом) происходит окисление хлорид-ионов с образованием свободного хлора
Диафрагменные метод
В диафрагменного методе пространство между катодом и анодом разъединен перегородкой, которая не пропускает растворы и газы, однако не препятствует прохождению электрического тока и миграции ионов. Обычно, в качестве таких перегородок используется асбестовая ткань, пористые цементы, фарфор и т.
В анодный пространство подается раствор KCl: на аноде (графитовом или магнетитовых) восстанавливаются хлорид-ионы, а катионы K + (и, частично, анионы Cl -) мигрируют сквозь диафрагму к катодной пространства. Там катионы где сочетаются с гидроксид-ионами, образованными восстановлением воды на железном или медном катоде:
С катодной пространства в результате выделяется смесь гидроксида и хлорида натрия с содержанием KOH 8-10%. Путем испарения удается увеличить концентрацию гидроксида до 50%, но содержание хлорида все равно остается существенным — около 1,0-1,5%. Дальнейшая очистка является экономически нецелесообразным.
Мембранный метод
Мембранный метод считается наиболее совершенным из существующих, но, в то же время, и наиболее энергоемким.
По этому методу в реакторе устанавливается катионообменная мембрана, которая является проницаемой для ионов K +, движущихся в катодный пространство, и подавляет миграцию гидроксид-ионов, движущихся в обратном направлении — таким образом в катодном пространстве увеличивается концентрация составляющих KOH. По этому методу образуется раствор гидроксида концентрацией 32%, а последующим выпаривания это значение удается повысить до 45-50%.
Хлорид калия при этом теоретически не образуется, но проникновение хлорид-ионов через мембрану все же имеет место — в конечном растворе концентрация KCl составляет около 10-50 миллионных долей.
Источник: https://himya.ru/svojstva-gidroksida-kaliya-i-ego-kristallogidratov.html
Калий гидроокись
Вещество является сильным основанием, оно бурно реагирует с кислотой и коррозионно-агрессивно во влажном воздухе в отношении металлов типа цинка, алюминия, олова и свинца с образованием горючего/взрывчатого газа водород – (см. ICSC0001). Реагирует с солями аммония образуя аммиак с опасностью пожара или взрыва. Агрессивен в отношении некоторых форм пластиков, резины и полимеров.
Упаковка: п/п мешок 25 кг.
Страна производитель: Россия, Франция, Иордания, Китай, Корея, Чехия.
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- алкалиновые батареи,
- катализ,
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- перегонка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.
Одна из важнейших областей применения гидроксида калия — производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов.
Другая важная область применения — производство различных солей калия. Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере.
Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия.
Гидроксид калия также применяют вместе с каустической содой в производстве многих красителей и других органических соединений, а также как адсорбент газов, дегидратирующий агент, осадитель нерастворимых гидроксидов металлов, в щелочных аккумуляторах, для получения различных соединений калия.
Кроме того, гидроксид калия используется для обеззараживания сточных вод, в азотной промышленности для осушки газов, в резинотехнической промышленности в качестве «калийного мыла», предотвращающего слипание крошки каучука и др.
Жидкий технический гидроксид калия применяется при производстве удобрений, синтетического каучука, электролитов, реактивов, в медицинской промышленности.Чешуированный гидроксид калия используется в производстве удобрений и синтетического каучука, в фармацевтической промышленности и в других отраслях.
Гидроокись калия техническая применяется для выщелачивания отливок стального литья, для поддержания в заданных пределах щелочности буровых растворов, для производства удобрений, синтетического каучука и в других отраслях.
Особенности и тенденции технологий производства
В промышленном масштабе гидроксид калия получают электролизом хлористого калия. Возможны три варианта проведения электролиза: электролиз с твердым асбестовым или полимерным к
тодом (диафрагменный и мембранный методы производства), электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно – в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути.
Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи: исключается стадия сжижения и испарения хлора, водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
В России производство гидроксида калия осуществляется ртутным (ЗП КЧХК) и диафрагменным (Сода-Хлорат) методами. Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкий калий, так и каустическую соду.
Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется.
При этом в случае изменений на рынке возможен безболезненный перевод электролизеров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.
На международном рынке наиболее современный технологический подход демонстрирует корейская «OCI Corporation», являясь одним из лидеров по производству гидроокиси калия мембранным методом, гарантирующим не только высокое качество продукции, но и чрезвычайно низкое содержание ненормируемой другими производителями ртути и тяжелых металлов. Т.к. мембранный метод производства является достаточно новым, большинство старых предприятий по всему миру все еще использует ртутный метод: французский PPC sas., немецкий Degussa и прочие крупные мировые производители, не производившие перехода на новые технологии производства.
Источник: http://develope.himlogistik.com/kalij-gidrookis
Гидроксид калия — Potassium hydroxide
Гидроксид калия представляет собой неорганическое соединение с формулой К ОН , и обычно называется едкого кали .
Наряду с гидроксидом натрия (NaOH), это бесцветное твердое вещество является прототипическая сильным основанием . Она имеет много промышленных и нишевых приложений, большинство из которых эксплуатируют ее едкий характер и его реактивность по отношению к кислотам .
По оценкам , 700 000 до 800 000 тонн были произведены в 2005 году около 100 раз больше , чем NaOH , KOH производится ежегодно. КОН отметить в качестве предшественника для большинства мягких и жидких мыл , а также различных химических веществ , содержащих калий. Это белое твердое вещество, опасно едкий.
Большинство коммерческих образцов ca. 90% чистоты, остальное вода и карбонаты.
Свойства и структура
Гидроксид калия обычно продается в виде прозрачных гранул, которые становятся липкими в воздухе , потому что это КОН гигроскопичен .
Следовательно, КОН обычно содержит различные количества воды (а также карбонаты — смотри ниже). Его растворение в воде сильно экзотермической . Концентрированные водные растворы иногда называют калий щелоки .
Даже при высоких температурах, твердый КОН не легко обезвоживает.
Состав
При более высоких температурах, твердая КОН кристаллизуется в NaCl кристаллической структуры . ОН — группа либо быстро или случайным образом неупорядоченной так что ОН -группа эффективно сферический анион радиус 1,53 Å (между Cl -и F -в размерах).
При комнатной температуре ОН -группы упорядочены и окружающая среда о K +центров искажается, с K +-ОН -расстояния в пределах от 2,69 до 3,15 Å, в зависимости от ориентации группы ОН.
КОН образует ряд кристаллических гидратов , а именно моногидрат KOH ° H2 O, дигидрат КОН · 2Н2 Oи тетрагидрат КОН · 4Н2 вывода.
Термическая стабильность
Как NaOH, КОН обладает высокой термической стабильностью . Газообразные вид димерные . Из — за своей высокой стабильностью и относительно низкой температурой плавления , часто расплава литье под давлением в виде гранул или стержней, форм , которые имеют низкую площадь поверхности и удобные свойства обработки.
Реакции
Основность, растворимость и свойства десикации
О 121 г КОН растворить в 100 мл воды при комнатной температуре, что контрастирует с 100 г / 100 мл для NaOH. Таким образом , на молярной основе, КОН немного меньше растворим , чем NaOH.
Более низкие низкомолекулярные спирты , такие как метанол , этанол , и пропанолы также превосходные растворители .Они участвуют в кислотно-щелочного равновесия.
В случае метанола калия метоксид (метилат) формы:
КОН + СН 3 ОН СН 3 ОК + Н 2 О ↽ — ⇀ { Displaystyle { се {>}}}
Из — за своей высокой аффинностью к воде, КОН служит в качестве осушителя в лаборатории. Он часто используется , чтобы высушить основные растворители, особенно амины и пиридины .
В качестве нуклеофила в органической химии
КОН, как NaOH, служит в качестве источника ОН -, Высоко нуклеофильный анион , который атакует полярные связи в обеих неорганических и органических материалах. Водный раствор КОН saponifies сложные эфиры :
КОН + RCOOR»→ RCOOK + R'OH
Когда R является длинной цепью, продукт называется калиевым мылом . Эта реакция проявляется в «жирной» считают , что KOH дает при прикосновении — жиры на коже быстро превращаются в мыло и глицерин .
Расплавленный KOH используется для вытеснения галогенидов и других уходы щих групп . Реакция является особенно полезной для ароматических реагентов , с получением соответствующих фенолов .
Реакции с неорганическими соединениями
В дополнение к его реакционной способности по отношению к кислотам, КОН атакует оксиды . Таким образом, SiO 2 подвергается нападению KOH с получением растворимых силикатов калия. КОН реагирует с диоксидом углерода с получением бикарбоната :
КОН + СО 2 → КНСО 3
Производство
Исторически сложился так , КОН путем добавления карбоната калия к сильному раствору гидроксида кальция ( гашеная известь ) The соли реакция метатезиса приводит к осаждению твердого карбоната кальция , в результате чего гидроксида калия в растворе:
Са (ОН) 2 + К 2 СО 3 → СаСО 3 + 2 КОН
Отфильтровывания осажденного карбоната кальция и кипячения раствора дает гидроксид калия ( «прокаливают или едкого кали»). Этот способ получения гидроксида калия не оставался доминирующим до конца 19 века, когда он был в значительной степени заменен текущим методом электролиза хлорида калия растворов. Метод аналогичен производству гидроксида натрия (см процесса хлорщелочного ):
2 KCl + 2 Н 2 O → 2 KOH + Cl 2 + Н 2
Водород газ образует в качестве побочного продукта на катоде ; Одновременно, анодное окисление хлорида иона происходит, образуя хлор газ в качестве побочного продукта. Разделение анодных и катодных пространств в электролизер имеет важное значение для этого процесса.
Пользы
КОН и NaOH, могут быть использованы как взаимозаменяемые для ряда применений, хотя в промышленности, NaOH, является предпочтительным из-за его низкой стоимости.
Предшественник других соединений калия
Многие соли калия получают путем реакции нейтрализации с участием KOH. В калиевые соли карбоната , цианида , перманганата , фосфат , и различные силикаты получают путем обработки либо оксиды или кислот с КОН. Высокая растворимость фосфата калия желательно удобрений .
Производство мягких мыл
Омыления из жиров с KOH используется для получения соответствующих «калиевых мыл », которые являются более мягкими , чем гидроксид происхождения мыла чаще натрия. Из — за их мягкости и большей растворимости, калиевые мыла требуют меньше воды по сжижению, и может , таким образом , содержат больше , чем моющее средство сжиженных натриевых мыл.
В качестве электролита
карбонат калия, образованный из раствора гидроксида, вытекающего из щелочной батареи
Водный раствор гидроксида калия, используют в качестве электролита в щелочных батарей на основе никеля — кадмий , никель — водород и диоксид марганца — цинк . Гидроксид калия является предпочтительным по сравнению гидроксид натрия , поскольку ее решения являются более проводящими. В гидридных батарей никель-металл в Toyota Prius используют смесь гидроксида калия и гидроксида натрия. Никель-железные аккумуляторы также используют электролит гидроксида калия.
Пищевая промышленность
В пищевых продуктах, гидроксид калия действует в качестве пищевого загустителя, рН контролирующего агента и пищевого стабилизатора. FDA считает (как прямой человеческим пищевым ингредиент) , как правило , безопасна в сочетании с «хорошими» производственной практикой условиями использования. Известно , в числе Х систем как E525 .
Ниша приложения
Как гидроксид натрия, гидроксид калия привлекает множество специализированных приложений, практически все из которых опираются на его свойства в качестве сильного химического основания с последующим его способностью разрушать многие материалы.
Например, в процессе , как правило , называют «химическим сожжением» или « resomation », гидроксид калия ускоряет разложение мягких тканей, как животных и человека, чтобы оставить только кости и другие твердые ткани.
Энтомологи , желающие изучить тонкую структуру насекомых анатомии может использовать 10% -ный водный раствор КОН , чтобы применить этот процесс.
В химическом синтезе, выбор между использованием KOH и использования NaOH ориентируется на качество растворимости или сохранности полученного соли .
Коррозионные свойства гидроксида калия делает его полезным ингредиентом в агентов и препаратов, чистые и дезинфекции поверхностей и материалов , которые сами по себе могут противостоять коррозии с помощью KOH.
Источник: https://ru.qwe.wiki/wiki/Potassium_hydroxide





