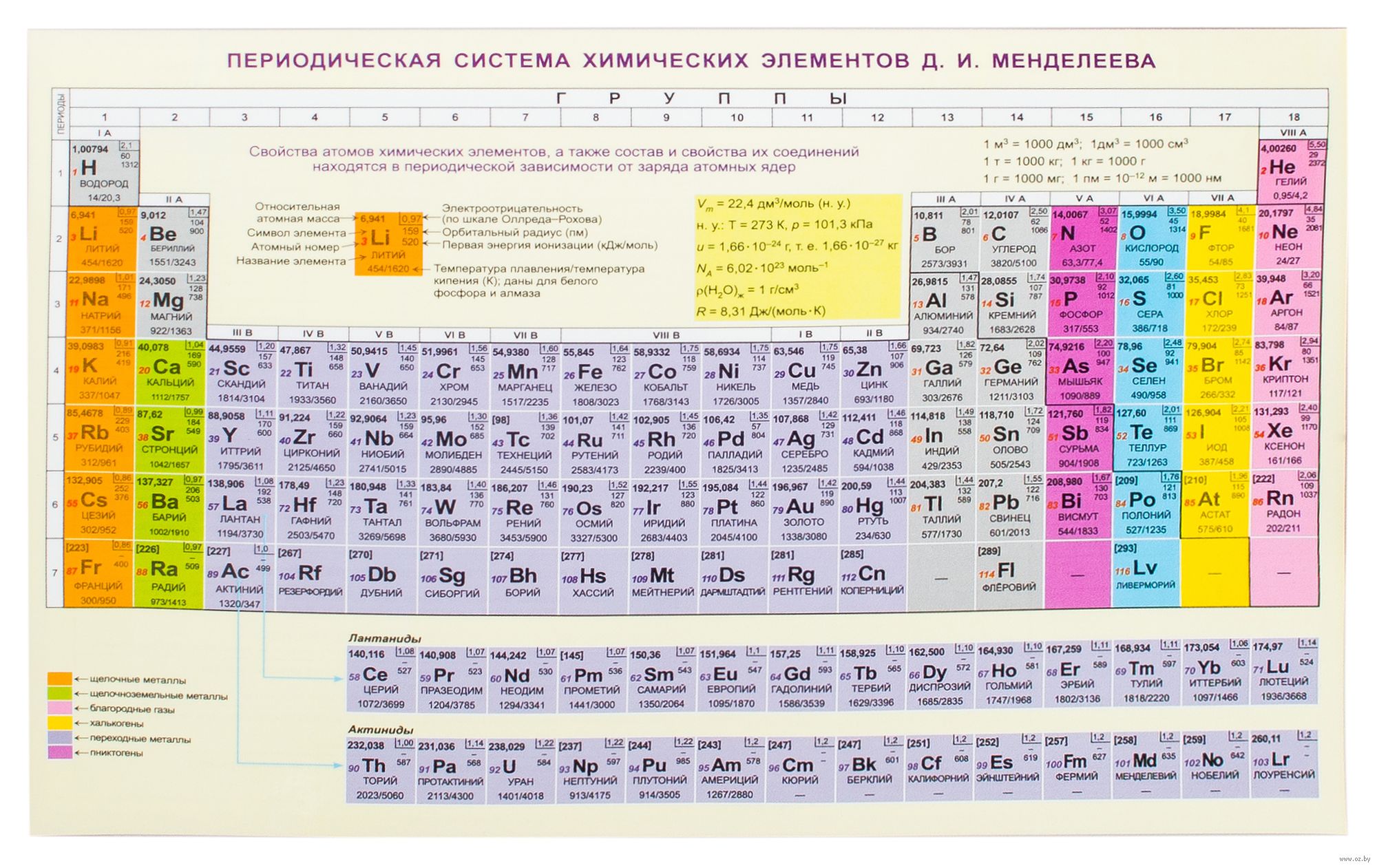
Элемент железо входит в побочную подгруппу VIII группы периодической системы и относится к d-элементам.

Железо известно очень давно. Это самый распространенный в земной коре металл (около 4 % по массе) и самый распространенный в природе переходный металл. В природе железо существует только в виде соединений. Чистое железо имеет преимущественно внеземное происхождение.
Железо используются в виде сплавов: чугуна, стали и ковкого железа.
Эти сплавы различаются различным содержанием углерода, в чугуне более 1,7 %, в стали – от 0,3 % до 1,7 %, а в ковком железе – менее 0,3 %.
В состав так называемых легированных сталей входят хром, вольфрам, молибден, никель, ванадий, титан, кобальт и другие металлы, что дает возможность получать стали с разными полезными свойствами.
Чистое железо – блестящий серебристо-белый металл. В ряду активности стоит до водорода и растворяется в соляной и разбавленной серной кислотах, выделяя водород. При действии концентрированной серной и азотной кислот железо пассивируется – покрывается тонкой защитной пленкой оксида, поэтому эти кислоты перевозят в железных цистернах.
В соединениях железо проявляет различные степени окисления, в основном +2 и +3, известны также высшие степени окисления железа +4, +5 и +6. Железо является металлом средней активности. При нагревании выше 200 °С в отсутствие паров воды железо покрывается плотной пленкой оксида. Этот процесс называется воронением.
- Железо взаимодействует с парами воды при нагревании:
- 3Fe + 4H2O = Fe3O4 + 4H2
- С галогенами железо образует соответствующие соли железа (II и III), а при избытке галогена образуется галогенид железа (III):
- 2Fe + 3Cl2 = 2FeCl3
- Железо растворяется в разбавленных соляной и серной кислотах с образованием солей железа (II):
- Fe + 2HCl = FeCl2 + H2
- Разбавленная азотная кислота растворяет железо с выделением оксидов азота и нитрата железа (III).
Во влажном воздухе и воде железо разрушается – коррозирует, образуя ржавчину. Коррозия – это окислительно-восстановительный процесс, при котором металл окисляется. Наиболее интенсивно он идет при одновременном присутствии воды и кислорода. В сухом воздухе или в воде, не содержащей кислорода, железо не ржавеет. Суммарное уравнение реакции ржавления железа можно записать так:
- 4Fe + 6H2O + 3O2 = 4Fe(OH)3
- В настоящее с коррозией борются нанесением защитных покрытий, легированием, применением ингибиторов.
- Получение:
- Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe2Fe32)O4+ CO2
(Fe2Fe32)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C); 
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева.
Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов.
При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Оксид железа(II) FеО. Основный оксид. Черный, имеет ионное строение Fе2+ O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой.
Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок.
Уравнения важнейших реакций:
- FеО + 2НС1 (разб.) = FеС12 + Н2O
- FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O
- FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
- FеО + С(кокс) = Fе + СО (выше 1000 °С)
- FеО + СО = Fе + СO2 (900°С)
- 4FеО + 2Н2O(влага) + O2 (воздух) →4FеО(ОН) (t)
- 6FеО + O2 = 2Fe3O4 (300—500°С)
- Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
- Fе(ОН)2 = FеО + Н2O (150-200 °С)
- FеСОз = FеО + СO2 (490-550 °С)
Оксид железа (III) – Fe3 O4 . Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна.
Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется.
Уравнения важнейших реакций:
- 2Fe3O4 = 6FеО + O2 (выше 1538 °С)
- Fe3O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O
- Fe3O4 +10НNO3 (конц.) =3Fе(NO3)3 + NO2↑+ 5Н2O
- Fe3O4 + O2 (воздух) = 6Fе2O3 (450-600°С)
- Fe3O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
- Fe3O4 + СО =ЗFеО + СO2 (500—800°C)
- Fe3O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
- Получение: 3Fe + 2O2 (воздух) = Fe3O4
- В природе – оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе.
Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом.
Сплавляется с оксидами других металлов и образует двойные оксиды – шпинели (технические продукты называются ферритами).
Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
- Уравнения важнейших реакций:
- 6Fе2O3 = Fe3O4 +O2 (1200—1300 °С)
- Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) (600°С,р)
Fе2O3 + 2NaОН (конц.) →Н2O+ 2NаFеO2 (красн.) диоксоферрат(III)
- Fе2О3 + МО= Fe3O4 (М=Сu, Мn, Fе, Ni, Zn)
- Fе2O3 + ЗН2 =ЗН2O+ 2Fе (особо чистое, 1050—1100 °С)
- Fе2O3 + Fе = ЗFеО (900 °С)
- 3Fе2O3 + СО = 2Fe3O4 + СO2 (400—600 °С)
- Получение в лаборатории – термическое разложение солей железа (III) на воздухе:
- Fе2(SO4)3 = Fе2O3 + 3SO3 (500-700 °С)
- 4{Fе(NO3)3 9 Н2O} = 2Fе2O3 + 12NO2+ 3O2 + 36Н2O (600-700 °С)
- В природе – оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O
Гидроксид железа (II) Fе(ОН)2. Основный гидроксид. Белый (иногда с зеленоватым оттенком), связи Fе – ОН преимущественно ковалентные. Термически неустойчив.
Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа.
Применяется в изготовлении активной массы железоникелевых аккумуляторов.
- Уравнения важнейших реакций:
- Fе(OН)2 = FеО + Н2O (150-200 °С, в атм.N2)
- Fе(ОН)2 + 2НС1 (разб.) =FеС12 + 2Н2O
- Fе(ОН)2 + 2NаОН (> 50%) = Nа2[Fе(ОН)4] ↓(сине-зеленый) (кипячение)
- 4Fе(ОН)2 (суспензия) + O2 (воздух) →4FеО(ОН)↓ + 2Н2O (t)
- 2Fе(ОН)2 (суспензия) +Н2O2 (разб.) = 2FеО(ОН)↓ + 2Н2O
- Fе(ОН)2 + КNO3 (конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
- Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
- Fе2+ + 2OH (разб.) = Fе(ОН)2↓
- Fе2+ + 2(NH3Н2O) = Fе(ОН)2↓+ 2NH4

Источник: http://www.yoursystemeducation.com/zhelezo/
Молярная масса железа и описание химического элемента :
Железо (Fe) имеет для человека большое значение. Этот элемент необходим как для питания растений и поддержания уровня кислорода в крови, так и промышленной сферы в качестве одного из основных материалов.
Оно представляет собой хрупкое, твердое вещество, классифицирующееся как металл в группе 8 периодической таблицы элементов. Это самый чистый из всех металлов, он сильно подвержен воздействию влажного воздуха и высоких температур.
Использование и значение
Железо является четвертым наиболее распространенным по массе элементом в земной коре, и считается, что большая часть ядра Земли состоит из него. Оно имеет решающее значение для выживания живых организмов. У растений необходим в производстве хлорофилла. У животных является компонентом гемоглобина — белка в крови, который переносит кислород из легких в ткани организма.
Твердое внутреннее и жидкое внешнее ядра Земли в основном состоят из железа (примерно 85 и 80 процентов от общей массы соответственно). Электрический ток, создаваемый жидкой его формой, формирует магнитное поле, защищающее Землю. Оно также находится в ядрах всех планет Солнечной системы.

Большая часть его используется для производства стали, сплава железа и углерода, которая, в свою очередь, используется в производстве и гражданском строительстве. Нержавеющая сталь, которая содержит не менее 10,5 % хрома, обладает высокой устойчивостью к коррозии.
Ее применяют в кухонных столовых приборах и посуде. Добавление других элементов может придать другие полезные качества.
Например, никель увеличивает долговечность и делает более устойчивым к теплу и кислотам; вольфрам помогает сохранять твердость при высоких температурах.
Характеристики
Основные свойства химического элемента железо:
- Атомный номер (количество протонов в ядре): 26.
- Атомный символ (в периодической таблице элементов): Fe.
- Атомный вес (средняя масса атома): 55,845.
- Плотность: 7,874 грамма на кубический сантиметр.
- Состояние при комнатной температуре: твердое.
- Температура плавления: 1538° C.
- Температура кипения: 2 861° C.
- Количество изотопов (атомов одного и того же элемента с различным числом нейтронов): 33, из них стабильных – 4.
- Наиболее распространенные изотопы: железо-56
История и свойства
Археологи подсчитали, что люди используют железо более 5 000 лет. На самом деле получается, что самые древние из известных человеку образцов буквально упали с неба. В изысканиях, опубликованных в 2013 году в «Журнале археологических наук», исследователи изучили древнеегипетские бусы, датируемые примерно 3 200 г. до н. э., и обнаружили, что они были сделаны из метеоритного железа.
Его в основном получают из минералов гематита и магнетита. В меньшей степени он также может быть получен из минералов таконита, лимонита и сидерита. У него есть четыре различные аллотропные формы, а это означает, что у него четыре различные структурные формы, в которых атомы связываются по-разному. Они называются ферритами, известными как альфа (магнитная), бета, гамма и омега.
Роль в жизни человека
Химический элемент железо является важным питательным веществом в нашем рационе. Его дефицит, один из наиболее распространенных недостатков питательных веществ, может вызвать анемию и усталость, которые влияют на способность выполнять физическую работу у взрослых. Это также может привести к ухудшению памяти и других психических функций у подростков.
Есть два типа пищевого железа: гемовое и негемовое.
Гемовое является наиболее легко усваиваемым типом, содержится в мясе, рыбе и птице, тогда как второй тип, который также усваивается, но в меньшей степени, содержится в растительных продуктах (таких как шпинат, капуста и брокколи) и мясе.
Люди потребляют до 30 процентов гемового железа по сравнению с 2-10 процентами негемового. При этом продукты, богатые витамином С, такие как помидоры или цитрусовые, могут помочь организму усваивать его.

Молярная масса железа
В химии формула веса представляет собой величину, вычисляемую путем умножения атомного веса каждого элемента в химической формуле на количество его атомов с последующим сложением всех этих результатов вместе. Эти параметры используются в разных целях. Например, для объемных стехиометрических расчетов обычно определяют молярную массу железа. Ее также называют стандартной или средней атомной.

Этот параметр имеет свое собственное обозначение. Поиск молярной массы железа начинается с единицы грамм на моль (г/моль). При расчете молекулярного веса химического соединения это указывает на то, сколько граммов содержится в одном моле этого вещества.
Фактически она отображает просто вес в атомных единицах всех атомов в данной формуле. Таким образом, она представляет собой среднюю атомную массу железа.
Расчет этой формулы особенно полезен при определении относительных весов реагентов и продуктов в химической реакции.
Для того чтобы найти необходимый параметр, достаточно взять Периодическую таблицу, найти в ней Fe. Над ним будет число 26, а внизу — 55,85, это и есть молярная масса железа.
Источник: https://www.syl.ru/article/468624/molyarnaya-massa-jeleza-i-opisanie-himicheskogo-elementa
Сульфат Железа
Железа(II) сульфат, сульфат железа (III).
Химические свойства
Двухвалентное сернокислое железо – неорганическое соединение, соль образованная серной кислотой и железом. Вещество не имеет запаха, не летуче. Безводная форма имеет вид бесцветных не прозрачных мелких гигрокопичных кристаллов.
Кристаллогидраты имеют характерный зеленовато-голубой окрас, тетрагидраты зеленого цвета. Химическая формула Сульфата Железа 2: FeSO4, рацемическая: O4SFe. На вкус соединение вяжущее, с привкусом металла. Средство хорошо растворяется в воде.
Молекулярная масса = 151,9 грамм на моль.
Вещество выделяется из железного купороса. Раствор сульфата Fe(2) под действием кислорода окисляется в переходит в Сульфат Железа 3. Разлагается при температуре выше 480 градусов Цельсия на оксиды.
Сульфат Железа 2 можно получить при воздействии разбавленной серной кислоты на обрезки железа; в виде побочного продукта реакции травления железных листов, при удалении окалины, при окислительном обжиге пирита.
Гидролиз Сульфата Железа 2 протекает по катиону в кислой среде. Первая ступень гидролиза: Fe2+ + SO42- + HOH ↔ FeOH+ + SO42- + H+; теоретически может протекать и вторая ступень гидролиза: FeOH+ + SO42- + HOH ↔ Fe(OH)2↓ + SO42- + H+.
Вещество применяют:
- для окраски изделий и шерстяной ткани в черный цвет, при производстве чернила, при консервировании древесины;
- в химической дозиметрии, для обработки садовых деревьев в сельском хозяйстве;
- в медицине при лечении железодефицитной анемии.
Сернокислое железо 3 или тетрасульфид 6 железа 3 – это светло-желтые парамагнитные мелкие кристаллы. Вещество хорошо растворяется в воде, медленно – в этиловом спирте. Химическая формула Сульфата Железа 3: Fe2(SО4)3, рацемическая: Fe2O12S3.
Вещество обладает способностью кристаллизоваться в форме кристаллогидратов Fe2(SO4)3•n H2O. Наибольшее значение имеет нонагидрат сульфата железа(III). Водные растворы приобретают красно-коричневую окраску из-за реакции гидролиза, протекающей по катиону.
Соединение разлагается под действие горячей воды и высоких температур.
При 98 градусах нонагидрат превращается в тетрагидрат, при температуре выше 125 градусов – в моногидрат и выше 175 – в безводный сульфат Fe, который при температуре более 600 градусов разлагается на оксиды серы и железа.
Вещество используют:
- при переработке медной руды, для очистки сточных вод, промышленных и коммунальных стоков;
- при окраске ткани и дублении в кожевельном производстве;
- в качестве флотационного регулятора, в виде катализатора некоторых реакций или окислителя;
- в медицине в качестве кровоостанавливающего средства.
Фармакологическое действие
Противоанемическое, устраняющее железодефицит. Кровоостанавливающее (Сульфат Железа 3).
Фармакодинамика и фармакокинетика
Железо является основным микроэлементом, входящим в состав гемоглобина, миоглобина и прочих компонентов крови.
Вещество принимает участие в окислительно-восстановительных реакциях, связывается и переносит молекулы кислорода по организму, стимулирует гемопоэз и эритропоэз. Сульфат Железа обеспечивает синтез всех железосодержащих метаболитов.
После поступления Fe с пищей, оно усваивается в двенадцатиперстной кишке и переносится в депо тканей с помощью ферментов трансферетинов.
После приема лекарства внутрь, его активные компоненты полностью усваиваются организмом. Максимальная концентрация в крови наблюдается через 2-4 часа.
Показания к применению
Средство используют:
- для лечения и профилактики железодефицитной анемии у детей и взрослых;
- при нарушении всасывания железа из пищеварительного тракта;
- у пациентов с повышенной потребностью в железе, при беременности, кормлении грудью, во время интенсивного роста, при несбалансированном питании;
- при хроническом гастрите, сопровождающимся секреторной недостаточностью;
- на некоторых стадиях лечения B12-дефицитной анемии;
- при обострении язвы желудка и 12-перстной кишки;
- во время реабилитации после резекции желудка;
- для лечения недоношенных детей;
- для стимуляции иммунитета во время инфекционных заболеваний и при опухолях;
- при лечении пациентов с ахлоргидрией, хронической диареей, болезнью Крона, синдромом мальабсорбции.
Противопоказания
Сульфат Железа 2 противопоказан к приему:
- при аллергии на средство;
- у пациентов с нарушениями обменных процессов в организме, при гемосидерозе, гемохроматозе;
- больным с дисфункцией ЖКТ, которая препятствует всасыванию железа;
- при апластической и гемолитической анемии;
- пациентам с талассемией.
Побочные действия
Побочные реакции во время лечения Сульфатом Железа возникают не часто.
Могут проявиться:
- головокружение, головная боль, общая слабость и раздражительность, эпилептический синдром и энцефалопатия;
- чувство давления в груди, понос или запор, тошнота;
- зубная боль, боль в эпигастральной области;
- высыпания на коже, зуд, боль в горле;
- очень редко – анафилактические реакции.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь. Минимальная эффективная дозировка в пересчете на элементарное железо составляет 100 мг. Максимальное количество лекарства, которое можно принять – до 400 мг.
В профилактических целях назначают от 30 до 60 мг элементарного железа в сутки.
Передозировка
При передозировке усиливаются побочные реакции от приема лекарства. Возникают: диарея, тошнота, болезненные ощущения в животе, рвота, аритмия и рост ЧСС, повышается проницаемость капилляров, возможен сердечно-сосудистый коллапс. В качестве терапии промывают желудок, вводят дефероксамин для связывания ионов железа.
Взаимодействие
- При сочетании с аскорбиновой кислотой улучшается всасывание препаратов железа.
- Сочетанный прием сульфата и антацидных средств с магнием, алюминием, кальцием, пеницилламином и колестирамином замедляет всасывание железа.
- Не рекомендуется сочетать лекарство с тетрациклиновыми антибиотиками, так как происходит взаимное снижение системной абсорбции обоих препаратов.
- При сочетании лекарства с ГКС взаимно усиливается эритропоэз.
Условия хранения
Препараты хранят в сухом, темном, прохладном месте в оригинальной упаковке. Нельзя использовать лекарство после истечения срока годности.
Особые указания
- Во время лечения Сульфатом Железа ii может наблюдаться окрашивание кала в черный цвет и потемнение эмали зубов.
- При заболеваниях почек и печени железо может накапливаться в организме.
- Особую осторожность соблюдают при лечении пациентов с язвенной болезнью желудка и 12-персной кишки, при язвенном колите и энтерите.
Вещество рекомендуется комбинировать с Фолиевой кислотой при железодефицитной анемии с дефицитом фол. к-ты.
При курсовом приеме лекарства рекомендуют периодически проводить контроль гемоглобина и уровня сывороточного железа.
При беременности и лактации
Лекарство можно использовать во время кормления грудью и при беременности по показаниям.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня: Гино-Тардиферон
Гино-Тардиферон Ферретаб
Ферретаб Мальтофер Фол
Мальтофер Фол
Железа закисного сульфат является активным компонентом следующих препаратов: Ферроградумет, Ферроплекс, Тардиферон, Гемофер пролонгатум, Сорбифер Дурулес, Актиферрин, Витатресс, Гематоген С, Олиговит и так далее.
Отзывы
Некоторые отзывы о применении препаратов Сульфата Железа:
- “… Лекарство назначила врач на 7 месяце беременности, так как сильно упал гемоглобин. Сказала, что питанием его уже в норму не привести и сказала пить это лекарство. Побочных действий у меня от таблеток не было, только кал окрашивался в черный цвет, но это меня не беспокоило”;
- “… От приема этого лекарства у меня был сильный запор, иногда тошнило после приема таблетки, но я терпела. В целом, мне препарат очень помог, гемоглобин через месяц нормализовался”;
- “… Три месяца с помощью этого препарата лечила железодефицитную анемию. Анализы были в норме уже после первых 4 недель применения. Хорошее лекарство”.
Цена Сульфата Железа, где купить
Цена на лекарство варьирует в зависимости от производителя и лек. формы. Купить Сульфат Железа можно в любой аптеке. Например, стоимость таблеток пролонгированного действия Тардиферон составляет порядка 200 рублей за 30 штук.
Источник: https://medside.ru/sulfat-zheleza
Занимательная химия: Хром
| Fe 26 Железо 55.847(3) 3s23p33s64s2 |
История открытия и применения железа
Железо — Элемент XVIII группы четвертого периода периодической системы Менделеева, металл Степень окисления +2,+3, иногда +6.
Один из наиболее распростаненных элементов в природе. Особено важен для живых организмов: является основным катализатором дыхательных процессов. Железо входит в состав гемоглобина крови (477 мг/л), учавствует в процессе переноса кислорода от легких к тканям.
Железо встречается в природе в основном в виде руд. Основные руды железа:
— магнетит (магнитный железняк) FезО4 (содержит до 72% железа), основные месторождения находятся на Урале.
— гематит (красный железняк) Fe2О3 (содержит до 65% железа), основное месторождение — Криворожское. — лимонит (бурый железняк) Fe2О3 • nH2O (содержит до 60% Ре), крупные месторождения в Крыму и на Урале. — пирит (железный колчедан) FeS2 (содержит около 46% железа), — сидерит (шпатовый железняк) FeСО3 (содержит до 35% Железа).
Получение:
1. Чистое железо можно получить электролитическим восстановлением солей железа.
FeCl2 = Fe2+ + 2Cl-
2. Восстановление оксидов железа Fe2O3 и Fe3O4 при алюминотермии: 8Al + 3Fe3O4 = 9Fe + 4Al2O3 3. Основная масса железа используется не в чистом виде, а виде сплавов с углеродом (чугуна и стали) и другими элементами. Основная масса железа вырабатывается в доменных печах. Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании:
3Fe2O3 + CO = 2Fe3O4 + CO2
Fe3O4 + CO = 3FeO + CO2 FeO + CO = Fe + CO2 FeO + C = Fe + CO
Физические свойства:
Чистое железо — серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей кислород. Железо пластично, легко подвергается ковке и прокатке, температура плавления 1539°С. Обладает сильными магнитными свойствами (ферромагнетик), хорошей тепло- и электропроводностью.
Химические свойства:
Железо — активный металл.
1. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III). 4Fe + 3О2 + 6Н2О = 4Fe(ОН)3 3. Взаимодействует с хлором, углеродом и другими неметаллами при нагревании: 2Fe + 3Cl2 = 2FeCl3 4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа:
- Fe + CuSO4 = FeSO4 + Cu
- Fe + 2Cl = FeCl2 + H2
5. Растворяется в разбавленных серной и соляной кислотах c выделением водорода:
Источник: https://AllMetalls.ru/fe.html




