С точки зрения
теории электролитической диссоциации, основания – это
электролиты, при диссоциации которых в качестве анионов образуются только
гидроксид-ионы.
Но органические
соединения также проявляют основные свойства, но не содержат гидроксид-ионов.
Их основные свойства основаны на том, что они реагируют с кислотами с
образованием солей.
Поэтому для более
полного определения оснований используют протолитическую теорию, которую
предложили в 1923 году Брэнстэд и Лоури.

Й. Н. Бренстед
(1879–1947)
Согласно этой
теории, кислоты и основания – это противоположная группа веществ,
характер которой проявляется при их взаимодействии между собой.
При этом кислоты
– это вещества, характер которых проявляется в том, что они являются донорами
катионов водорода, а основания – это вещества, которые при
взаимодействии с кислотами будут принимать катионы водорода, то есть они
являются акцэпторами катионов водорода.
- Таким образом, согласно
протолитической теории, кислоты – это вещества, группы
атомов или ионы, которые являются в данной реакции донорами катионов, то есть
отдают катионы водорода. - Основания – это вещества,
группы атомов или ионы, которые являются акцэпторами катионов, то есть принимают
протоны водорода. - Разберём эту
теорию на примере взаимодействия сильного основания и сильной кислоты.

Например, при
взаимодействии гидроксида натрия с серной кислотой образуется соль и вода.
Сущность данной реакции связано с соединением ионов водорода и гидроксид-ионов
с образованием воды.

Поэтому, согласно
протолитической теории, кислотой является серная кислота, так как она
является донором катионов водорода, а основанием является гидроксид натрия, так
как присоединяет катионы водорода с образованием воды.
Применим
протолитическую теорию к реакции взаимодействия метиламина с хлороводородом.

В этой реакции нет
основания, так как метиламин – газ и не имеет гидроксид-ионов, и нет
кислоты, потому что хлороводород тоже газ. Почему эту реакцию протолитическая
теория рассматривает как взаимодействие основания и кислоты?
В молекуле амина азот
имеет свободную пару электронов, он присоединяет катионы водорода
по донорно-акцэпторному механизму, являясь при этом акцэптором катионов
водорода, поэтому метиламин – основание. Хлороводород отдаёт катионы водорода и
является кислотой.

В реакции аммиака
с хлороводородом образуется соль – хлорид аммония. Аммиак выступает в роли
основания, так как присоединяет катион водорода, а хлороводород выступает в
роли кислоты, так как отдаёт катион водорода.
Таким образом,
протолитическая теория позволяет объяснить сходство в свойствах органических и
неорганических оснований, при всём различии их строения. То есть в определённых
реакциях эти вещества будут проявлять себя, как акцэпторы катионов водорода.
Поэтому
классификацию оснований можно дополнить. Различают основания кислородсодержащие
(как гидроксид калия, гидроксид меди два), бескислородные (как аммиак, этиламин).
Основания можно
классифицировать по числу катионов водорода, которые может присоединить
основание. Это однокислотные основания (как гидроксид натрия, аммиак, этиламин);
двухкислотные (как гидроксид кальция, этилен-ди-амин).
По растворимости в
воде различают растворимые в воде основания (как гидроксид натрия, гидроксид
бария, этиламин) и нерастворимые в воде (как гидроксид меди два, гидроксид
железа два, анилин).
По степени
диссоциации различают
сильные снования, которые почти полностью диссоциируют. К ним
относятся щёлочи. Слабые электролиты частично диссоциируют на
ионы (к ним относятся нерастворимые основания, гидрат аммиака, гидрат
метиламина).
По стабильности различают основания
стабильные (как гидроксид натрия, гидроксид бария и другие) и нестабильные
(как гидрат аммиака).
По летучести
различают нелетучие основания – щёлочи и нерастворимые
в воде основания, к летучим относятся аммиак, амины.
Гидроксиды
металлов имеют ионную связь, а значит, и ионную кристаллическую решётку, поэтому
это – твёрдые вещества. Бескислородные вещества имеют ковалентную связь
и молекулярную кристаллическую решётку, поэтому это газы, летучие жидкости,
легкоплавкие твёрдые вещества.
Химические
свойства щелочей заключаются в их способности диссоциировать с образованием
гидроксид-ионов,
поэтому они изменяют окраску индикаторов: фенолфталеин в растворах щелочей
имеет малиновую окраску, лакмус – синюю, а метилоранж – жёлтую.

При диссоциации
гидроксида натрия образуются ионы натрия и гидроксид-ионы, при диссоциации гидроксида
кальция образуются ионы кальция и гидроксид-ионы.
Щёлочи реагируют с
кислотами с образованием соли и воды.

Данные реакции
обмена являются реакциями нейтрализации.
Например, в
реакции гидроксида кальция с соляной кислотой образуется соль – хлорид кальция
и вода. В реакции многокислотных оснований может образоваться и основная соль, например
гидроксохлорид кальция.

Щёлочи реагируют с
кислотными оксидами с образованием солей и воды. Эти реакции являются реакциями
обмена. Так, в реакции гидроксида кальция с оксидом углерода четыре образуется
соль – карбонат кальция.

Щёлочи реагируют с
амфотэрными соединениями. При сплавлении гидроксида натрия с оксидом цинка
образуется соль – цинкат натрия, при сплавлении гидроксида натрия с гидроксидом
цинка образуется соль – цинкат натрия и вода.

- В водном растворе
в реакции гидроксида натрия с оксидом цинка образуется комплексная соль – тэтра-гидроксо-цинкат
натрия, в реакции гидроксида натрия с гидроксидом цинка в водном растворе также
образуется комплексная соль.
Щёлочи вступают в
реакции обмена с солями. В реакции гидроксида натрия с сульфатом меди два
образуется соль – сульфат натрия, гидроксид меди два; в реакции гидроксида
натрия с сульфатом аммиака образуется соль – сульфат натрия, аммиак и вода.
В данной реакции
выделяется аммиак, который окрашивает лакмусовую бумажку в синий цвет.
Таким образом,
свойства растворов щелочей обусловлены наличием гидроксид-ионов.
Рассмотренные реакции идут до конца, так как в результате взаимодействия
веществ образуется вода – слабый электролит, осадок или газ.
Нерастворимые
основания имеют схожие химические свойства со щелочами. Они также реагируют с
кислотами с образованием солей и воды.
Например, в
реакции гидроксида железа два с соляной кислотой образуется соль – хлорид
железа два и вода.
Нерастворимые
основания при нагревании разлагаются с образованием оксида и воды. Так, в
реакции разложения гидроксида меди два образуется оксид меди два (чёрного
цвета) и вода.
Сила основания
основана на их способности диссоциировать с образованием гидроксид-ионов. При
этом разрываются связи между катионами металла и гидроксогруппой.
- Так, в ряду от натрия
к цэзию увеличивается радиус катиона металла, и щёлочи, образованные
катионами металла лучше диссоциируют, силы притяжения с гидроксид-ионами
ослабевает. - Поэтому в ряду от гидроксида
натрия к гидроксиду цэзия сила оснований будет увеличиваться. - Если же металлы
располагаются в одном периоде, то у них будет различаться число электронов
на внешнем уровне, а также радиус катиона.
Если сравнить
калий и кальций, то у кальция будет больше число электронов на внешнем уровне,
но радиус атома меньше. В ряду от гидроксида натрия до гидроксида алюминия
увеличивается заряд катиона металла, увеличивается сила притяжения катиона
металла и гидроксогруппы, и диссоциация оснований ослабевает, значит,
и сила оснований уменьшается.
- Рассмотрим
свойства бескислородных оснований. - Их основные
свойства проявляются в том, что они являются акцэпторами катионов водорода, то
есть они присоединяют катионы водорода при реакции с кислотами. - Следовательно,
аммиак и амины могут реагировать с кислотами и водой, которые являются донорами
катионов водорода. - Так, в реакции
аммиака с соляной кислотой, аммиак присоединяет катионы водорода с образованием
соли – хлорида аммония. - В реакции
метиламина с соляной кислотой, метиламин присоединяет катионы водорода и
образуется соль – хлорид-метил-аммония. - В реакции аммиака
с водой образуется гидрат аммония, который является непрочным и диссоциирует с
образованием катионов аммония и гидроксид-ионов. - Метиламин также
реагирует с водой, сначала образуется непрочное соединение гидрат метиламмония,
который распадается до ионов метиламмония и гидроксид-ионов.
Но анилин не даёт
реакцию с водой. Почему?
Сравним по силе
бескислородные основания. Сила этих оснований зависит от способности
присоединять катион водорода.
Эта способность
основана на величине частичного отрицательного заряда на атоме азота. В
молекуле аммиака есть частичный отрицательный заряд. В метиламине
частичный отрицательный заряд у азота больше, чем в аммиаке, так как он
создаётся не только атомами водорода, но и метильной группой.
В этиламине частичный
отрицательный заряд у азота ещё больше, чем в метиламине, потому что этильный
радикал увеличивает отрицательный заряд на томе азота.
В анилине
ароматическое кольцо оттягивает электронную пару от азота и уменьшает величину
отрицательного заряда, поэтому в ряду от анилина до этиламина будет идти усиление
основных свойств.
Рассмотрим
получение щелочей – растворимых в воде оснований.
Их можно получить
в реакции активных металлов с водой, основных оксидов с водой. Так, в реакции
натрия с водой образуется щёлочь – гидроксид натрия и водород. В реакции оксида
натрия с водой образуется также гидроксид натрия.
- Нерастворимые
основания получают в реакции щелочей с солями. - Например, в
реакции сульфата железа два с гидроксидом натрия образуется соль – сульфат
натрия и нерастворимое основание – гидроксид железа два.
Амины получают восстановлением
нитросоединений. При восстановлении нитрометана образуется метиламин.
Таким образом,
свойства кислородсодержащих оснований основано на наличии гидроксид-ионов,
свойства же бескислородных оснований заключаются в способности присоединять
катионы водорода. К неорганическим основаниям относятся щёлочи и нерастворимые
в воде основания, а к органическим – амины.
Источник: https://videouroki.net/video/43-organicheskie-i-neorganicheskie-osnovaniya.html
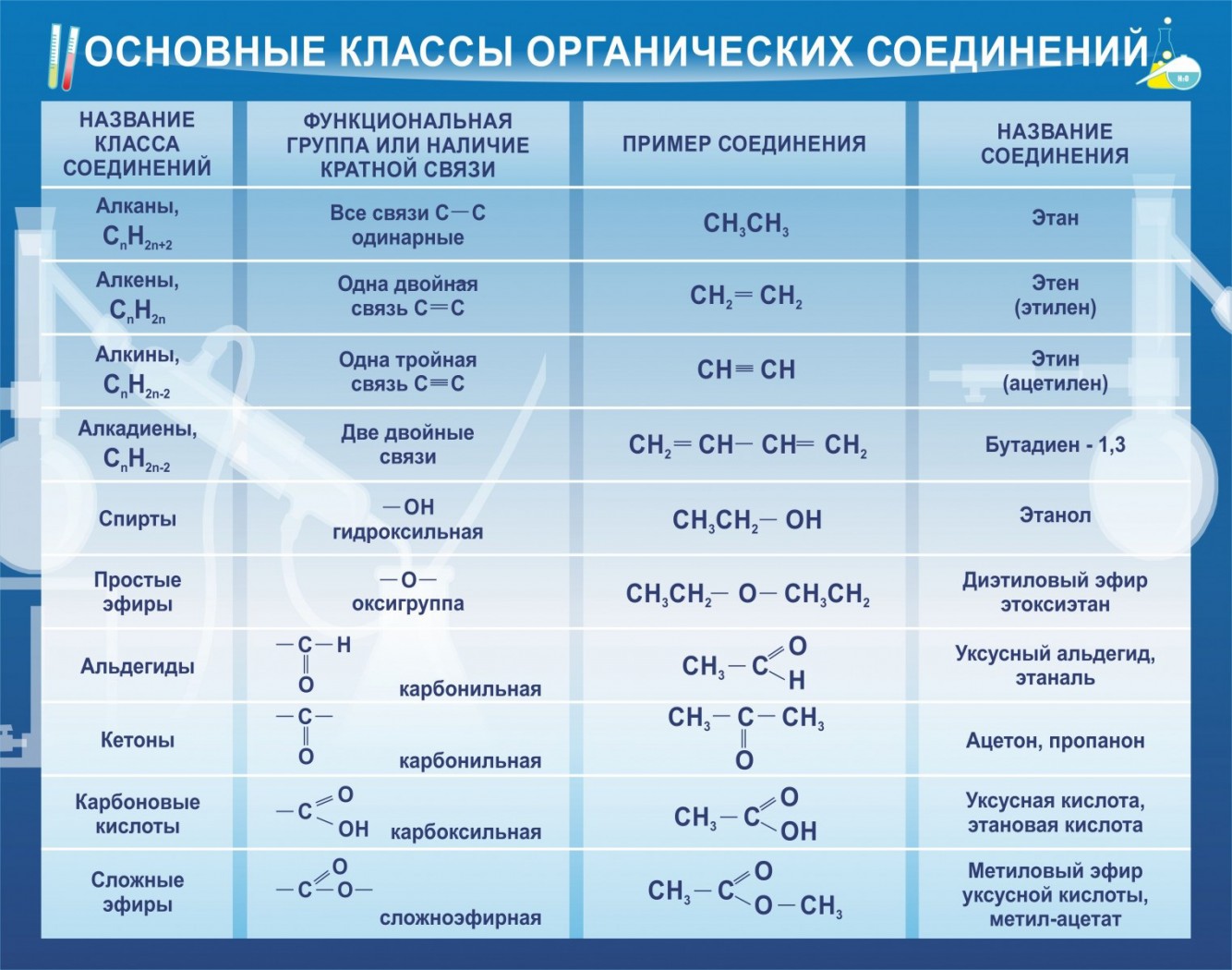
Что такое основание в химии органической и неорганической?
Термин «основание» встречается очень часто в процессе изучения химии, притом как органической, так и неорганической. Ученые впервые задались вопросом: «Что такое «основание» в химии?» еще в XVII веке.
Результатом стало возникновение нескольких теорий кислот и оснований, носящих имена их основателей.
Определение, что такое «основание в» химии, можно дать, обратившись к той, которая предлагает наилучшее обоснование для данного случая.
Теории кислот и оснований
В рамках данной статьи будут рассмотрены лишь части их, отвечающие на вопрос: «Что такое «основание» в химии?»
Наиболее известных теорий в настоящий момент четыре.
1. Теория электролитической диссоциации Аррениуса-Оствальда.
Основана на представлениях о распаде веществ на ионы в водной среде. Согласно этой теории, основаниями являются вещества, при диссоциации образующие гидроксид-анион.
Преимуществом ее является возможность классификации кислот и оснований по силе. Недостаток же заключается в применимости только для водных растворов и невозможности объяснения основных свойств веществ, не содержащих гидроксильных групп.
2. Протолитическая теория Бренстеда-Лоури.
В данном случае основанием считается вещество, способное присоединять протон (катион водорода). При этом появляется понятие амфотерности – возможности наличия у соединений либо кислотных, либо основных свойств в зависимости от условий.
В ней отдельно не рассматриваются основные и кислотные свойства. Основное положение теории – вещество становится тем или другим в присутствии другого соединения в зависимости от их природы.
Утверждается, что кислоты и основания обязательно существуют в виде пар соединений.
Эта теория является более общей, объясняет основные свойства соединений, не имеющих в молекуле гидроксильных групп, а также позволяет понять, что такое «основание» в органической химии. Именно с помощью теории Бренстеда-Лоури удалось объяснить механизм действия кислотно-основных индикаторов.

3. Электронная теория Льюиса.
Является еще более расширенной. Она объясняет механизм миграции протона, описанный в предыдущей теории. Льюис утверждал, что основание – это такое соединение, которое может выступать донором свободной электронной пары. Примером оснований Льюиса в химии является вода, аммиак. Основность органических соединений также по большей части объясняется данной теорией.
4. Обобщенная теория Усановича.
В ней принято оперировать зарядами частиц. Так, согласно Усановичу, основание – это частица, которая может присоединять протон или другие катионы, либо отдавать электрон и другие анионы. К сожалению, она не описывает неионогенные процессы.
Теория Усановича не была доработана. По сей день учеными предпринимаются попытки довести ее до логического завершения.
Ожидается, что в этом случае именно теория Усановича станет наиболее точно и правильно описывающей природу кислотно-основных свойств соединений.
В настоящее время используются все четыре теории в зависимости от рассматриваемых систем.
Что такое «основание» в неорганической химии?

На этот вопрос проще всего ответить при помощи электронной теории или теории Аррениуса-Оствальда, так как большинство реакций проходят в водных растворах.
Что такое «основание»? Примеры в неорганической химии: гидроксиды металлов, аммиак.
В первом случае в водных растворах молекулы диссоциируют с отщеплением гидроксид-аниона. Это яркий пример того, что такое «основание» с точки зрения теории Аррениуса.
Основные свойства аммиака же лучше объясняются наличием неподеленной электронной пары на атоме азота, что соответствует теории Льюиса.

В органической химии
Что такое основания в химии? Примеры органических оснований – представители класса аминов. Основность органических соединений принято объяснять с точки зрения теории Льюиса. Подобно аммиаку, основные свойства аминов обусловлены неподеленной электронной парой, находящейся на атоме азота.
Еще один пример основания в органической химии – анионы карбоновых кислот и алкоксильные (получаются при отщеплении атома водорода от спиртовой группы). Эти свойства можно объяснить при помощи теории Усановича или Бренстеда-Лоури.
Заключение
Итак, что же такое «основание» в химии? Это вещество, способное присоединять к себе катионы водорода или других элементов. То есть, теоретически, это может быть любой анион или молекула, имеющая на валентных орбиталях по меньшей мере одного из атомов неподеленную электронную пару.
Основания принято классифицировать по природе (органические и неорганические), силе, кислотности (количеству катионов водорода, которые могут быть присоединены к одной молекуле основания). Они имеют огромное значение в жизни человека. А потому попытки понять природу их свойств еще более глубоко и полно, вероятно, будут предприниматься еще в течение долгого времени.
Источник: https://News4Auto.ru/chto-takoe-osnovanie-v-himii-organicheskoi-i-neorganicheskoi/
Презентация на тему: Неорганические и органические основания
 Описание слайда:
Описание слайда:
Неорганические и органические основания. МБОУ «СОШ с.Озерки»учитель химии Добренькая Т.М.
Описание слайда:
Цель урока: обобщение, систематизация и углубление знаний о составе, классификации и свойствах оснований.
Описание слайда:
Основания — это… Основания —это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидроксогруппами (в зависимости от степени окисления металла) Основания –это электролиты, которые образуют в качестве отрицательных ионов только гидроксид –анионы
Описание слайда:
Согласно протолитической теории Брёнстеда-Лоури основания-это молекулы или ионы, которые являются акцепторами катионов водорода.
Описание слайда:
Классификация оснований 1. Растворимые в воде основания (щёлочи) 2. Малорастворимые в воде гидроксиды 3. Нерастворимые в воде основания Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды типичных и не типичных металлов.
Описание слайда:
Выполните задание.
Выберите среди предложенных веществ основания: C2 H5 OH , NH3, Al(OH)2Cl, NaOH, Ca(OH)2 , Cu(OH)2 , Cu(OH)2 CO3 , CH3 –NH2 Выберите бескислородные основания: NH3 , NaOH, Ca(OH)2 , Cu(OH)2 CH3 –NH2 Выберите нерастворимые и малорастворимые основания: NH3 , NaOH, Ca(OH)2 , Cu(OH)2 , CH3 –NH2 Выберите двухкислотные основания :NH3 , NaOH, Ca(OH)2 , Cu(OH)2 , CH3 –NH2 Выберите однокислотные основания : NH3 , NaOH, Ca(OH)2 , Cu(OH)2 , CH3 –NH2 Запишите ответы в тетради. 1) NH3, NaOH, Ca(OH)2 , Cu(OH)2 , CH3 –NH2 2) NH3 , CH3 –NH2 3) Ca(OH)2 , Cu(OH)2 4) Ca(OH)2 , Cu(OH)2 5) NH3, NaOH, CH3 –NH2 Оцените свой результат после проверки!
Описание слайда:
Свойства растворимых оснований 1) Изменяют окраску индикаторов 2) Взаимодействие с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O 3)Взаимодействие с кислотами Щёлочь + Кислота = Соль + Вода -реакция обмена (нейтрализация) Са(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O 4) С растворами солей, если в результате образуется осадок или газ Соль (раствор) + Щёлочь = Нерастворимое основание↓ + Новая соль FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl 2NH4 Cl+Ca(OH)2 =CaCl2 +2NH3↑ +2H2 O 5)С амфотерными оксидами и гидроксидами 2NaOH+Al2 O3 =2NaAlO2 +H2O 2КOH+Zn(OH)2=K2 ZnO2+2H2O
Описание слайда:
химические свойства аминов Основные свойства: а)СН3 NH2 + H2O = СН3 NH3OH Этиламин гидроксид метиламмония б)(С 2Н5)2 NH + HСl = (С 2Н5)2 NH2Cl Диэтиламин хлориддиэтил аммония
Описание слайда:
Проверьте ваши знания Ответы: I. Вариант II. Вариант 1.-2 1.-1 2.-3 2.-2 3.-4 3.-3 4.-1 4.-4 5.-2 5.-2 6.-3 6.-3
Описание слайда:
Практическое значение оснований
Описание слайда:
Домашнее задание Для учащихся, сдающих ЕГЭ по химии . § 21 № 2,5, 7, по учебнику «Химия 11класс» Профильный уровень . О.С.Габриелян, Г.Г.Лысова Для учащихся, не сдающих ЕГЭ по химии. § 23 №4, 5а,7 по учебнику «Химия 11класс» Базовый уровень . О.С.Габриелян,
Источник: https://ppt4web.ru/khimija/neorganicheskie-i-organicheskie-osnovanija.html
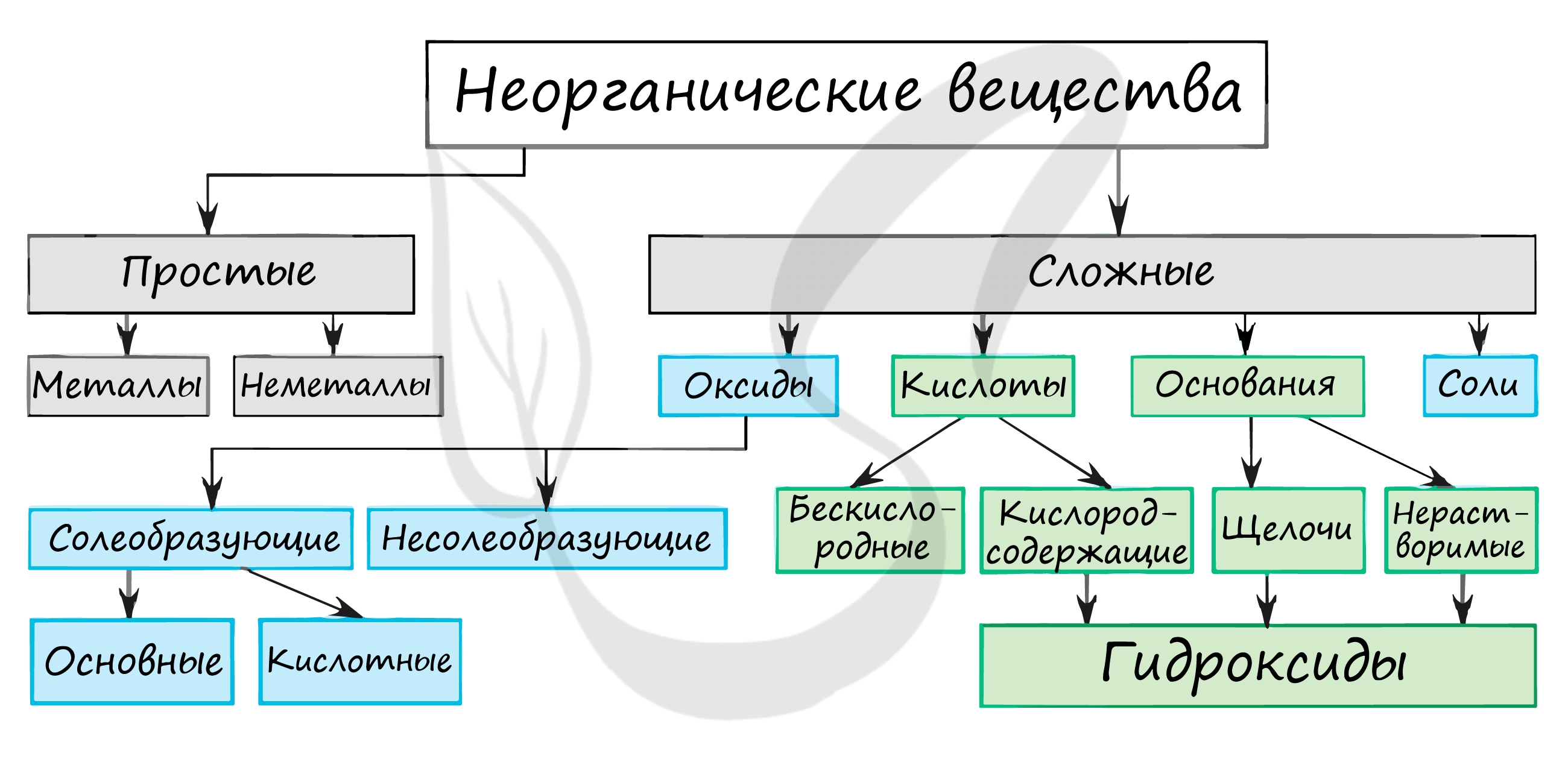
Неорганическая химия

Неорганическая химия— раздел химии, который связан с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Эта область химии охватывает все соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим). Различия между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических). Число известных сегодня неорганических веществ приближается к 500 тысячам.
Теоретическим основанием неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Главной задачей неорганической химии является разработка и научное обоснование способов создания новых материалов с нужными для современной техники свойствами.
Классификация химических элементов
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, которая устанавливает зависимость различных свойств химических элементов от заряда атомного ядра.
Система — это графическое выражение периодического закона, который был составлен русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И.
Менделеевым в 1869—1871 годах и назывался «Естественная система элементов», который устанавливал зависимость свойств химических элементов от их атомной массы.
Всего предложено несколько сотен вариантов изображения периодической системы, но в современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в некоторой степени подобные друг другу.
Простые вещества
Они состоят из атомов одного химического элемента (являются формой его существования в свободном состоянии). В зависимости от того, какова химическая связь между атомами, все простые вещества в неорганической химии разделяются на две основные группы: металлы и неметаллы. Для первых характерна металлическая связь, для вторых — ковалентная.
Также выделяются две примыкающие к ним группы — металлоподобных и неметаллоподобных веществ. Существует такое явление как аллотропия, которое состоит в возможности образования нескольких типов простых веществ из атомов одного и того же элемента, но с разным строением кристаллической решетки; каждый из таких типов называется аллотропной модификацией.
Металлы
Металлы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118 химических элементов, открытых на данный момент, к металлам относят:
Таким образом, к металлам относится 96 элементов из всех открытых.
Неметаллы
Неметаллы — химические элементы с типично неметаллическими свойствами, занимающие правый верхний угол Периодической системы элементов. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера.
Чаще неметаллы находятся в соединениях: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По содержанию в земной коре неметаллы существенно различаются.
Самыми распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, йод. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов.
Это определяет их бо́льшую способность для присоединения дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Сложные вещества
- Большую часть сложных неорганических веществ (то есть состоящих из двух и более химических элементов) можно разделить на следующие группы:
- Оксиды
- Гидроксиды (основания)
- Кислоты
- Соли
Источник: https://al-himik.ru/neorganicheskaja-himija/
Неорганические вещества

К группе неорганических веществ относятся все вещества, противоположные по своей сути органическим. То есть, этот означает, что в составе неорганических веществ отсутствует углерод. Исключение составляют карбиды, цианиды, карбонаты и оксид углерода.
Все неорганические вещества подразделяются на две большие группы:
• простые вещества
• сложные вещества.
Простые вещества
- – это вещества, состоящие из атомов одного элемента.
- Подразделяются на две большие группы:
- • металлы,
- • неметаллы.
Металлы
Металлы — называется группа простых тел, обладающих известными характерными свойствами, которые в типических представителях резко отличают металлы от других химических элементов.
В физическом отношении это по большей части тела твердые при обыкновенной температуре, непрозрачные (в толстом слое), обладающие известным блеском, ковкие, тягучие, хорошие проводники тепла и электричества и прочее. В химическом отношении для них является характерной способность образовать с кислородом основные окислы, которые, соединяясь с кислотами, дают соли.
К металлам относятся: железо, медь, цинк, кальций, калий, алюминий, золото, серебро, натрий, олово, бериллий и т.д.
Неметаллы
Неметаллами называется группа простых тел, обладающих известными характерными свойствами, которые резко отличают неметаллы от других химических элементов.
В физическом отношении это различные тела твердые: твердые, жидкие и газообразные.
К неметаллам относятся: водород, кислород, азот, фосфор, сера, углерод, аргон, неон и т.д.
Сложные вещества
- — это вещества, состоящие из атомов двух и более элементов. Подразделяются на четыре большие группы:
- • оксиды
- • основания
- • кислоты
- • соли
Оксиды
- Оксиды — это соединения различных химических элементов с кислородом.
- В зависимости от химических свойств различают:
- • солеобразующие оксиды,
- • несолеобразующие оксиды.
- Солеобразующие оксиды – это оксиды, дающие при взаимодействии с другими элементами соли. Они подразделяются на 3 группы:
- • основные оксиды (оксид натрия Na2O, оксид меди (II) CuO),
- • кислотные оксиды (оксид серы SO3, оксид азота NO2),
- • амфотерные оксиды (оксид цинка ZnO, оксид алюминия Аl2О3)
Несолеобразующие оксиды — это оксиды, не дающие при взаимодействии с другими элементами соли.
Обычно они распадаются до газа и воды.
Пример: оксид углерода СО, оксид азота NO.
Основания
— это вещества, молекулы которых состоят из молекул металла и гидрокс-группы — ОН. Основания образуются при взаимодействии ряда металлов (натрий, калий) или некоторых оксидов (оксид кальция CaO) с водой.
Пример: NaOH, Ca(OH)2, Al(OH)3, Fe(OH)3.
Кислоты
— называется группа соединений с известной, довольно определенной химической функцией. Эта функция выражена в таких типичных представителях этой группы, как серная кислота H2SO4, азотная кислота HNO3, соляная кислота НСl и прочие.
- Существует большое количество классификаций кислот, среди которых особый интерес представляют две – по содержанию кислорода и по принадлежности к классу химических соединений.
- Классификация кислот по содержанию кислорода:
- • безкислородные (HCl, H2S, HBr)
- • кислородсодержащие (HNO3, H2SO4, H3PO4).
- Классификация кислот по принадлежности к классу химических соединений:
- • неорганические (HBr,HCl, H2S, HNO3, H2SO4),
- • органические (HCOOH, CH3COOH).
Соли
- — это химическое соединение, образовавшееся в результате взаимодействия кислоты и основания.
- Пример: NaCl, KNO3, CuSO4, Ca3(PO4)2.
- Поделиться ссылкой
Источник: https://SiteKid.ru/himiya/neorganicheskie_veshchestva.html
Неорганическая химия — это… Что такое Неорганическая химия?
Неоргани́ческая хи́мия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений.
Это область охватывает все химические соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим[1]). Различие между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными.
[2] Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Теоретическим фундаментом неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Важнейшая задача неорганической химии состоит в разработке и научном обосновании способов создания новых материалов с нужными для современной техники свойствами.
В России исследованиями в области неорганической химии занимаются Институт неорганической химии им. А. В. Николаева СО РАН (ИНХ СО РАН, Новосибирск), Институт общей и неорганической химии им. Н. С.
Курнакова (ИОНХ РАН, Москва), Институт физико-химических проблем керамических материалов (ИФХПКМ, Москва), Научно-технический центр «Сверхтвердые материалы» (НТЦ СМ, Троицк) и ряд других учреждений.
Результаты исследований публикуются в журналах («Журнал неорганической химии» и др.).
История определения
Исторически название неорганическая химия происходит от представления о части химии, которая занимается исследованием элементов, соединений, а также реакций веществ, которые не образованы живыми существами.
Однако со времен синтеза мочевины из неорганического соединения цианата аммония (NH4OCN), который совершил в 1828 году выдающийся немецкий химик Фридрих Вёлер, стираются границы между веществами неживой и живой природы. Так, живые существа производят много неорганических веществ.
С другой стороны, почти все органические соединения можно синтезировать в лаборатории. Однако деление на различные области химии является актуальным и необходимым, как и раньше, поскольку механизмы реакций, структура веществ в неорганической и органической химии различаются.
Это позволяет проще систематизировать методы и способы исследования в каждой из отраслей.
Классификация химических элементов
Основная статья: Периодическая система химических элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д.
И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы).
Всего предложено несколько сотен[3] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и так далее).
В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Простые вещества
Состоят из атомов одного химического элемента (являются формой его существования в свободном состоянии). Все простые вещества в неорганической химии делятся на две большие группы: Металлы — Неметаллы.
Металлы
Основная статья: Металлы
Мета́ллы (от лат.
metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118[4] химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
Таким образом, к металлам относится 96 элементов из всех открытых.
Неметаллы
Основная статья: Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера.
Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются.
Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов.
Это определяет их бо́льшую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. К неметаллам также относят водород и гелий.
Сложные вещества
Большую часть сложных неорганических веществ (то есть состоящих из двух и более химических элементов) можно разделить на следующие группы:
- Оксиды,
- Соли,
- Основания,
- Кислоты.
Оксиды
Основная статья: Оксиды
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще.
Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Соли
Основная статья: Соли
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония ; известны соли фосфония или гидроксония ) и анионов кислотного остатка. Типы солей:
- Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример: , .
- Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: , .
- Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример: .
- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример: .
- Смешанные соли — в их составе присутствует два различных аниона. Пример: .
- Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: .
- Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример: , .
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
Основания
Основная статья: Основание (химия)
Основа́ния — класс химических соединений:
Кислоты
Основная статья: Кислоты
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Также можно выделить следующие группы неорганических веществ: карбиды, нитриды, гидриды, интерметаллиды и другие, которые не укладываются в приведённую выше классификацию (более подробно см. Неорганическое вещество).
Карбиды
Основная статья: Карбиды
Карби́ды — соединения металлов и неметаллов с углеродом.
Традиционно к карбидам относят соединения, в которых углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и тому подобные).
Карбиды — тугоплавкие твёрдые вещества: карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Нитриды
Основная статья: Нитриды
Нитри́ды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4).
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор.
Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Гидриды
Основная статья: Гидриды
Гидри́ды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом[5][6].
Интерметаллиды
Основная статья: Интерметаллиды
Интерметалли́д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами.
Интерметаллиды обладают, как правило, высокой твёрдостью и высокой химической стойкостью. Очень часто интерметаллиды имеют более высокую температуру плавления, чем исходные металлы.
Почти все интерметаллиды хрупки, так как связь между атомами в решётке становится ковалентной или ионной (например, в ауриде цезия CsAu), а не металлической.
Некоторые из них имеют полупроводниковые свойства, причём, чем ближе к стехиометрии соотношение элементов, тем выше электрическое сопротивление. Никелид титана, известный под маркой «нитинол», обладает памятью формы — после закалки изделие может быть деформировано механически, но примет исходную форму при небольшом нагреве.
См. также
Примечания
- ↑ К неорганическим соединениям углерода обычно относят некоторые соли (карбонаты, цианиды, цианаты, тиоцианаты) и соответствующие им кислоты, а также оксиды углерода, карбонилы металлов и карбиды.
- ↑ Spencer L. Seager, Michael R. Slabaugh. Chemistry for Today: general, organic, and biochemistry. // Thomson Brooks/Cole, 2004. — Р. 342. ISBN 0-534-39969-X
- ↑ В книге В. М. Потапов, Г. Н. Хомченко «Химия», М. 1982 (стр. 26) утверждается, что их более 400.
- ↑ Международный химический союз признал 112-й химический элемент
- ↑ Гидриды. XuMuK.ru. Архивировано из первоисточника 22 июня 2012. Проверено 15 июля 2010.
- ↑ onium compounds // IUPAC Gold Book
- Капустинский А. Ф. Очерки по истории неорганической и физической химии в России. М.-Л., 1949
- Жамбулова М. Ш. Развитие неорганической химии (Историко-методологический аспект). Алма-Ата, 1981.- 187 с.
- Неорганическое материаловедение в СССР. Под ред. И. В. Тананаева — Киев: Наукова думка, 1983. — 720 с.
- Популярная библиотека химических элементов. Т. 1,2. / Под ред. И. В. Петрянова-Соколова — М.: Наука, 1983. — 575 с., — 572 с.
- Реми Г. Курс неорганической химии. Т. 1. М.: Изд-во иностранной ли-тературы, 1963. — 920 с.
- Реми Г. Курс неорганической химии. Т. 2. М.: Мир, 1974. — 775 с.
- Шрайвер Э. Неорганическая химия. Т. 1,2. / Э. Шрайвер, П. Эткинс — М.: Мир, 2004. — 679 с., — 486 с.
- Энциклопедия неорганических материалов / Под ред. И. М. Федорчен-ко. В 2-х т. — Киев: Укр. сов. энциклопедия, 1977. — 1652 с.
- Аблесимов Н. Е. Синопсис химии: Справочно-учебное пособие по общей химии — Хабаровск: Изд-во ДВГУПС, 2005. — 84 с. — http://www.neablesimov.narod.ru/pub04c.html
- Аблесимов Н. Е. Сколько химий на свете? ч. 1. // Химия и жизнь — XXI век. — 2009. — № 5. — С. 49-52.
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 мая 2011. |
Источник: https://dic.academic.ru/dic.nsf/ruwiki/7728
Неорганические и органические основания. МБОУ «СОШ с.Озерки» учитель химии Добренькая Т.М. — презентация
1 Неорганические и органические основания. МБОУ «СОШ с.Озерки» учитель химии Добренькая Т.М.
- 2 Цель урока: обобщение, систематизация и углубление знаний о составе, классификации и свойствах оснований.
- 3 Основания — это… Основания это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидроксогруппами (в зависимости от степени окисления металла) Основания –это электролиты, которые образуют в качестве отрицательных ионов только гидроксид –анионы индикаторКислая средаЩелочная среда Нейтральная среда лакмускрасныйсинийфиолетовый фенолфталеинбесцветныймалиновыйбесцветный Метиловый оранжевый Красно- розовый жёлтыйоранжевый
- 4 Согласно протолитической теории Брёнстеда-Лоури основания-это молекулы или ионы, которые являются акцепторами катионов водорода. видеоопыт
5 Классификация оснований 1. Растворимые в воде основания (щёлочи) 2. Малорастворимые в воде гидроксиды 3. Нерастворимые в воде основания Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды типичных и не типичных металлов.
6 Выполните задание. 1.Выберите среди предложенных веществ основания: C 2 H 5 OH, NH 3, Al(OH) 2 Cl, NaOH, Ca(OH) 2, Cu(OH) 2, Cu(OH) 2 CO 3, CH 3 –NH 2 2.Выберите бескислородные основания: NH 3, NaOH, Ca(OH) 2, Cu(OH) 2 CH 3 –NH 2 3.Выберите нерастворимые и малорастворимые основания: NH 3, NaOH, Ca(OH) 2, Cu(OH) 2, CH 3 –NH 2 4.
Выберите двухкислотные основания :NH 3, NaOH, Ca(OH) 2, Cu(OH) 2, CH 3 –NH 2 5.Выберите однокислотные основания : NH 3, NaOH, Ca(OH) 2, Cu(OH) 2, CH 3 –NH 2 Запишите ответы в тетради.
1) NH 3, NaOH, Ca(OH) 2, Cu(OH) 2, CH 3 –NH 2 2) NH 3, CH 3 –NH 2 3) Ca(OH) 2, Cu(OH) 2 4) Ca(OH) 2, Cu(OH) 2 5) NH 3, NaOH, CH 3 –NH 2 Оцените свой результат после проверки!
- 7 Свойства растворимых оснований Щёлочь + Кислота = Соль + Вода 1) Изменяют окраску индикаторов Изменяют окраску индикаторов 2) Взаимодействие с кислотными оксидами Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O 3)Взаимодействие с кислотами — реакция обмена (нейтрализация)нейтрализация Са(OH) 2 + 2HNO 3 = Ca(NO 3 ) 2 + 2H 2 O 4) С растворами солей, если в результате образуется осадок или газ Соль (раствор) + Щёлочь = Нерастворимое основание + Новая соль FeCI 3 + 3NaOH = Fe(OH) 3 + 3NaCl 2NH 4 Cl+Ca(OH) 2 =CaCl 2 +2NH H 2 O 5)С амфотерными оксидами и гидроксидами 2NaOH+Al 2 O 3 =2NaAlO 2 +H 2 O 2КOH+Zn(OH) 2 =K 2 ZnO 2 +2H 2 O
- 8
- 9
- 10 химические свойства аминов Основные свойства: а)СН 3 NH 2 + H 2 O = СН 3 NH 3 OH Этиламин гидроксид метиламмония б)(С 2 Н 5 ) 2 NH + HСl = (С 2 Н 5 ) 2 NH 2 Cl Диэтиламин хлориддиэтил аммония видеоопыт
11 Проверьте ваши знания Ответы: I. Вариант II. Вариант
12 Практическое значение оснований
13 Домашнее задание Для учащихся, сдающих ЕГЭ по химии. § 21 2,5, 7, по учебнику «Химия 11класс» Профильный уровень. О.С.Габриелян, Г.Г.Лысова Для учащихся, не сдающих ЕГЭ по химии. § 23 4, 5а,7 по учебнику «Химия 11класс» Базовый уровень. О.С.Габриелян,
Источник: http://www.myshared.ru/slide/453345/




