На предыдущих двух вступительных уроках в курс молекулярной физики речь шла об основных положениях МКТ. Сейчас же мы подробнее остановимся на первом положении (все тела состоят из маленьких частиц), а именно поговорим о численных оценках некого тела, некой порции вещества. Введём понятие массы молекулы, количества вещества, молярной массы и относительной атомной и молекулярной массы.
Тема: Основы молекулярно-кинетической теорииУрок: Масса молекул. Количество вещества
В предыдущих уроках уже упоминалось о том, что средний размер атомов и молекул (за исключением органических соединений) не превосходит см (рис. 1). Очевидно, что тела с такими размерами не могут иметь большой массы. Так и есть.

Рис. 1. Атомная структура сплава золота под микроскопом (Источник)
Масса молекулы обозначается и, как и любая другая масса, измеряется в кг. Несложно догадаться, что для нахождения описываемой величины необходимо измерить массу некой порции вещества и поделить её на количество молекул, входящих в эту порцию.
К примеру, в одном грамме воды содержится примерно молекул. Следовательно, по вышеуказанной формуле, масса молекулы воды составляет примерно кг. И опять-таки, если не принимать во внимание органические вещества, то массы молекул всех веществ соизмеримы по величине.
![]()
Так как всегда неудобно работать со слишком большими или слишком маленькими величинами, в физике и химии введены такие величины, как относительная атомная масса (ОАМ) и относительная молекулярная масса (ОММ).
Определение. Относительная атомная масса – отношения массы атома определённого химического элемента к одной двенадцатой массы атома углерода.
На данный момент все ОАМ известных элементов с довольно большой точностью рассчитаны и известны. Для нахождения относительной массы некой молекулы достаточно просто сложить относительные атомные массы тех элементов, которые входят в состав молекулы, причём столько раз, сколько штук атомов элемента входит в молекулу. На примере молекулы воды это выглядит:
![]()
Стоит добавить, что относительные атомные и молекулярные массы берутся из отношения к массе атома углерода, потому что углерод является одним из самых распространённых элементов в природе.
Некую порцию вещества (некое тело) иногда требуется описать не со стороны, какая масса этой порции, а какое количество частиц содержится в ней. И, как уже было сказано ранее, такими большими числами, коими описывается абсолютное количество молекул и атомов в веществе, пользоваться неудобно. Поэтому вводится такая величина, как количество вещества.
Определение. Количество вещества – физическая величина, характеризующая количество молекул, входящих в некую порцию вещества. Обозначение – .
- Единица измерения – моль.
- 1 моль – такое количество вещества, которое содержит столько же молекул (атомов), сколько 12 г углерода.
- Чтобы посчитать количество вещества некой порции вещества, необходимо воспользоваться формулой:
- Здесь: — количество всех частиц в порции вещества; — количество частиц в одном моле, величина, обозначенная как число Авогадро.
Определение. Число Авогадро – посчитанное итальянским учёным Амедео Авогадро (рис. 2) количество атомов в 12 г углерода. Исходя из определения моля – количество молекул или атомов в 1 моле. Единица измерения — . Значение этой важной константы:
![]()

Рис. 2. Амедео Авогадро (Источник)
Некая порция вещества в количестве 1 моля уже имеет как различимые глазом размеры (уже является макрообъектом), так и ощутимую массу. Поэтому имеет смысл ввести понятие молярной массы.
Определение. Молярная масса – масса одного моля вещества. Обозначение – . Единица измерения – . Для того чтобы вычислить эту величину, следует массу одной частицы умножить на количество частиц в 1 моле (число Авогадро). То есть:
Найти значение молярной массы для любого химического элемента можно в таблице Менделеева. В ячейке для нужного вам элемента молярная масса – это десятичная дробь. Например, для железа молярная масса 55,847 (Рис. 3).
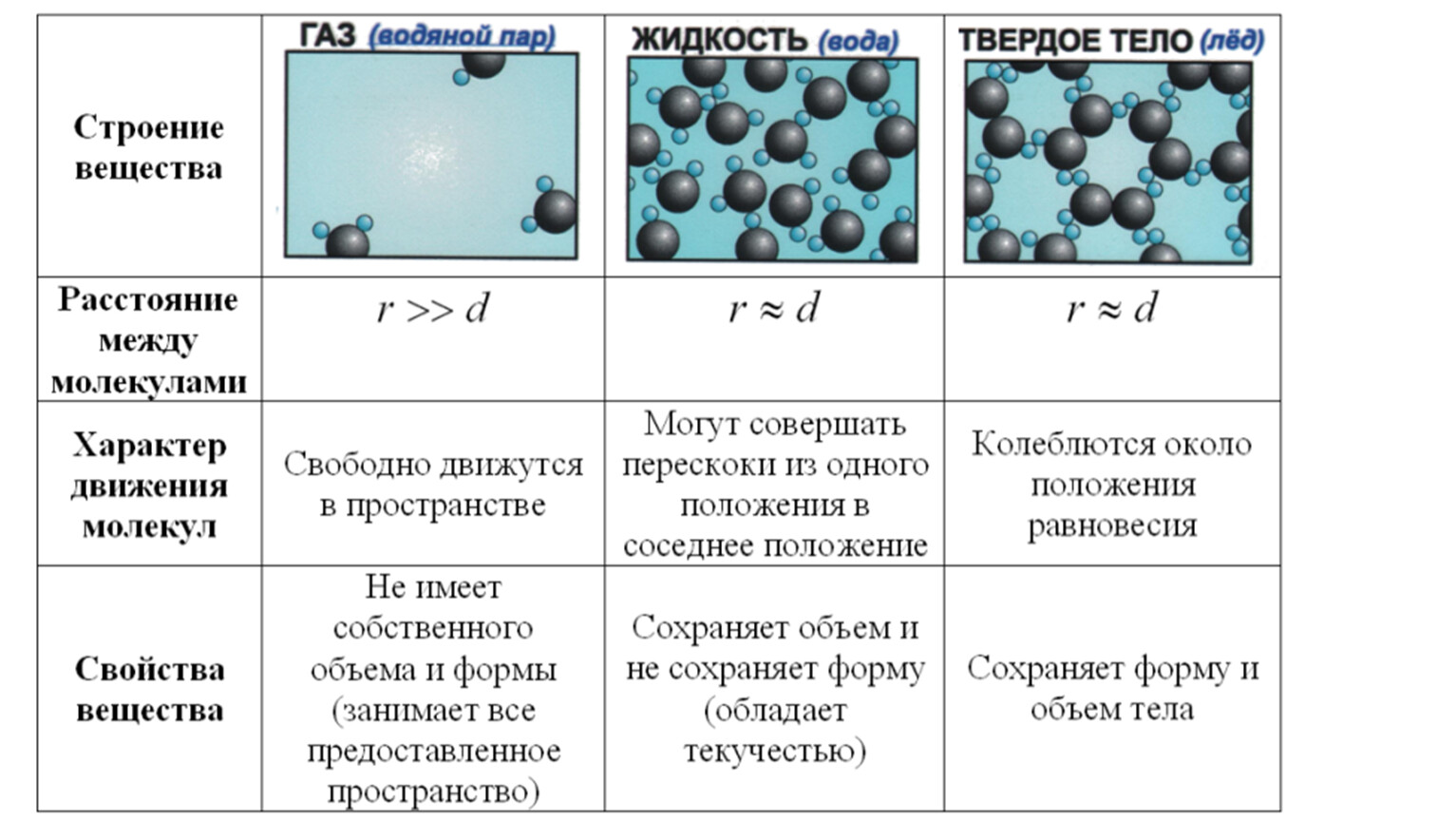
Рис. 3. Пример оформления элемента в таблице Менделеева (Источник)
Следует помнить два правила работы с таблицей Менделеева. Во-первых, все значения следует округлять до целых по правилам математики. Исключение – хлор, его молярная масса = 35,5 . Во-вторых, все молярные массы даны в размерности , поэтому, чтобы перевести эту величину в единицу измерения СИ, необходимо округлённое число умножить на .
- Для нахождения молярных масс сложных веществ нужно просто сложить молярные массы элементов, входящих в состав молекулы этого вещества.
- Введя понятие молярной массы, мы можем теперь получить другую формулу для определения количества вещества:
- Здесь: — масса порции вещества; — молярная масса вещества.
Начиная со следующего урока, мы приступаем к изучению газов. На следующем уроке мы введём физическую модель газа, с которой будем работать в дальнейшем, перечислим параметры, описывающие газ, и сформулируем уравнение, связывающее эти параметры.
Список литературы
- Мякишев Г.Я., Синяков А.З. Молекулярная физика. Термодинамика. – М.: Дрофа, 2010.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. – М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. – М.: Дрофа, 2010.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
- Стр. 64: № 454, 455, 459 – 463. Физика. Задачник. 10-11 классы. Рымкевич А.П. – М.: Дрофа, 2013. (Источник)
- Какой была бы относительная атомная масса фтора, если бы за атомную единицу массы приняли массу атома кислорода?
- Где больше молекул: в 5 г водорода или в 10 г воды? Во сколько раз?
- При изготовлении микросхем в кристалл кремния массой 1 мг вводят галлий массой . Сколько атомов кремния приходится на один атом галлия?
- *В закрытом баллоне с кислородом находится 12 г угля. Во сколько раз изменится количество вещества в баллоне после сгорания угля? Масса кислорода – 32 г.
Источник: https://interneturok.ru/lesson/physics/10-klass/osnovy-molekulyarno-kineticheskoy-teorii/massa-molekul-kolichestvo-veschestva-eryutkin-e-s?trainers
Масса и размер молекул. Постоянная Авогадро
Молекулярно-кинетическая теория — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов как мельчайших частиц вещества. В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул.
Упругость газов, твердых и жидких тел, способность жидкостей смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами.
Явление диффузии — способность молекул одного вещества проникать в промежутки между молекулами другого — тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавления или путем давления.
Подтверждением непрерывного хаотического движения молекул является также и броуновское движение — непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости.
Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения — уменьшение температуры.
Существование броуновского движения убедительно подтверждает движение молекул.
Любое вещество состоит из частиц, поэтому количество вещества v принято считать пропорциональным числу частиц, т. е. структурных элементов, содержащихся в теле.
Единицей количества вещества является моль. Моль — это количество вещества, содержащее столько же структурных элементов любого вещества, сколько содержится атомов в 12 г углерода С12. Отношение числа молекул вещества к количеству вещества называют постоянной Авогадро:
![]()
Постоянная Авогадро показывает, сколько атомов и молекул содержится в одном моле вещества. Молярная масса — масса одного моля вещества, равная отношению массы вещества к количеству вещества:
М = m/v.
Молярная масса выражается в кг/моль. Зная молярную массу, можно вычислить массу одной молекулы:
![]()
Средняя масса молекул обычно определяется химическими методами, постоянная Авогадро с высокой точностью определена несколькими физическими методами. Массы молекул и атомов со значительной степенью точности определяются с помощью масс-спектрографа.
Массы молекул очень малы. Например, масса молекулы воды:
Молярная масса связана с относительной молекулярной массой Мг. Относительная молекулярная масса — это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода С12.
Если известна химическая формула вещества, то с помощью таблицы Менделеева может быть определена его относительная масса, которая, будучи выражена в килограммах, показывает величину молярной массы этого вещества.
Диаметром молекулы принято считать минимальное расстояние, на которое им позволяют сблизиться силы отталкивания. Однако понятие размера молекулы является условным. Средний размер молекул порядка 10^-10м.
Источник: http://ingaagapova.ucoz.ru/blog/massa_i_razmer_molekul_postojannaja_avogadro/2012-04-30-240
Основы молекулярной физики
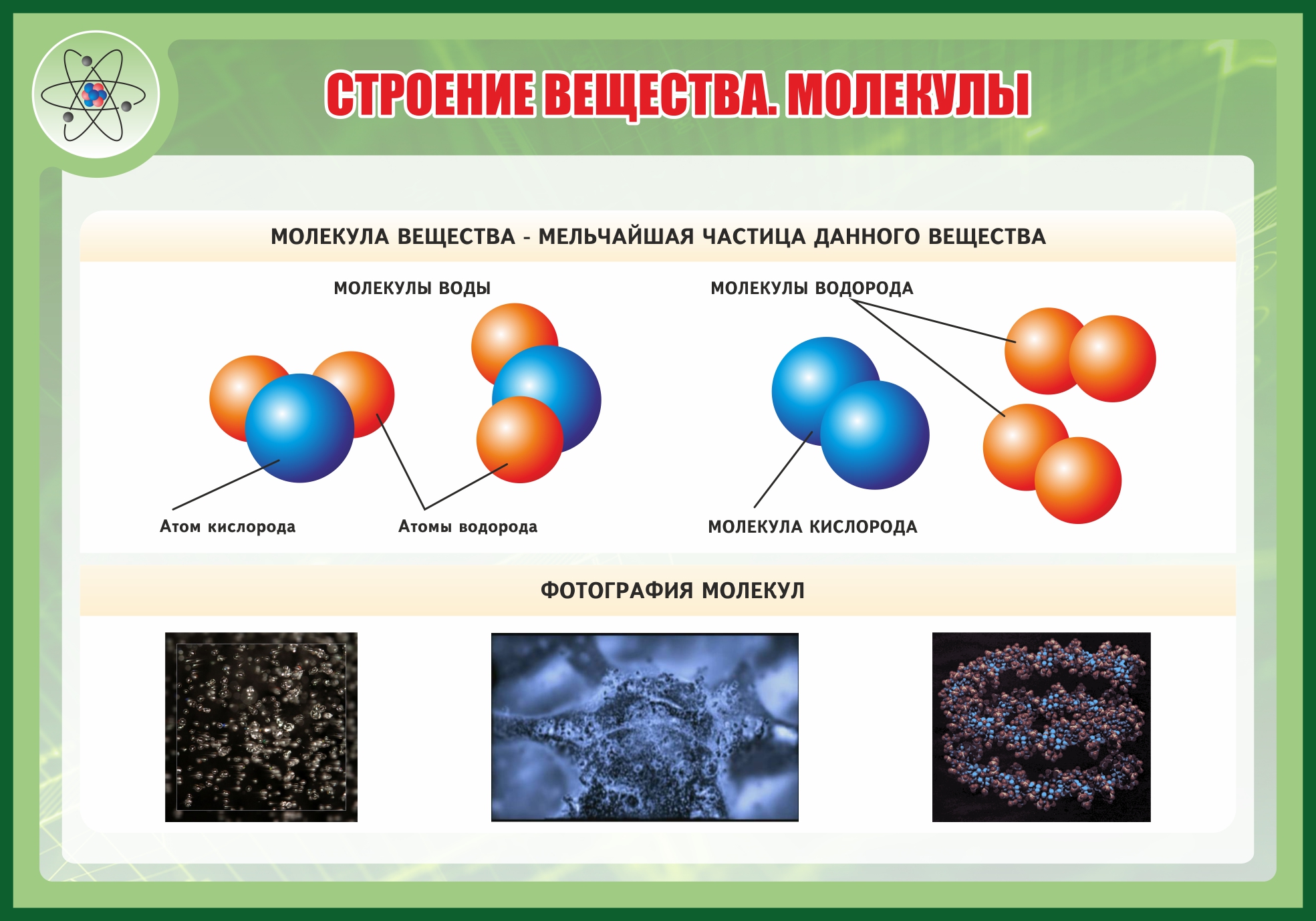
Молекула (новолат. molecula, уменьшительное от лат.
moles — масса) — это частица, образованная двумя или большим количеством атомов, характеризующаяся определённым количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Молекулы вещества имеет постоянный состав, то есть одинаковое количество атомов, объединённых главными взаимодействиями — химическими связями, при этом химическая индивидуальность молекулы определяется именно совокупностью и конфигурацией химических связей.
в Вакуум в физике — это такое состояние газа, когда его давление меньше атмосферного.
Давление от атмосферного до наименьшего достижимого условно делиться на четыре областию эти области вакуума характеризируется отношением средней длины свободного пробега l молекул газа к линейным размерам d сосуда, в котором находиться газ. В области низкого вакуума средняя длина свободного пробега молекул во много раз меньше линейного размера сосуда (l/d) > 1.
| Вещество | Диаметр молекулы, нм | Вещество | Диаметр молекулы, нм |
| Азот (N2) | 0,32 | Оксид серы (IV) | 0,34 |
| Вода (H2O) | 0,30 | Оксид углерода (IV) | 0,33 |
| Водород (H2) | 0,25 | Оксид углерода (II) | 0,32 |
| Гелий (He) | 0,20 | Хлор (CI2) | 0,37 |
| Кислород (O2) | 0,30 | Хлороводород (HCI) | 0,30 |
- Размер частиц пыли — 0,1 — 0,001 мм (100-1мкм)
- Размер частиц тумана — 0,01 — 0,001 мм (10 — 1) мкм
- Размер броуновской частицы — 0,0004 мм (40 нм)
- Размер молекулы гемоглобина — 6,4 нм
| Вещество | Расстояние, нм | Вещество | Расстояние, нм |
| Азот (N2) | 0,11 | Ртуть (Hg2) | 0,33 |
| Водород (H2) | 0,07 | Сера (S2) | 0,19 |
| Гидрид натрия (NaH) | 0,19 | Фосфор (Р2) | 0,19 |
| Кислород (O2) | 0,12 | Углерод (С2) | 0,13 |
| Натрий (Na2) | 0,31 |
Примечание. Расстояние между атомами в молекуле имеет строго определенное значение. Оно определяется рановесным расстоянием, на котором испытываемые каждым атомом силы приложения уравновешиваются силами оталлкивания.
Масса молекул некоторых элементов и соединений
| m, 10-27кг | m, 10-27кг | ||
| Азот (N2) | 46,5 | Карбонат кальция (CaCO3) | 166 |
| Аммиак (NH3) | 28,3 | Нафталин (C1010H8) | 213 |
| Ацетон [(CH3)2CO] | 96,5 | Нитрат серебра (AgNO3) | 282 |
| Вода (H2O) | 29,9 | Оксид ртути (II) | 360 |
| Водород (H2) | 3,3 | Серная кислота (H2SO4) | 163 |
| Едкий натр (NaOH) | 66,4 | Сульфат меди (CuSO4) | 265 |
| Едкое кали (KOH) | 93,2 | Хлороводород (HCI) | 60,6 |
| Глицерин [C3H5(OH)3] | 153 | Хлорид натрия (NaCI) | 97 |
| Кислород (O2) | 53,2 |
Средняя скорость движения молекул газа
| Газ | Водород | Кислород | Углекислый газ |
| t, C | Скорость, м/с | ||
| 1693 | 425 | 362 | |
| 20 | 1755 | 440 | 376 |
| 100 | 1980 | 496 | 422 |
| 200 | 2232 | 556 | 475 |
Зависимость средней скорости движения молекул газа от температуры

Распределение молекул по скоростям движения
| Интервал скоростей, м/с | Относительное число молекул, % | Интервал скоростей, м/с | Относительное число молекул, % |
| Менее 100 | 1,4 | 600-700 | 9,2 |
| 100-200 | 8,1 | 700-800 | 4,8 |
| 200-300 | 16,5 | 800-900 | 2,0 |
| 300-400 | 21,4 | 900-1000 | 0,6 |
| 400-500 | 20,6 | Более 1000 | |
| 500-600 | 15,1 |
В таблице приведены интервалы скоростей молекул и соответстующее им относительное число молекул в процентах, имеющих скорость в данном интервале. Данные относятся к молекулам газообразного кислорода, находящегося при нормальных условиях (t=0 oC, p=101 325 Па =760 мм рт.ст.).
Длина свободного пробега молекул газа
при различном давлении (t=20 oC)
| Давление | Средняя длина свободного пробега | Давление | Средняя длина свободного пробега | ||
| Па | мм рт.ст. | Па | мм рт.ст. | ||
| 101 325 | 760 | 62 нм | 10-2 | 10-4 | 0,5 |
| 100 | ≈ 1 | 47 мкм | 10-3 | 10-5 | 4,7 |
| 50 | 0,4 | 190 мкм | 10-4 | 10-6 | 47 м |
| 10 | 0,1 | 0,5 мм | 10-5 | 10-7 | 0,5 км |
| 1 | 0,01 | 4,7 мм | 10-6 | 10-8 | 4,7 км |
| 10-1 | 0,001 | 47 мм | 10-7 | 10-9 | 47 км |
Длина свободного пробега молекул различных газов
при нормальных условиях (t=0 oC, p=101 325 Па)
| Газ | Азот | Водород | Водянной пар (100 oC | Воздух | Гелий | Кислород | Углекислый газ |
| Длина свободного пробега, нм | 63 | 110 | 67 | 60 | 175 | 63 | 39 |
Длина свободного пробега молекул газа на различной высоте над землей
| Высота, км | Длина свободного пробега | Высота, км | Длина свободного пробега |
| 66,3 нм | 10 | 196 нм | |
| 0,05 | 66,6 нм | 20 | 914 нм |
| 0,1 | 67,0 нм | 30 | 4410 нм |
| 0,2 | 67,6 нм | 50 | ≈ 79 мкм |
| 0,5 | 69,9 нм | 60 | ≈ 0,26 мм |
| 1 | 73,1 нм | 80 | 4,4 мм |
| 2 | 80,7 нм | 90 | 23,8 мм |
| 5 | 110 нм | 100 | ≈ 14 см |
| 8 | 155 нм | 120 | 2,93 м |
В таблицах приведены средняя длина свободного пробега молекул газов.
Среднее число столкновений молекул
| Азот | 7,2 х 109 | Кислород | 6,7 х 109 |
| Водород | 1,5 х 1010 | Неон | 1,3 х 109 |
| Воздух | 7,5 х 109 | Углекислый газ | 9,3 х 109 |
Число молекул в единице объема
Число молекул в 1 см3 при различных давлениях (t=20 oC)
| Диапазон давлений | Примерное число молекул воздуха в 1 см3 | Область вакуумав | |
| Па | мм рт. ст. | ||
| 101 325 — 133 | 760 — 1 | 1019- 1016 | Низкий вакуум |
| 133 — 0,13 | 1 — 10-3 | 1016 — 1013 | Средний вакуум |
| 0,13 — 1,3 х 10-5 | 10-3- 10-7 | 1013- 1010 | Высокий вакуум |
| 1,3 х 10-5 и менее | 10-7 и ниже | 1010 и менее | Сверхвысокий вакуум |
Источник: http://www.kilomol.ru/molecula.html
Атомы и молекулы
Тема урока – атомы и молекулы. Представление о том, что материя состоит из неких элементарных блоков (атомов) зародилось в Древней Греции, в трудах философов-материалистов. Вновь об атомах заговорили в 18-19 веках, когда создавалась молекулярно-кинетическая теория газов.

Классическая физика считала атомы – элементарными частицами материи. Они обладали набором характеристик (зарядом и массой) и могли образовывать соединения – молекулы. Именно из молекул строится всякое вещество, при этом молекула может состоять из одного атома (как в случае благородных газов, кислорода, ртути и т.д.).
Рис. 1. Молекула воды.
О строении самих элементарных частиц материи представления не было. Считалось, что они неуничтожимы, неделимы и не могут превращаться друг в друга. Такой взгляд привел к созданию молекулярно-кинетической теории, которая решила вопросы своего времени.
Учеными 19-го века также было получено число Авагадро $N_A = {6,022 cdot 10^{23}} моль^{-1}$, т.е. количество молекул (атомов) в 1 моле вещества (т.е. в 12 г углерода C-12). Исходя из этого параметра легко получить формулу числа молекул (атомов) в любом количестве вещества: $N = {{m over M} cdot N_A}$, где M – молярная масса.
Методами химии и физики удалось измерить размеры молекул и атомов, а также их массы.
К примеру, диаметр молекулы кислорода $O_2$ составляет примерно $3 cdot 10^{-10}$ м, а масса $53 cdot 10^-27$ кг. В то же время атом кислорода намного меньше – $d = {4,8 cdot 10^{-11}}$.
Его абсолютную массу можно получить, если атомную массу кислорода, взятую из таблицы Менделеева, умножить на $1 a.е.м. = 1,66 cdot 10^{-27} кг$.
Тогда масса атома кислорода $m = {15,99 cdot {1,66 cdot 10^{-27}}} = {26,54 cdot 10^{-27}} кг$.
Рис. 2. Молекула кислорода.
Из сравнения этих величин видно, что масса молекулы кислорода равна сумме масс двух атомов кислорода, но о размерах сказать тоже самое нельзя. Разница в один порядок. Дело в том, что атомы в молекулах находятся на определенном расстоянии друг от друга. В твердых телах это расстояние наименьшее, в газах – наибольшее.
Опыты Томсона (1897 г.) и Резефорда (1911 г.) привели к революции: атом более не был элементарной частицей материи.
Появилась планетарная модель, согласно которой атом состоял из массивного ядра и вращающегося вокруг него электрона.
Позднее Резерфордом и его учениками было установлено, что ядра в свою очередь состоят из протонов (частица с теми же зарядом и массой, что у водорода H-1) и нейтронов (нейтральных частиц, обладающих массой).
Рис. 3. Планетарная модель атома.
Со временем от планетарной модели отказались. К этому привело противоречие: в классическом представлении вращающиеся электроны должны испускать энергию и в конечном итоге падать на ядро атома. Этого не происходило. Объяснение дала квантово-механическая модель атома.
- Какова масса молекулы воды, если молярная масса водорода – 1 моль, а кислорода – 16?
- Решение
- Так как молекула воды состоит из двух атомов водорода и одного атома кислорода, запишем выражение для молярной массы воды:
- $M_{H_2O} = 2M_H + M_O = 18$
- Тогда масса воды:
$m = {M_{H_2O} cdot 1 а.е.м.} = {18 cdot {1,66 cdot 10^{-27}}} = {30 cdot {1,66 cdot 10^{-27}}} кг$
- Известно, что масса двухатомной молекулы некоторого вещества равна $97,1 cdot 10^{-27}$. Что это за вещество?
Решение
$M = {m over N_a} = {97,1 over 1,66} = 58,5 моль$
Поскольку вещество двухатомное, то 58,5 моль – это сумма молярных масс двух различных атомов. Такую сумму дают молярные массы Na и Cl. Из этого следует, что искомое вещество – хлорид натрия, т.е. соль. Такую же формулу имеет минерал Галит.
В ходе урока были рассмотрены строение атома и молекул, а также проведено сравнение масс некоторых молекул и атомов и их размеров. Для закрепления пройденного материала были решены две простые задачи.
Средняя оценка: 4.6. Всего получено оценок: 158.
Источник: https://obrazovaka.ru/fizika/atomy-i-molekuly-formula.html
Масса и размер молекул
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами.
Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
- Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
- Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
- Мr = (m0) : (m0C / 12)
- где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12.
Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м.
, то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м.
, если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу).
Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
- Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
- ν = N / NA
- где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро.
Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
- В 1 моле любого вещества содержится одинаковое количество частиц.
- NA = 6,02 * 1023 моль-1
- Молярная масса – это масса вещества, взятого в количестве одного моля:
- μ = m0 * NA
- где m0 – масса молекулы.
- Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
- Молярная масса связана с относительной молекулярной массой соотношением:
- μ = 10-3 * Mr [кг*моль-1]
- Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
- m = m0N = m0NAν = μν
- Количество вещества равно отношению массы вещества к его молярной массе:
- ν = m / μ
- Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
- m0 = m / N = m / νNA = μ / NA
- Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Источник: http://av-mag.ru/physics/index.php/molecule/mkt-base/molecule-mass/
Презентация по физике на тему: "Размеры и масса молекул. Количество вещества"
Слайд 1
Презентация по физике «Размеры и масса молекул. Количество вещества» Ученика 10 класса ГБОУ СОШ № 1465 Склянкина Владимира Учитель физики Л.Ю. Круглова
Слайд 2
Размеры молекул Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами.
Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около см . Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43 ∙ 10 -8 см.
- Слайд 3
- Электронный микроскоп
- Слайд 4
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Слайд 5
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Слайд 6
Масса молекулы Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества М r – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода-12 = , где m 0 – масса молекулы (или атома) данного вещества, m 0C – масса атома углерода. Относительная молекулярная (атомная) масса выражается в атомных единицах массы ( а.е.м .) .
Слайд 7
Атомная единица массы – это 1/12 массы изотопа углерода С-12. Точные измерения показали, что атомная единица массы составляет 1,660 ∙ 10 -27 кг, то есть 1 а.е.м .
= 1,660 ∙ 10 -27 кг Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И.
Менделеева. В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы ( а.е.м .). Например, атомная масса магния равна 24,305 а.е.м .
, то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м . (это следует из того, что 1 а.е.м . = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Слайд 8
Зачем измерять массу молекул и атомов в а.е.м ., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м .
Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет: m 0Mg = 24,305 ∙ 1 a.e.м . = 24,305 ∙ 1,660 ∙ 10 -27 = 40,3463 ∙ 10 -27 кг Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы.
Например, масса молекулы воды (Н 2 О) будет равна: = 2 ∙ m H + m O = 2 ∙ 1,00794 + 15,9994 =18,0153 a.e.м .= 29,905 ∙ 10 -27 кг
Слайд 9
Количество вещества Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в Международной системе единиц (СИ) — моль.
Слайд 10
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа. При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Слайд 11
Например, для реакции горения водорода (2H 2 + O 2 → 2H 2 O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода).
Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях.
Фактическое количество единиц вещества в 1 моле называется числом Авогадро (N A = 6,022 141 79(30)·10 23 моль −1 ) (правильнее — постоянная Авогадро , так как в отличие от числа эта величина имеет единицы измерения).
Слайд 12
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: ν =m/M , где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой. По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: ν = V / V m , где V — объём газа (при нормальных условиях), V m — молярный объём газа при Н. У., равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества : ν = = =
Источник: https://nsportal.ru/ap/library/nauchno-tekhnicheskoe-tvorchestvo/2013/12/07/prezentatsiya-po-fizike-na-temu-razmery-i-massa
Масса молекул (относительная молекулярная масса)
Малые размеры атомов и молекул обусловливают их незначительную массу.
Так, масса молекулы кислорода равна 53,5 • 10-27кг, водорода — 3,34 • 10-27 кг, воды — приблизительно 30 • 10-27 кг, что вызывает определенные трудности в расчетах.
В связи с этим в молекулярной физике массу молекул часто измеряют в атомных единицах массы (а. е. м.), сравнивая ее с 1/12 массы атома изотопа углерода-12.
Отношение массы молекулы данного вещества m0 к 1/12 массы атома углерода m0C называют относительной молекулярной массой вещества Mr:
Чтобы определить относительную молекулярную массу вещества, необходимо по структурной формуле сложить относительные атомные массы его составляющих. Например, относительная молекулярная масса воды равна 18, поскольку атомные массы водорода и кислорода равны 1 и 16 соответственно. Из формулы воды H2O имеем: 2 x 1 + 16 = 18 а. е. м.
Множитель 1/12 введен для того, чтобы относительные молекулярные массы были близки к целым числам. Например, относительная молекулярная масса молекулы кислорода O2 равна приблизительно 32 а. е. м., а молекулы водорода — 2 а. е. м.
Установлено, что атомная единица массы равняется 1,6605655 • 10-27 кг. Поэтому по данному значению можно определить массу любой молекулы:
m0 ≈ Мr • 1,661 • 10-27 кг.
Масса молекулы воды приблизительно равна: mН2O = 18 • 1,661 • 10-27 кг ≈ 30 • 10-27 кг. Материал с сайта http://worldofschool.ru
Итак, размеры и масса молекул очень маленькие, тем не менее их количество в макроскопическом теле огромное. Например, в 1 г воды приблизительно 3,3 • 1022 молекул. Чтобы упростить расчеты, в физике и химии количество атомов, молекул или других структурных единиц в данном теле принято сравнивать с количеством атомов в 12 г углерода.
Для измерения массы вещества молекулярная физика использует относительную молекулярную (атомную) массу. Относительные атомные массы всех известных химических элементов приведены в Периодической таблице химических элементов Д. И. Менделеева.
На этой странице материал по темам: Вопросы по этому материалу:
Источник: http://WorldOfSchool.ru/fizika/molekulyarnaya/velichiny/kolichestvo-veshhestva/massa-molekul-otnositelnaya-molekulyarnaya-massa
Как впервые определили массу атомов
Явление броуновского движения и его исследователи проложили торную дорогу в мир атомов. Особенно конечно здесь надо отметить Альберта Эйнштейна, как теоретика, Мариана Смолуховского, как математика и Жана-Батиста Перрена, как физика- экспериментатора.
Жан-Батист Перрен. Agence de presse Meurisse — Bibliothèque nationale de France, Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=18368501
В 1908 году этот француз окончательно доказал существование атомов и убедил своими исследованиями самых ярых противников атомистической теории.
Перрен брал кусочки гуммигута — смолы, используемой для изготовления лаков и красок.
Гуммигут. Источник. mpmart.ru
Ученый растирал кусочки этой смолы и растирал их в воде руками. Вода становилась ярко-желтого цвета. После этого эмульсия исследовалась под микроскопом. Гуммигут распадался в воде на так называемые зернышки, но не растворялся.
Первая проблема была в том, что частички гуммигута были совершенно разного размера. А Перрену нужны были одинаковые. Проблему он решил остроумно, использовав центрифугу. Центрифуга делала 2500 оборотов в минуту. Первыми выпадали частицы большего размера, а значит и большей массы.
Да это была кропотливейшая работа, требующая нечеловеческого терпения. Из килограмма гуммигута получалось несколько сотых долей грамма зерен необходимого размера.
Через месяц напряженнейшего труда Жан-Батист получил несколько проб эмульсии смолы с частичками разного размера: 0.5; 0.46; 0.37; 0.21; 0.14 микрон (микрон равен 0,001 миллиметра).
И вот тут началось самое интересное.
Опыт 1. Каплю эмульсии Перрен поместил на дно стеклянной ванночки и покрыл тонкой стеклянной пластинкой. Глубина ванночки ( кюветы) была сто микрон (0,1 мм).Края были залиты парафином. Капля эмульсии получилась размазанной по дну ванночки и герметически запертой, чтобы не было испарения. Французский ученый поставил кювету на бок и изучал эмульсию в микроскоп.
В него можно было увидеть водно-эмульсионную вертикальную стенку с зернышками гуммигута. Самое главное, что зернышки распределились по эмульсии неравномерно. Соответственно внизу больше, вверху меньше.
Распределение гуммигута в воде. Рисунок автора.
Перрен решает найти закономерность убывания плотности эмульсии с высотой. И тут он опять принимает ряд оригинальных экспериментаторских решений.
Опыт 2. Кювету возвратили на дно и стали рассматривать в микроскоп сверху вниз. Что же оригинального спросите Вы? А то, что Перрен взял микроскоп с очень маленькой глубиной поля зрения, всего в один микрон. Передвигая микроскоп вверх и вниз можно было рассматривать эмульсию на разной глубине, то есть по сути изучать ее послойно.
Перрен стал подсчитывать число зернышек в слоях толщиной в 1 микрон. Здесь опять пришлось французу применить свою экспериментаторскую смекалку. Частички смолы двигались очень быстро и считать их, наблюдая за ними, было невероятно сложно.
Жан-Батист сузил и поле зрения, гуммигут он изучал через булавочный прокол в металлической фольге. В такое узкое поле зрения микроскопа попадало не более пяти зернышек одновременно.
Делать подсчеты приходилось много-много-много раз, чтобы получить достоверное среднее значение.
Частицы эмульсии гуммигута были подсчитаны на высотах 5, 35, 65 и 95 микрон над уровнем донышка кюветы.
Фотографии, сделанные Перреном через микроскоп на разных высотах эмульсии. Источник: журнал «Квант».
Оказалось и это важно, что плотность частиц с увеличением высоты на 30 микрон убывает ровно в 2 раза. То есть на высоте 35 микрон частиц было в два раза меньше, чем на высоте 5 микрон.
Рисунок автора.
Соответственно закономерность Перрен сформулировал так: если высоты образуют арифметическую прогрессию, то число зернышек — геометрическую.
Это был невероятный результат. Ведь по такому же закону, установленному еще Паскалем, который называют барометрической формулой, падает с высотой плотность воздушной оболочки Земли — атмосферы.
Большая получается статья, но уважаемые читатели — терпите. Разбивать я ее не решился.))
При чем тут масса атома, и где масса атома? Сейчас все будет. Перрен проводит следующую аналогию:
Эмульсия — это атмосфера в миниатюре, тяготеющая к Земле. В масштабе такой атмосферы высота Альп представилась бы несколькими микронами, а отдельные холмы стали бы равны молекулам.
Вот она ключевая мысль, в эмульсии действуют те же законы, что и в атмосфере. Ну а дальше дело простое, сделать расчет. Количество кислорода уменьшается в атмосфере вдвое при увеличении высоты на 5 км.
Количество частиц в эмульсии уменьшается вдвое при увеличении высоты на 30 микрон. Пропорция
Пять километров в 165 миллионов раз больше, чем 30 микрон. Значит масса гуммигутового зернышка размером 0,21 микрон в 165 миллионов раз больше массы молекулы кислорода. Масса гуммигутовой частицы равна 0,000 000 000 000 01 грамма.
(вычисления были выполнены Перреном, исходя из количества таких частиц в 1 грамме гуммигута). Делим массу гуммигутового зерна на 165 000 000, и получим массу молекулы кислорода. Она получается равной 0,000 000 000 000 000 000 05 грамма.
Разделим на 32 (молекула кислорода в 32 раза тяжелее атома водорода) и , вуаля, вот и масса атома водорода, самого легкого во Вселенной. Она равна 0,000 000 000 000 000 000 000 0016 г. Значит в 1 грамме содержится 600 000 000 000 000 000 000 000 атомов водорода.
Масса водорода получилась ничтожно малой, но тем не менее материальной и точно определенной. Противник атомов были повержены.
Гениальность ученого была вознаграждена Нобелевской премией по физике, хотя формулировка была за «седиментационное равновесие», но броуновское движение конечно никто не забыл.
Подписывайтесь. Не забывайте про лайки. Делитесь в соцсетях. Спасибо
Источник: https://zen.yandex.ru/media/id/5a630d2c9b403c5442578563/5c8d475f48001d00b4f5eb49




