Висмут (лат. Bismuthum) – химический элемент V группы периодической системы Д.И. Менделеева. Среди нерадиоактивных элементов висмут имеет самый большой атомный номер – 83 и атомную массу – 208,9804.

Происхождение названия этого элемента трактуют по-разному. Одни исследователи склонны считать его производным от древнегерманского слова «Wismuth» (белый металл), другие – от немецких слов «Wiese» (луг) и «muten» (разрабатывать рудник), поскольку в Саксонии, висмут издревле добывали на лугах округа Шнееберг.
Есть еще одна версия, согласно которой название элемента произошло от арабского «би исмид», что означает «обладатель свойств сурьмы». Висмут действительно на нее очень похож. Какая из этих точек зрения наиболее близка к истине, сказать трудно. Нынешний символ элемента №83, Bi, впервые введен в химическую номенклатуру в 1819 г.
шведским химиком Берцелиусом.
Висмут известен со средневековья (впервые упомянут в письменных источниках в 1450 году как Wismutton или Bisemutum). Первые сведения о висмуте появились в начале XVI в. в трудах минералога и металлурга Георга Бауэра (Агриколы). Однако до XVIII века его считали разновидностью свинца, олова или сурьмы.
Лишь в 1753 француз Клод Жофруа (Claude J. Geoffroy) высказал мнение, что это отдельный элемент. Эту точку зрения подтвердил в 1793 г. Потт (J. H. Pott), описавший свойства висмута. В 1739 г. немецкий химик Потт установил самостоятельность элемента висмута. Окончательно как элемент он был открыт в 1799 г.
шведским химиком Т. Бергманом.

Известный металлург и минералог средневековья Георг Агрикола в своей книге «О месторождениях и рудниках в старое и новое время», написанной в 1546 году, возвел висмут в ранг одного из основных металлов, присовокупив его к известной с древности «великолепной семерке» — золоту, серебру, меди, железу, свинцу, олову и ртути.
Однако окончательно «права гражданства» висмут обрел лишь в XVIII веке.
Этому металлу, пожалуй, как ни одному другому химическому элементу, повезло с названиями: по подсчетам некоторых ученых, в литературе XV-XVIII веков можно встретить более 20 «псевдонимов» висмута и среди них такие выразительные, как демогоргон, глаура, нимфа.
Висмут является последним членом подгруппы мышьяка. Относится к халькофильным элементам. Ближайшие аналоги висмута — сурьма и свинец. Кларк его по А. П. Виноградову составляет 9–10%. Содержание висмута повышается от ультраосновных магматических пород (1–10%) к кислым (1– 10%). Он представлен одним изотопом с массовым числом 209.
Характеризуется переменной валентностью, в природных условиях преобладает Bi3+. Высокое сродство к сере, способность существовать в свободном состоянии и склонность к образованию основных солей определяют важнейшие формы нахождения висмута в природе. На магматическом этапе висмут не концентрируется.
Его накопление связано с постмагматическими процессами гранитоидных магм. Из магматических очагов он выносится в хлоркомплексах (BiCl2+, BiCl0) и гидрооксокомплек-сах (Bi(OH)3, Bi(OH)2J). При экзогенных процессах первичные сульфидные соединения висмута окисляются (образуются оксидные и карбонатные соединения).
При слабом проявлении процессов окисления висмутин и самородный висмут могут образовать россыпи.

Физические свойства
Висмут – это серебристо-серый металл с розоватым оттенком, хрупкий, легкоплавкий, плотность при 20 оС – 9,80 г/см3. Висмут — белый металл с розоватым оттенком. При комнатной температуре Висмут легко раскалывается по плоскостям спайности, в фарфоровой ступке растирается в порошок.
Он обладает диамагнитностью, плохой теплопроводностью, низкой температурой плавления (271,4 оС), высокой температурой кипения (1560 °С) и способностью расширяться в объеме при затвердевании. Удельная магнитная восприимчивость равна -1,35·10-6.
Висмут – самый диамагнитный металл: если его поместить между полюсами обычного магнита, то он, стремясь с одинаковой силой оттолкнуться от обоих полюсов, займет положение на равном от них расстоянии.
Под влиянием магнитного поля электрическое сопротивление висмута увеличивается в большей степени, чем у других металлов; этим его свойством пользуются для измерения индукции сильных магнитных полей (прибор, служащий для этой цели, называется висмутовой спиралью).
После расплавления висмута его электросопротивление падает вдвое, а при охлаждении резко возрастает (например, при понижении температуры от нуля до -180° С сопротивление этого металла увеличивается в 60 раз).
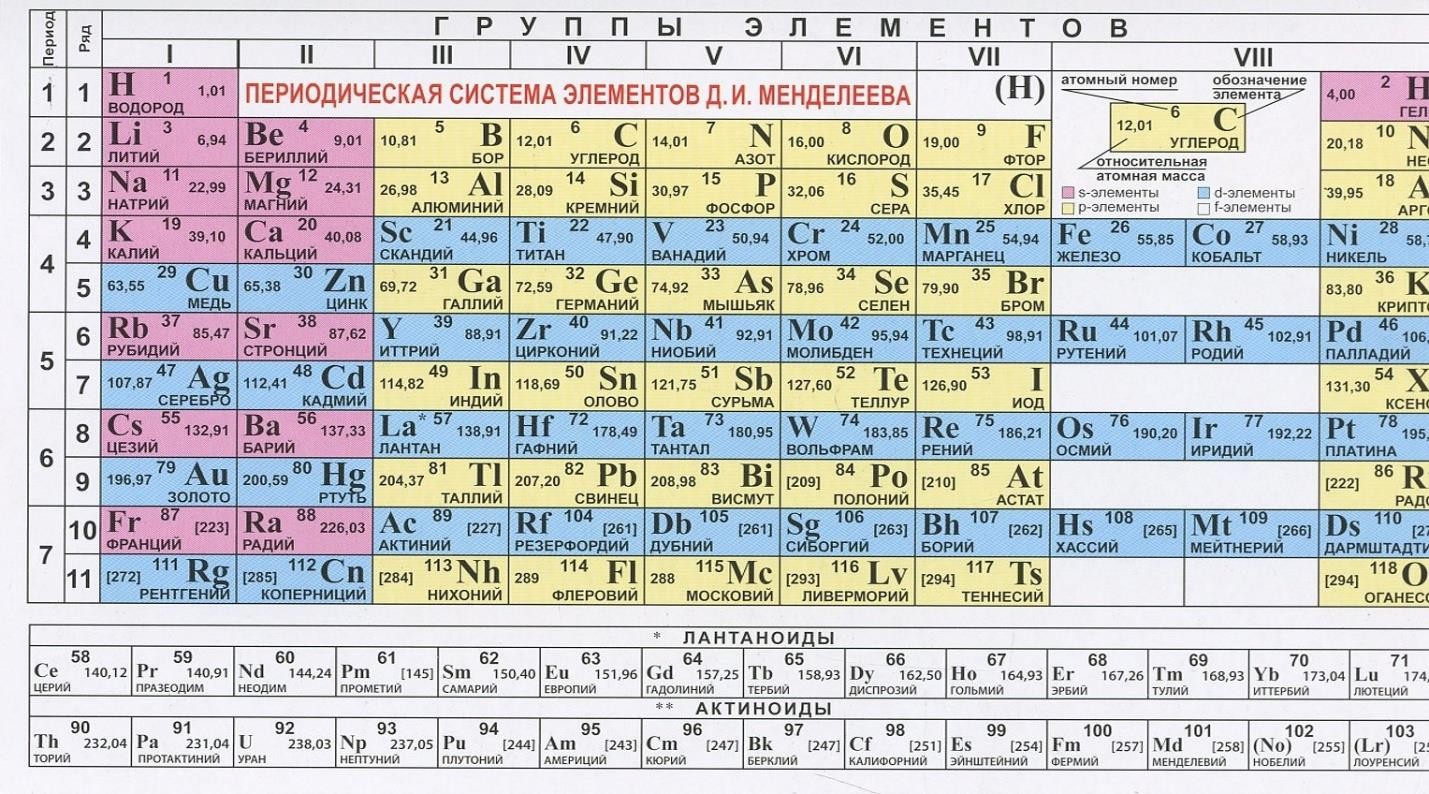
Рис. 1. Диаграмма состояния висмута при высоких давлениях. Пунктирные линии-приблизительные границы областей существования фаз.
Сечение захвата тепловых нейтронов у Висмута мало (34·10-31 м2 или 0,034 барна). Висмут и его соединения обладают дезинфицирующими и антисептическими свойствами. Он устойчив к действию кислорода и воды и растворим в концентрированной серной кислоте.
Висмут имеет ромбоэдрическую решетку с периодом а = 4,7457 Å и углом ά = 57°14'13″.
Удельная теплоемкость (20 °С) 123,5 Дж/(кг·К) [0,0294 кал/(г·°С)]; термический коэффициент линейного расширения при комнатной температуре 13,3·10-6; удельная теплопроводность (20 °С) 8,37 вт/(м·К) [0,020 кал/(см·сек·°С)]; удельное электрическое сопротивление (20° С) 106,8·10-8 ом·м (106,8·10-6ом·см).
При температуре 120-150°С ковок; горячим прессованием (при 240-250°С) из него можно изготовить проволоку диаметром до 0,1 мм, а также пластинки толщиной 0,2-0,3 мм. Твердость по Бринеллю 93 Мн/м2 (9,3 кгс/мм2), по Моосу 2,5. При плавлении Висмут уменьшается в объеме на 3,27%.
Таблица 1. Характеристика некоторых кристаллических модификаций висмута.
Химические свойства
Висмут в сухом воздухе устойчив, во влажном наблюдается его поверхностное окисление. При нагревании выше 1000° С сгорает голубоватым пламенем с образованием оксида Bi2O3.
В ряду напряжений Висмут стоит между водородом и медью, поэтому в разбавленной серной и соляной кислотах не растворяется; растворение в концентрированных серной и азотной кислотах идет с выделением SO2 и соответствующих оксидов азота.
Висмут проявляет валентность 2, 3 и 5. Соединения Висмута низших валентностей имеют основной характер, высших — кислотный. Из кислородных соединений Висмута наибольшее значение имеет оксид Bi2O3, при нагревании меняющий свой желтый цвет на красно-коричневый.
Bi2O3 применяют для получения висмутовых солей. В разбавленных растворах висмутовые соли гидролизуются. Хлорид BiCl3 гидролизуется с выпадением хлороксида BiOCl, нитрат Bi(NO3)3 — с выпадением основной соли BiONО3·BiOOH.
Способность солей Висмут гидролизоваться используется для его очистки.
Соединения 5-валентного Висмута получаются с трудом; они являются сильными окислителями. Соль КВiO3 (соответствующая ангидриду Bi2O5) образуется в виде буро-красного осадка на платиновом аноде при электролизе кипящего раствора смеси КОН, КСl и взвеси Bi2O3.
Висмут легко соединяется с галогенами и серой. При действии кислот на сплав висмута с магнием образуется висмутин (висмутистый водород) BiH3; в отличие от арсина AsH3, висмутин — соединение неустойчивое и в чистом виде (без избытка водорода) не получено.
С некоторыми металлами (свинцом, кадмием, оловом) Висмут образует легкоплавкие эвтектики; с натрием, калием, магнием и кальцием — интерметаллические соединения с температурой плавления, значительно превышающей температуры плавления исходных компонентов.
С расплавами алюминия, хрома и железа висмут не взаимодействует.

Металлические свойства у него выражены посильней, но к этому его просто обязывает положение в таблице элементов: он ближе к «полюсу металличности» (левый нижний угол таблицы), чем другие элементы его подгруппы. В сухом воздухе висмут устойчив, но во влажном он облачается в тончайшее покрывало оксида. Если же металл нагреть выше 1000 °С, он сгорает красивым голубоватым пламенем.
Как известно, при электролизе ионы металла переносятся с анода на катод. Так считали почти полтора столетия — с тех пор как английский ученый Майкл Фарадей установил важнейшие законы электролиза.
Но вот в 1975 году сотрудники Института общей и неорганической химии Академии наук УССР обнаружили, что некоторые металлы при электролитических процессах устремляются к аноду. В опытах украинских ученых катод был изготовлен из висмута, анод — из никеля, а роль электролита выполнял расплавленный едкий натр.
Когда был включен ток, висмутовый катод начал таять на глазах, и уже вскоре на поверхности анода появились блестящие шарики из чистого висмута.

Это открытие не опровергает, а лишь уточняет закон Фарадея. Большинство металлов действительно выделяется на катоде, и лишь некоторые — висмут, свинец, олово, сурьма — «предпочитают» анод, правда, при условии, что электролитом служит расплав солей щелочных и щелочноземельных металлов.
«Поправка к закону» может быть использована для очистки многих металлов и сплавов от примесей висмута, свинца и других «нарушителей порядка».
Для этого металлическую заготовку, которую нужно подвергнуть рафинированию, вводят в электролит в качестве катода.
Начинается электролиз, и ненужные примеси, расставшись с основной массой металла, перебазируются на анод. Этот экономичный способ назван катодной очисткой.
Как известно, все металлы, да и вообще большинство твердых тел, имеют кристаллическую структуру, при которой их атомы (ионы, молекулы) располагаются в пространстве в строго определенном порядке.
В ходе многочисленных опытов удалось установить, что если на переохлажденную металлическую пластинку, находящуюся в камере, где обеспечены указанные условия, нанести пары какого-либо металла, то на пластинке тут же образуется «стеклянная» пленка.
Подобный эксперимент, в частности, был проделан с висмутом. Оказалось, что пленка из висмутового «стекла» толщиной всего в несколько микрон обладает буквально сказочными магнитными и сверхпроводящими свойствами.
Даже при обычной температуре ее сопротивление электрическому току во много раз ниже, чем у того же висмута в кристаллическом состоянии.
Висмут помог советским физикам синтезировать ядра 107-го элемента периодической системы. Помещенная в ускоритель висмутовая мишень подверглась ожесточенной бомбардировке ионами хрома.
Более двух месяцев непрерывно работал ускоритель, сопоставлялись и анализировались результаты десятков тончайших экспериментов, и вот, наконец, можно было с уверенностью заявить, что при слиянии иона хрома с ядром висмута образуются ядра 107-го элемента, период полураспада которых всего около двухтысячных долей секунды.

Получение висмута
Основное количество Висмута добывается попутно при огневом рафинировании чернового свинца (веркблея). Пирометаллургический способ основан на способности Висмута образовывать тугоплавкие интерметаллические соединения с К, Na, Mg и Са.
В расплавленный свинец добавляют указанные металлы и образовавшиеся твердые соединения их с Висмутом (дроссы) отделяют от расплава. Значительное количество Висмута извлекают из шламов электролитического рафинирования свинца в кремнефтористоводородном растворе, а также из пылей и шламов медного производства.
Содержащие Висмут дроссы и шламы сплавляют под щелочными шлаками. Полученный черновой металл содержит примеси As, Sb, Cu, Pb, Zn, Se, Те, Ag и некоторых других элементов. Выплавка Висмута из собственных руд производится в небольшом масштабе. Сульфидные руды перерабатывают осадительной плавкой с железным скрапом.
Из окисленных руд Висмут восстанавливают углем под слоем легкоплавкого флюса.
Для грубой очистки чернового Висмут применяются в зависимости от состава примесей различные методы: зейгерование, окислительное рафинирование под щелочными флюсами, сплавление с серой и другими.
Наиболее трудноотделяемая примесь свинца удаляется (до 0,01%) продуванием через расплавленный металл хлора. Товарный Висмут содержит 99,9-99,98% основного металла.
Висмут высокой чистоты получают зонной перекристаллизацией в кварцевых лодочках в атмосфере инертного газа.
Висмут получают сплавлением сульфида с железом:
- Bi2S3 + 3Fe ——-> 2Bi + 3FeS,
или последовательным проведением процессов:
- 2Bi2S3 + 9O2 ——-> 2Bi2O3 + 6SO2;
- Bi2O3 + 3C ——-> 2Bi + 3CO.

Вообще, висмут — это легкоплавкий металл, который расширяется при затвердевании, поэтому слитки не имеют усадочной раковины, а наоборот, имеют выпуклую поверхность. Применяется висмут, в основном, для изготовления легкоплавких сплавов и припоев.

Чистый, неокисленный висмут имеет серебристо-белый цвет с небольшим красноватым оттенком. Радужная окраска этого кристалла обусловлена наличием тонкой оксидной пленки на его поверхности. При желании, окраску легко удалить. Достаточно просто промыть кристалл разбавленной соляной кислотой, и его поверхность станет серебристой.
Если расплавленный металл залить в форму и дать ему затвердеть, то получится слиток. Но кристаллы висмута получаются немного по-другому.
Получить такие фантастические кристаллы висмута (только висмута! с другим металлом такое не получится!) можно так. Нужен очень чистый висмут. Чем он чище, тем красивее получатся кристаллы. Расплавленный на горелке металл выливается в подогретую ёмкость.
Через некоторое время, когда он примерно на треть затвердеет, жидкий металл сливают, а на дне остаются такие кристаллы.
Такую красивую окраску кристаллы висмута приобретают в результате окисления поверхностного слоя металла, причем чем выше чистота исходного металла, тем более красиво окрашивается кристалл.
Источник: http://samocvet.net/article/vismut-lat-bismuthum
Что такое висмут, его свойства, соединения, получение и применение :
Что такое висмут? Удивительный металл необычной формы и внешности, который еще в Средневековье использовался алхимиками во многих опытах.
Его называли tectum argenti, что переводится, как «производство серебра», ведь люди действительно считали, что этот металл наполовину состоит из него.
Его применяли во многих сферах и даже добавляли в сплавы, из которых делали холодное оружие – так мечи приобретали особый блеск и красоту. Что же представляет собой этот элемент, и какими особенностями он обладает?

Нахождение в природе
Рассказывая о том, что такое висмут, следует отметить, что в земной коре этот элемент содержится в количестве 2х10−5 % по массе, а в морской воде 2х10−5 мг/л.
Также он находится в рудах. В этих полезных ископаемых висмут содержится, как в форме собственных минералов, так и в виде примесей в сульфатных солях и сульфидах других металлов.
Порядка 90 % висмута добывается посредством извлечения его из проходящих обработку медных, оловянных и свинцово-цинковых руд, а также из концентратов. В них обнаруживаются сотые, а порой и десятые доли процента этого вещества.
Крайне редко в природе встречаются висмутовые руды. В них наблюдается высокая концентрация вещества – от 1 % и выше. Состав таких руд включает в себя самородный висмут (образуется в гидротермальных жилах), висмутин (простой сульфид), тетрадимит, козалит, бисмит, бисмутит, виттихенит, айкинит и галеновисмутит.
Месторождения
Висмут – металл, который в высоких концентрациях скапливается, как правило, в горных породах (пегматиты), в средне- и высокотемпературных гидротермальных и в контактово-метасоматических месторождениях.
Как уже говорилось выше, он обычно образует комплексные руды с другими элементами. Они также отличаются, в основном по типу оруденения. В Боливийской провинции, например, распространены сульфидно-касситеритовые месторождения, из которых извлекают этот металл. В Забайкалье — кварц-вольфрамитовые.
В России и за рубежом особенно распространены гидротермальные месторождения. В Средней Азии и Италии – медно-висмутовые. В Германии, США и Канаде – пятиэлементные. В таких месторождениях самородный висмут ассоциируется с арсенидами серебра, кобальта и никеля, а еще с ураном.
Но самое масштабное месторождение данного металла находится в Перу, в городе Серро-де-Паско. Висмут там добывают в больших количествах, извлекая его в процессе переработки свинцовых концентратов.

Процесс получения
В продолжение темы о том, что такое висмут, стоит рассказать, как именно его добывают.
Получение этого металла основано на переработке руды, а также свинцовых и медных концентратов посредством методов, используемых в сферах пиро/гидрометаллургии.
Есть и другой способ, но он используется лишь в случае получения висмута из сульфидных соединений. Процесс подразумевает переработку медных концентратов, сопровождающуюся осадительной плавкой с железным скрапом и флюсом.
Как правило, происходит процесс получения висмута по формуле: Bi2S3 + 3Fe à 2Bi + 3FeS.
В том случае, если используются окисленные руды, то металл восстанавливают углеродом под слоем флюса. Происходит это в температурном режиме от 900 до 1000 °C. Углерод, кстати, может быть заменен сульфитом натрия. С применением данного кристаллогидрата можно восстановить оксид висмута при меньшей температуре (800 °C).
Для получения сульфида данного металла применяют соду или гидроксид натрия. В этих случаях устанавливается температура в 950 и 500-600 градусов соответственно.
Специфика процесса
Отдельно стоит сказать про извлечение висмута из чернового свинца. Данный процесс специфичен тем, что он подразумевает выделение металла при помощи кальция или магния. Висмут при этом, имея вид соединения CaMg2Bi2, накапливается в верхних слоях.
Как в дальнейшем металл очищается от магния или кальция? Посредством его переплавки под щелочным слоем с добавлением окислителя NaNO3. Затем полученное вещество подвергают электролизу с получением шлама (отходные вещества). Этот продукт и переплавляют в черновой висмут.
Важно оговориться, что гидрометаллургический способ получения данного элемента характеризуют более высокие экономические показатели и соответствующая чистота полученного вещества. Этот метод основан на растворении висмутосодержащих руд, сплавов и полупродуктов. Для этого используется соляная и азотная кислоты.
За растворением следует выщелачивание получившейся жидкости. Для осуществления этого процесса используют серную кислоту или растворы хлорида натрия. Это последний этап, затем висмут извлекают и очищают посредством экстракции.
Кстати, еще есть методы двухстадийной перегонки, зонной плавки и гидрометаллургического рафинирования. Их применяют для получения самого чистого висмута.

Модификации металла
Что такое висмут? Визуально это – серебристо-белый металл, переливающийся различными оттенками. Чистый висмут отливает преимущественно розовым. Металл, в котором доминирует какой-либо другой цвет, является аллотропной модификацией.
Их, кстати, немало. Модификации возникают вследствие воздействия высокого давления. Если подвергнуть висмут температуре в +25 °C и давлению в 2,57 ГПа, то кристаллическая решетка этого вещества претерпит полиморфное превращение. Ее форма перестанет быть ромбоэдрической и станет моноклинной.
Также изменения решетки происходит при других показателях давления (5 ГПа, 4,31 ГПа и 2,72 ГПа). А если довести его до уровня в 7,74 ГПа, то она и вовсе приобретет кубическую форму. Тетрагональной решетка становится при давлении в 2,3—5,2 ГПа.
Физические свойства
Висмут – химический элемент, являющийся поистине уникальным. Лишь у немногих веществ при их плавлении наблюдается повышение плотности, и он к ним относится. Когда висмут переходит в жидкое состояние из твердого, данный показатель изменяется с 9,8 г/см3 до 10,07 г/см3.
С ростом температуры увеличивается и удельное электрическое сопротивление этого вещества. При обычных условиях (+17.5 °C), данный показатель составляет 1,2 мкОм·м. При плавлении сопротивление уменьшается. При температуре в 269 °C, когда висмут еще находится в твердом состоянии, оно равно 2,67 мкОм·м. А когда она повышается до 272 °C, то показатель сразу падает до 1,27 мкОм·м.
Если сравнивать висмут с другими металлами, то по свойствам к нему ближе всего будет ртуть. У них обоих низкая теплопроводность, составляющая 7,87 Вт/(м·К) при 300 К.
Магнитные свойства
Конечно же, рассказывая про свойства висмута, нельзя не отметить, что это самый диамагнитный металл из всех существующих. Его магнитная восприимчивость равна 1,34·10−9 при 293 K. И данное качество, при наличии висмута, можно заметить невооруженным взглядом. Если подвесить образец металла на нитку и поднести к нему магнит, то он заметно от него отклонится.

Важнейшие соединения
Их тоже стоит отметить вниманием. Соединений у висмута масса. Но наиболее характерными для него являются те, которые обладают степенью окисления +3 и +5. Вот несколько примеров:
- Оксид висмута (II) BiO. Выглядит как кристаллы серо-черного цвета. Вещество окисляется при температуре в 180 °С, в условиях повышенной влажности. Вступает в реакцию с хлороводородной кислотой, поддается восстановлению монооксидом углерода и водородом.
- Оксид висмута (III) Bi2O3. Представляет собой кристаллы желтого цвета тетрагональной или моноклинной формы. До 1750 °С находятся в твердом состоянии. Плохо растворяются в гидроксидах, аммиаке, ацетоне и в воде, но хорошо в кислотах. Оксид получают, как правило, посредством нагревания висмута в кислороде.
- Гидроксид висмута (III) Bi(OH)3. Выглядит, как аморфный порошок белого цвета. Плохо растворяется в воде и щелочах высокой концентрации, но хорошо в хлориде аммония и глицерине.
- Сульфид висмута (III) Bi2S3. Кристаллы ромбоэдрической формы серо-черного цвета. Имеют ярко выраженные термоэлектрические свойства. Полностью гидролизуются в воде, но не поддаются растворению в минеральных кислотах, сульфидах и прочих жидкостях. Поддается восстановлению кремнием, углеродом и водородом.
- Оксид висмута (V) Bi2O5. Порошок темно-коричневого цвета. При нагревании разлагается, в щелочах и кислотах растворяется. Добывается окислением висмута в щелочных растворах высокой концентрации.
Нитрат висмута
Это – неорганическое соединение с формулой Bi(NO3)3. Оно представляет собой смесь азотной кислоты и соли металла висмута. Выглядят, как бесцветные кристаллы, похожие на соль или сахар. Их можно растворить в воде, вследствие чего нитрат висмута образует кристаллогидрат. Но в подкисленных растворах данное соединение устойчиво.
Интересно, что кристаллогидрат этого вещества способен плавиться при температуре в 75 °С, причем в собственной же кристаллизационной воде.
У него масса химических свойств. Растворенный в воде основной нитрат висмута при кипячении полностью гидролизуется. Происходит сольволиз. Вещество взаимодействует с жидкостью и разлагается с образованием новых соединений. То же самое произойдет, если кристаллогидрат хранить на воздухе.
Стоит отметить, что нитрат может вступать в реакции с холодной концентрированной соляной кислотой, щелочами, фторидами и окислителями (вследствие этого образуются висмутаты).
Применение нитрата
Используют его в нескольких сферах. В фармакологии основной нитрат висмута широко распространен, как эффективный антисептический препарат. Его используют при кожных заболеваниях, а также при недугах желудочно-кишечного тракта.
- Еще нитрат вводят в состав кремов от веснушек, отбеливающих средств для лица, светлые краски для волос и осветлители.
- Кроме перечисленного, пигмент добавляют в испанские и жемчужные белила.

Где используют металл?
Применение висмута в наши дни очень распространено. Данный элемент используют в самых разных сферах.
Висмут ценится за свою легкоплавкость. Его используют при производстве автоматических огнетушителей – делают для них предохранители.
Еще из него изготавливают модели для отливки сложных деталей, поскольку висмут имеет повышенные литейные свойства, и может заполнить мельчайшие детали формы. Им заливают металлографические шлифы, используют в протезировании. Вот еще несколько способов его применения:
- Висмут добавляют к олову, чтобы оно не рассыпалось в порошок при низких температурах. Атомы этого металла будто бы «цементируют» его решетку.
- Из марганцево-висмутового сплава изготавливают постоянные магниты.
- Висмут добавляют в количестве 0.01 % к другим сплавам, что улучшает их пластические свойства.
- Трехокись этого металла используется в производстве полимеров как катализатор.
- С применением висмут-цезий-теллура изготавливают качественный материал, используемый в создании полупроводниковых холодильников.
- В ядерной физике, геологии и томографии применяется германат висмута — сцинтилляционный материал.
- Для получения полония-210 также необходимо добавление этого вещества.
Перечень можно продолжить. Металл используют как химический источник тока, материал для обработки прочных сплавов, применяют его в ядерной энергетике и в изготовлении топливных элементов, в производстве тетрафторгидразина. Сферы многогранны. Это лишний раз подтверждает уникальность обсуждаемого вещества.

Сфера медицины
Выше уже было сказано, что в некоторые лечебные препараты висмут, а точнее, его нитрат, активно добавляется. Но на этом его применение в медицине не заканчивается.
Соли висмута – одно из немногих активных веществ, которое может уничтожить бактерии Helicobacter Pylori, провоцирующие язвенную болезнь. Это было установлено недавно. Но уже сейчас добавляется во многие препараты висмут. А точнее, его субнитрат, трикалия дицитрат и ранитидина висмута цитрат.
Также доказано, что применение медикаментов с содержанием данного вещества снижает токсический эффект от химиотерапии. А на основе висмутовых соединений (трибромфенолят, субцитрат, карбонат, тартрат и т. д.) разработана масса медицинских препаратов.
Кстати, оксохлорид висмута активно применяется как рентгеноконтрастное средство и как наполнитель при изготовлении кровеносных сосудов.
Источник: https://www.syl.ru/article/365281/chto-takoe-vismut-ego-svoystva-soedineniya-poluchenie-i-primenenie
Висмут
ВИСМУТ, Bi (лат. bismuthum * а. bismuth; н. Wismut; ф. bismuth; и. bismuto), — химический элемент V группы периодической системы Менделеева, атомный номер 83, атомная масса 208,980.
Свойства висмута
Природный висмут состоит из одного стабильного изотопа 209Bi; из радиоактивных — важнейший — 210Bi. С глубокой древности считался разновидностью сурьмы, свинца или олова. Представление о висмуте как о самостоятельном химическом элементе сложилось лишь в 18 в., после того как в 1739 немецким химиком И. Поттом была установлена его химическая индивидуальность.
Висмут — серебристо-серый металл с розоватым оттенком. Имеет ромбоэдрическую решётку с периодом а = 47,364 нм (4,7364 Е) и углом а = 57°14'13''. Плотность 9800 кг/м3, t плавления 271,3°С, t кипения 1564° С.
При плавлении уменьшается в объёме на 3,27% (плотность жидкого висмута 10 060 кг/м3). При комнатной температуре хрупок, при t 120-150°С ковок. Твёрдость по Бринеллю 93 МПа, по Moocy 2,5.
Наименее теплопроводный удельная теплопроводность при 20°С 8,37 Вт/(м•К) и наиболее диамагнитный металл (удельная магнитная восприимчивость 1,35 • 10-6).
На воздухе висмут слабо окисляется. В своей подгруппе обладает наиболее ярко выраженными основными свойствами; степень окисления +2, +3, +5, а также -3, +4, +1. Высшую степень окисления +5 висмут проявляет лишь в щелочной среде при действии сильных окислителей; в природе единственное окисленное состояние висмута +3.
Кристаллохимически близок к Pb2+, Sb3+, Te2-. Обладает большим сродством к электрону (окислительно-восстановительный потенциал Bi3+/Bi0 = +0,226). В природе для Висмута характерны соединения с S, Se и Te. Как и сульфид, Bi2О3 легко растворим в кислотах и очень мало в концентрированных щелочах.
Растворимые соли висмута токсичны.
Висмут в природе
Содержание висмута в земной коре 1,7 • 10-5% по массе. При сравнительно небольшой распространённости он проявляет ярко выраженную способность к образованию собственных минералов в эндогенных и гипергенных процессах. Известно свыше 100 минералов висмута.
Основное промышленное значение имеют самородный висмут, висмутин и сульфосоли висмута. В зоне гипергенеза эти минералы переходят в труднорастворимые гидроокиси и основные карбонаты висмута. Основная форма присутствия висмута в изверженных породах — собственная акцессорная минерализация.
Наиболее значительные концентрации висмута отмечены в кислых породах. Относительно обогащены висмутом продукты поздних фаз кристаллизации магмы. Собственно висмутовые месторождения редки и обычно невелики по масштабам.
Сопутствующая висмутовая минерализация проявлена в рудах практически всех высоко- и среднетемпературных месторождений W, Sn, Mo, Cu, Pb, Au, Co. Основные типы месторождений и схемы обогащения см. в ст. Висмутовые руды.
Получение и применение висмута
В зависимости от состава примесей в черновом висмуте, извлечённом из концентратов, чистый висмут получают различными методами: окислительное рафинирование под щелочными флюсами, зейгерование, сплавление с серой и др. Товарный висмут содержит почти 100% основного металла. Висмут высокой чистоты получают зонной перекристаллизацией в атмосфере инертного газа.
Висмут применяется в металлургии (получение легкоплавких сплавов со свинцом, оловом, кадмием; при изготовлении форм для точного литья, штампов, разметочных, монтажных и контрольных приспособлений; для улучшения обрабатываемости сплавов алюминия, чугуна и стали при производстве авиа- и автодвигателей). Значительное количество висмута потребляется фармацевтической промышленностью (висмут и его препараты — обеззараживающее и подсушивающее средство). В химической промышленности висмут — катализатор при производстве синтетических волокон. Висмут применяется также в атомной энергетике (висмут — жидкий теплоноситель и охлаждающий агент), электронике (полупроводники на основе висмута), стекольной (соединения висмута увеличивают коэффициент преломления) и керамической (легкоплавкие эмали) промышленности.
Источник: http://www.mining-enc.ru/v/vismut/





