Химия довольно интересный предмет, который изучает химические элементы и их свойства. Одним из таких уникальных элементов является калий, который таит в себе множество тайн и загадок. Не каждый из нас знает, что сталкивается с ним каждый день. 
Калий — это химический элемент системы элементов, придуманной Дмитрием Менделеевым, который находится в первой группе. Он имеет атомный номер 19 и атомную массу равную 39,098 г/моль.По своим физическим свойствам элемент представляет из себя металл серебристо-белого цвета. Он очень пластичный и плавкий. Имеет характерный металлический блеск. Калий легко режется ножом и по твердости не уступает куску твердого сыра.Калий состоит из трех изотопов: 39К, 41К, 40К. Два первых соединения являются стабильными, а третий считается достаточно слабым, но при всем этом радиоактивным. Период полураспада последнего соединения составляет 1,32*109 лет.
Химический элемент в химии обозначают «К».

Химический элемент располагается в четвертом периоде, поэтому все его электроны будут расположены на четырех энергетических уровнях. Энергетическая формула элемента выглядит следующим образом: +19К: 2ё; 8ё; 8ё; 1ё.Графическая формула элемента выглядит соответствующим образом.

Исходя из электронного строения элемента, можно сделать вывод, что калий имеет валентность равную I. Так как в химических реакциях элемент отдает один электрон с внешнего энергетического уровня, он проявляет восстановительные свойства, приобретая степень окисления +1.
Благодаря своему расположению в таблице Менделеева, можно сказать, что восстанавливающие свойства калия выражены гораздо сильнее, чем у Na, но слабее, чем у Rb. Такая закономерность связана с увеличением атомного диаметра. Кроме этого, калий будет сильнее, чем атом кальция, так как на внешнем энергетическом уровне у кальция уже два электрона и оторвать их гораздо сложнее, чем один.
Калий по своей химической структуре является простым веществом с металлической кристаллической решеткой и металлической химической связью. Исходя их этого, можно сказать, что калий легко вступает в реакцию и очень быстро окисляется на воздухе.
Как уже было сказано, калий очень активный элемент, поэтому очень легко вступает в реакцию с окружающеми его веществами. Если оставить кусок калия на воздухе, он мновенно вступит в реакцию с воздухом.Элемент прекрасно реагирует с кислородом, азотом, фосфором и галогенами.
Реакция окисления
Взаимодействие любых элементов с кислородом (О2) называется окислением. В результате реакции образуется оксид калия (II). В результате процесса образуется промежуточное соединение оксиген калия.

Горение
Если поджечь калий или его соединения, можно наблюдать фиолетовый цвет пламени у горелки или лучины. Благодаря этому, такая реакция является качественной на определение калия.
Реакция галогенирования
Исходя из того, с каким из элементов вступает в реакцию калий, реакции были названы: йодирование, фторирование, хлорирование и бромирование. Эти реакции являются реакциями присоединения, так как в результате образуется одно соединение. Соответственно, результатом химической реакции будут хлориды, бромиды, йодиды и фториды.
Реакция с азотом и фосфором
Калий реагирует с N2 на открытом воздухе. В результате горения образуется нитрид калия, который представляет собой соединение темно-зеленого цвета.
По такой же схеме калий взаимодействует с фосфором.
Реакция с водородомВ качестве еще одного примера реакции присоединения можно привести реакцию калия с водородом. В результате химического взаимодействия образуется гидрид калия.
Калий способен реагировать с кислотами, солями, основаниями и оксидами. С каждым из перечисленных соединений калий вступает в реакцию по разному.
Реакция с водой
Если поместить кусочек калия в воду можно отметить бурную химическую реакцию. Калий, в буквальном смысле слова, будет провоцировать процесс кипения. В результате реакции образуется щелочь и чистый водород.

Реакция с кислотой
Взаимодействие с кислотами в данном случае можно назвать реакцией замещения, так как калий замещает атомы гидрогена из их соединений. В качестве примера можно привести реакцию калия с соляной кислотой. По такому же принципу калий реагирует с другими неорганическими кислотами.
Реакция с оксидами
Эта реакция относится к реакции обмена. Если металл в составе оксида оказывается слабее, чем калий, то элемент вытесняет его из соединения, присоединяя кислород.
Реакция с основаниями
Реакция с основаниями происходит по тому же принципу, что и взаимодействие с оксидами. Калий способен реагировать с соединениями, в которых элемент слабее, чем он сам. В результате данной реакции барий выпадает в осадок.

Реакция с солями
Химическая реакция с солями позволяет получать чистые металлы без примесей. Калий как сильный восстановитель вытесняет более слабый металл, присоединяя остаток соли к себе.
Характерной реакцией взаимодействия калия с такими соединениями является реакция с жирами. Калий вытесняет один из атомов гидрогена, образуя стеарат, пальмитат или другое соединение и водород.
Как и любой металл, калий очень востребован в промышленной индустрии. Благодаря своим сильным восстановительным свойствам и высокой реактивности его используют в следующих сферах:
- в качестве реагента в химической промышленности;
- сплавы с большим содержанием элемента используют для разработки ядерных реакторов;
- цианид калия используют на рудниках. Там он используется в качестве химического реактива для вытеснения драгоценных металлов из руды.
- является основой для производства удобрений;
- средняя соль калия и угольной кислоты используется в производстве стекла. Его активно используют для выдувания хрусталя, и производства высокоточной оптики.
- калий является одной из составляющих чистящих веществ и стиральных средств;
- хлорат калия используют для изготовления спичек;
- калия хлорид используется в пищевой промышленности в качестве эмульгатора;
- стеарат данного элемента применяется в мыловарении. Он является основой для изготовления жидкого мыла.

Как уже было сказано, калий постоянно находится в непосредственной близости от человека. Будь то мыло, соль или обычный стиральный порошок. Однако, надо сказать, что калий играет незаменимую роль не только в жизни человека, но в нормальном функционировании его организма.
Калий принимает участие в передаче между нейронами импульса, тем самым регулируя нервную проводимость клеток. Совместно с ионами Na, данный элемент периодической системы регулирует водно-солевой обмен всех биологических жидкостей человека.
Гипокалиемия очень быстро дает о себе знать. Характерными симптомами дефицита калия являются:
- избыточная отечность;
- повышенная раздражительность;
- нарушение памяти;
- заторможенность реакций;
- повышает вероятность возникновения инфарктов и инсультов.
Однако, не только недостаток калия может спровоцировать негативные последствия для организма. Его избыток также губительно действует на человека. На фоне высокой концентрации калия в организме может развиваться эрозии на стенках тонкого кишечника.
Для того, чтобы контролировать уровень калия в своем организме, необходимо знать, в каких продуктах он содержится в больших количествах. К ним можно отнести:
- орехи (кедровые орехи, лесные, фундук, кешью);
- морская капуста;
- фрукты (мандарины, сладкие яблоки, дыни, арбузы, бананы)
- гречневая и перловая крупа;
- картофель;
- лук и чеснок.
- куриные яйца;
- молочные продукты (молоко, сыр, сливки, сметана).

Суточная норма потребления калия составляет 3-5 грамм для взрослого человека.
Источник: https://www.kakprosto.ru/kak-968690-harakteristika-i-stroenie-kaliya
Калий, свойства атома, химические и физические свойства
![]()
![]()
![]()
![]()
K 19 Калий
39,0983(1) 1s2 2s2 2p6 3s2 3p6 4s1
Калий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 19. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), четвертом периоде периодической системы.
Атом и молекула калия. Формула калия. Строение калия
- Изотопы и модификации калия
- Свойства калия (таблица): температура, плотность, давление и пр.
- Физические свойства калия
Химические свойства калия. Взаимодействие калия. Реакции с калием
Получение калия
Применение калия
Таблица химических элементов Д.И. Менделеева
Атом и молекула калия. Формула калия. Строение калия:
Калий (лат. Kalium, от араб. аль-кали – «поташ») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением K и атомным номером 19. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), четвертом периоде периодической системы.
Калий – металл. Относится к группе щелочных металлов.
- Как простое вещество калий при нормальных условиях представляет собой мягкий щелочной металл серебристо-белого цвета.
- Молекула калия одноатомна.
- Химическая формула калия K.
Электронная конфигурация атома калия 1s2 2s2 2p6 3s2 3p6 4s1. Потенциал ионизации атома калия равен 4,34 эВ (418,5 кДж/моль).
Строение атома калия. Атом калия состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 19 электронов. При этом 18 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку калий расположен в четвертом периоде, оболочек всего четыре.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома калия – на 4s-орбитали находится один неспаренный электрон. В свою очередь ядро атома калия состоит из 19 протонов и 20 нейтронов.
Калий относится к элементам s-семейства.
Радиус атома калия составляет 235 пм.
Атомная масса атома калия составляет 39,0983(1) а. е. м.
Калий – седьмой по распространённости элемент в земной коре. Содержание его в земной коре составляет 1,5 %, в океанах и морях – 0,042 %.
Калий очень легко вступает в химические реакции.
Изотопы и модификации калия:
Свойства калия (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Калий/ Kalium |
| Символ | K |
| Номер в таблице | 19 |
| Тип | Металл |
| Открыт | Хемфри Дэви, Англия, 1807 г. |
| Внешний вид и пр. | Серебристо-белый мягкий металл |
| Содержание в земной коре | 1,5 % |
| Содержание в океане | 0,042 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,0983(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Степени окисления | 0, +1 |
| Валентность | +1 |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 418,5 кДж/моль (4,34 эВ) |
| Электродный потенциал | -2,92 В |
| Физические свойства | |
| Плотность (при нормальных условиях) | 0,856 г/см3 |
| Температура плавления | 63,5 °C (336,7 K) |
| Температура кипения | 759 °C (1032 K) |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 26,6 Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Теплопроводность (при 300 K) | 79,0 Вт/(м·К) |
| Электропроводность в твердой фазе | 14х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 0,4 по шкале Мооса |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Конденсат Бозе-Эйнштейна | 39K, 41K |
Физические свойства калия:
Химические свойства калия. Взаимодействие калия. Реакции с калием:
Получение калия:
Применение калия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- калий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле калия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/kaliy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Характеристика химического элемента КАЛИЯ
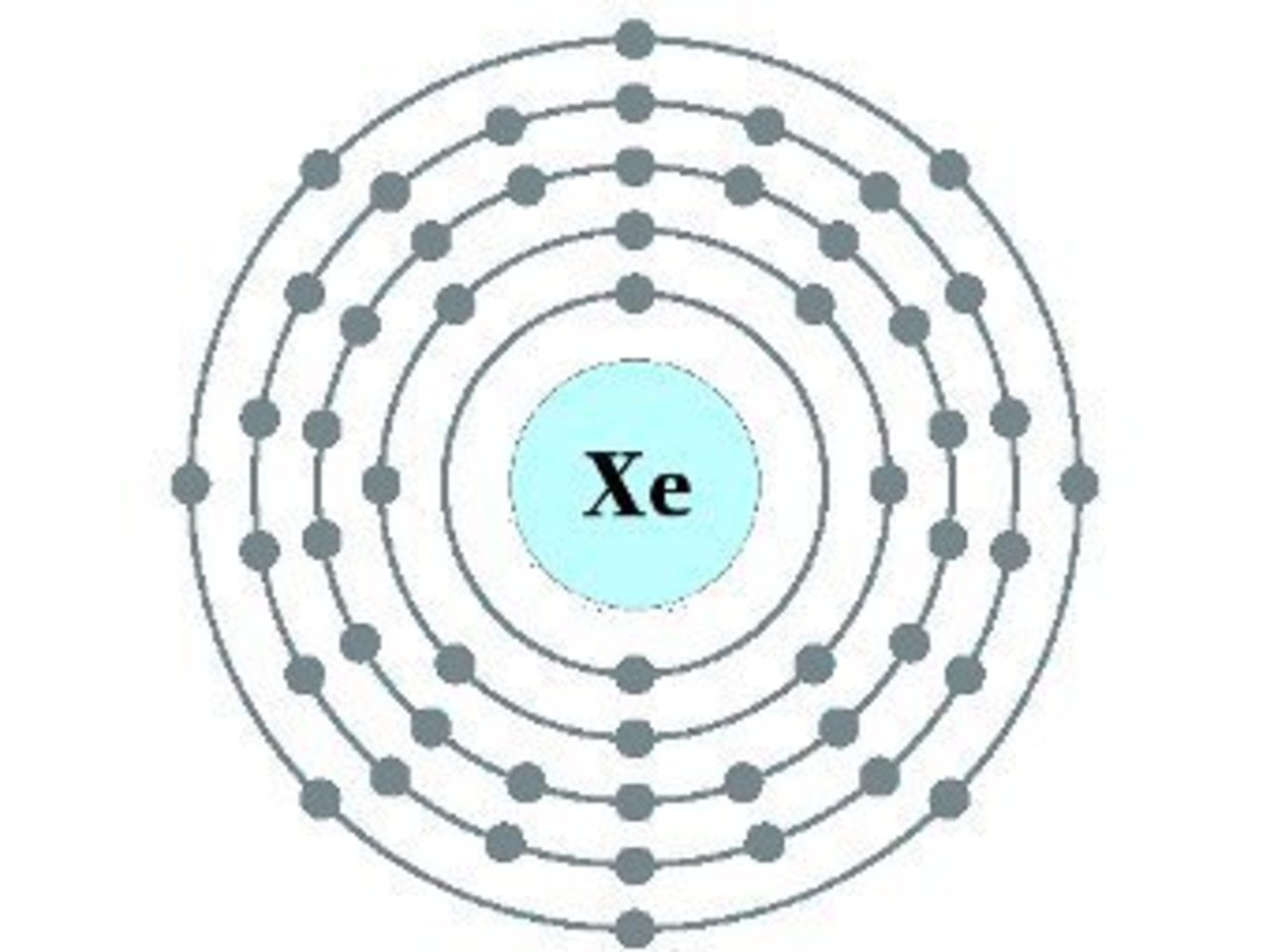
Калий — обозначается символом K — химический элемент I группы периодической системы Менделеева;
- атомный номер 19,
- атомная масса 39,098;
Калий — серебристо-белый, очень легкий, мягкий и легкоплавкий металл.
Элемент состоит из двух стабильных изотопов — 39K (93,08%), 41K (6,91%) и одного слабо радиоактивного 40K (0,01%) с периодом полураспада 1,32·109 лет.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так: +19К: 2ё; 8ё; 8ё; 1ё.
Исходя из строения атома, можно предсказать степень окислени С1 калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.

- Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Nа к Rb.
- Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
- К2O + 2НСl = 2КСl +H2O;
- К2O +SO3 = К2SO4
- В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
- КОН+НNОз = КNO3+Н2O;
- 2КОН+H2O5 = 2KNO3+Н2O.
- Летучего водородного соединения калий не образует, а образует гидрид калия КН
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
Источник: https://kratkoe.com/harakteristika-himicheskogo-elementa-kaliya/
Свойства калия
Калием называется элемент, находящийся в периодической системе Менделеева под 19-ым номером. Вещество принято обозначать заглавной буквой К (от латинского Kalium). В русской химической номенклатуре настоящее название элемента появилось благодаря Г.И. Гессу в 1831 году.
Изначально калий называли «аль-кали», что в переводе с арабского означает «зола растений». Именно едкий кали стал материалом для самого первого получения вещества. Едкий кали, в свою очередь, добывался из поташа, который являлся продуктами горения растений (карбонат калия). Его первооткрывателем стал Х.
Дэви. Стоит отметить, что карбонат калия является прототипом современного моющего средства. Позже он использовался для удобрений, используемых в сельском хозяйстве, в производстве стекла и других целей.
В настоящее поташ – это пищевая добавка, прошедшая официальную регистрацию, а калий научились добывать совершенно другими путями.
В природе калий можно обнаружить только в виде соединений с другими элементами (например, морская вода, или минералы), свободный его вид не встречается вообще. Он способен в достаточно короткий промежуток времени окисляться на открытом воздухе, а также вступать в химические реакции (например, при взаимодействии калия с водой, образуется щелочь).
| 1 | 2 | 3 | 4 | 5 |
| Россия | 19118 | 3658 | 31,4 | 17,8 |
| Европа | 3296 | 2178 | 18,5 | — |
| Беларусь | 1568 | 1073 | 9,1 | 16 |
| Великобритания | 30 | 23 | 0,2 | 14 |
| Германия | 1200 | 730 | 6,2 | 14 |
| Испания | 40 | 20 | 0,2 | 13 |
| Италия | 40 | 20 | 0,2 | 11 |
| Польша | 10 | 10 | 0,1 | 12 |
| Украина | 375 | 292 | 2,5 | 11 |
| Франция | 33 | 10 | 0,1 | 15 |
| Азия | 2780 | 1263 | 10,8 | – |
| Израиль | 600 | 44 | 0,4 | 1,4 |
| Иордания | 600 | 44 | 0,4 | 1,4 |
| Казахстан | 102 | 54 | 0,5 | 8 |
| Китай | 320 | 320 | 2,7 | 12 |
| Таиланд | 150 | 75 | 0,6 | 2,5 |
| Туркменистан | 850 | 633 | 5,4 | 11 |
| Узбекистан | 159 | 94 | 0,8 | 12 |
| Африка | 179 | 71 | 0,6 | – |
| Конго | 40 | 10 | 0,1 | 15 |
| Тунис | 34 | 19 | 0,2 | 1,5 |
| Эфиопия | 105 | 42 | >0,4 | 25 |
| Америка | 14915 | 4548 | 38,7 | — |
| Аргентина | 20 | 15 | 0,1 | 12 |
| Бразилия | 160 | 50 | 0,4 | 15 |
| Канада | 14500 | 4400 | 37,5 | 23 |
| Мексика | 10 | — | 12 | |
| США | 175 | 73 | 0,6 | 12 |
| Чили | 50 | 10 | 0,1 | 3 |
| Итого: | 40288 | 11744 | 100 | — |
Описание калия
Калий в виде простого вещества представляет собой щелочной металл. Для него характерен серебристо-белый окрас. На свежей поверхности моментально появляется блеск. Калий является мягким металлом, легко поддающимся плавлению. Если вещество или его соединения поместить в пламя горелки, то огонь приобретет розово-фиолетовый цвет.

Физические свойства калия
Калий очень мягкий металл, который легко разрезать обычным ножом. Его твердость по Бринеллю составляет 400 кн/м2 (или 0,04 кгс/мм2). Он имеет объемноцентрированную кубическую кристаллическую решетку (5=5,33 А). Его плотность составляет 0,862 г/см3 (200С). Вещество начинает плавиться при температуре в 63,550С, закипать – при 7600С.
Имеет коэффициент термического расширения, который равняется 8,33*10-5 (0-500С). Его удельная теплоемкость при температуре в 200С составляет 741,2 дж/(кг*К) или же 0,177 кал/(г*0С). При той же температуре имеет удельное электросопротивление, равное 7,118*10-8ом*м. Температурный коэффициент электросопротивления металла составляет 5,8*10-15.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Калий является щелочным металлом. В связи с этим, металлические свойства калия проявляются типично, так же, как и других подобных металлов.
Элемент проявляет свою сильную химическую активность, а кроме этого, также выступает в роли сильного восстановителя Как уже говорилось выше, металл активно вступает в реакцию с воздухом, о чем свидетельствует появление пленок на его поверхности, в результате чего его цвет становится тусклым.
Данную реакцию можно наблюдать невооруженным глазом. Если калий на протяжении достаточно длительного времени контактирует с атмосферой, то есть вероятность его полного разрушения. При вступлении в реакцию с водой, происходит характерный взрыв.
Это связано с выделяющимся водородом, который воспламеняется характерным розовато-фиолетовым пламенем. А при добавлении в воду, реагирующую с калием фенолфталеина, она приобретает малиновый цвет, который свидетельствует о щелочной реакции образующегося гидроксида калия (КОН).
При взаимодействии металла с такими элементами, как Na, Tl, Sn, Pb, Bi, образуются интерметаллиды
Указанные характеристики калия говорят о необходимости соблюдений определенных правил безопасности и условий во время хранения вещества. Так, вещество следует покрывать слоем бензина, керосина или силикона. Это делается для полного исключения его контакта с воздухом или водой.
Стоит отметить, что в условиях комнатной температуры металл вступает в реакцию с галогенами. Если его немного нагреть, то он легко взаимодействует с серой. В случае же увеличения температуры, калий способен соединяться с селеном и теллуром.
Если повысить температуру более 2000С в атмосфере водорода, то образуется гидрид КН, который способен воспламеняться без посторонней помощи, т.е. самостоятельно.
Калий совершенно не взаимодействует с азотом, даже если для этого создать надлежащие условия (повышенные температуру и давление). Однако, контактировать эти два вещества можно заставить, повлияв на них электрическим разрядом.
В данном случае получится азид калия KN3 и нитрид калия K3N. Если нагреть вместе графит и калий, то в результате получатся карбиды KC8 (при 300 °С) и KC16 (при 360 °C).
При взаимодействии калия и спиртов получаются алкоголяты. Кроме этого, калий делает существенно быстрее процесс полимеризации олефинов и диолефинов. Галогеналкилы и галогенарилы вместе с девятнадцатым элементом в результате дают калийалкилы и калийарилы.
| Свойства атома | |
| Название, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 0; +1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 336,8К; 63,65 °C |
| Температура кипения | 1047К; 773,85 °C |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | Кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
Электронное строение атома калия
Калий имеет положительно заряженное ядро атома (+19). В середине этого атома присутствуют 19 протонов и 19 нейтронов, которые окружаются четырьмя орбитами, где в постоянном движении находятся 19 электронов. Электроны распределены на орбиталях в следующем порядке:
1s22s22p63s23p64s1.
На внешнем энергетическом уровне атома металла находится всего 1 валентный электрон. Это объясняет тот факт, что абсолютно во всех соединениях калий имеет валентность 1.
В отличие от лития и натрия, данный электрон располагается на более удаленном расстоянии от ядра атома. Это является причиной повышенной химической активностью калия, чего нельзя сказать об упомянутых двух металлах.
Таким образом, внешняя электронная оболочка калия представлена следующей конфигурацией:
4s1.
Не смотря на присутствие вакантных 3p— и 3d-орбиталей, возбужденное состояние отсутствует.
Источник: http://mining-prom.ru/gorn/kaliy/svoystva-kaliya/
Строение электронных оболочек атомов
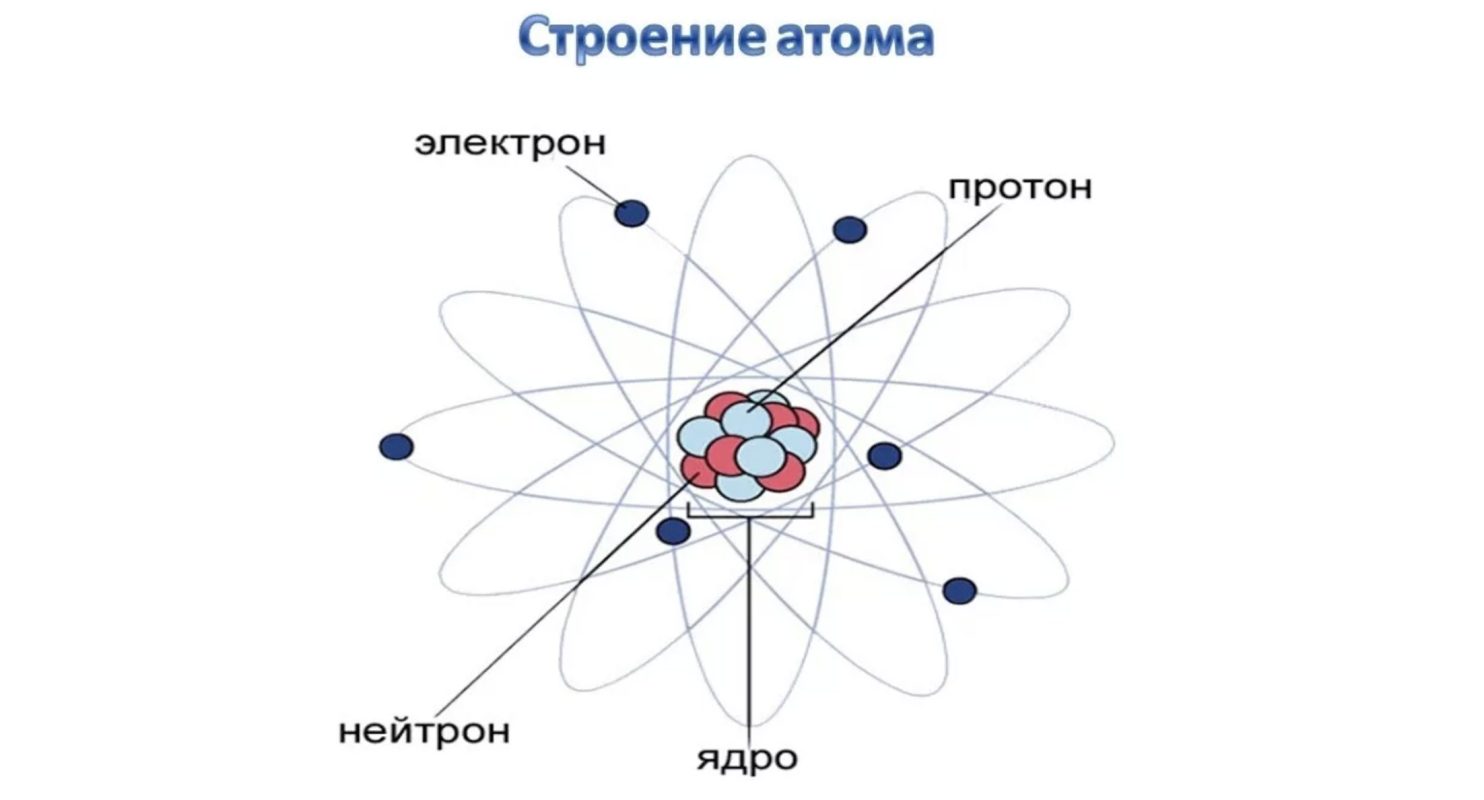
Атом – мельчайшая частица вещества, состоящая из ядра и электронов. Строение электронных оболочек атомов определяется положением элемента в Периодической системе химических элементов Д. И. Менделеева.

Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Рис. 1. Атом.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
Рис. 2. Формы электронных орбиталей.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем.
Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома.
Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов.
Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе.
Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
Рис. 3. Схема строения электронной оболочки атома.
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
Средняя оценка: 4.7. Всего получено оценок: 660.
Источник: https://obrazovaka.ru/himiya/stroenie-elektronnyh-obolochek-atomov-tablica-8-klass.html
ПОИСК
Двухатомные молекулы из разных атомов 532 Фтороводород и фторид калия 532 Дипольные моменты 536 Электронное строение двухатомных молекул общего вида АВ 537 [c.651]
Причина такой последовательности заполнения электронных энергетических подуровней заключается в следующем.
Как уже указывалось, энергия электрона в многоэлектронном атоме определяется значениями не только главного, но и орбитального квантового числа. Так же была указана последовательность расположения энергетических подуровней, отвечающая возрастанию энергии электрона (табл. 2.3). Как показывает табл. 2.
3, подуровень 4з характеризуется более низкой энергией, чем подуровень 3 , что связано с более сильным экранированием -электронов в сравнении с з-электронами. В соответствии с этим размещение внешних электронов в атомах калия и кальция на 4в-подуровне соответствует наиболее устойчивому состоянию этих атомов.
Электронное строение атомов калия и кальция соответствует правилу Клечковского. Действительно, для З -орбиталей (п = 3, / = 2) сумма (п + I) равна 5, а для 45-орбитали (п = 4, / = 0) — равна 4. Следовательно, 4з-подуровень должен заполняться раньше, чем подуровень 3 , что в действительности и происходит.
[c.67]
Электронное строение атомов калия и кальция соответствует этому правилу. Действительно, для З -орбиталей (л = 3, / = 2) р мма (/г + 1) равна 5, а для 45-орбитали (п == 4, / = 0)— равна [c.93]
Продолжим рассмотрение электронного строения атомов. Мы остановились на атоме аргона, у которого целиком заполнены о5- и Зр-подуровни, но остаются незанятыми все орбитали Зй-под-уровня.
Одиако у следующих за аргоном элементов — калия (2=19) и кальция (2 = 20) — заполнение третьего электронного слоя временно прекращается и начинает формироваться -подуровень четвертого слоя электронное строение атома ка- [c.88]
Электронное строение атомов калия и кальция соответствует этому правилу. Действительно, для З -орбиталей (п = 3, 1 — 2) сумма [п- -1) равна 5, а для 45-орбитали (п = 4, / = 0)—равна 4. Следовательно, 45-подуровень должен заполняться раньше, чем подуровень Зй, что в действительности и происходит. [c.89]
Продолжим рассмотрение электронного строения атомов. Мы остановились на атоме аргона, у которого целиком заполнены 3 -и Зр-подуровни, но остаются незанятыми все орбитали Зй-под-уровня.
Однако у следующих за аргоном элементов — калия (7 = 19) и кальция (2 = 20)—заполнение третьего электронного слоя временно прекращается и начинает формироваться -подуровень четвертого слоя электронное строение атома калия выражается формулой 15 25 2р 3 2 3р 45, атома кальция— 152 25 2р 3 2 3р 452 и следующими схемами [c.89]
Сейчас построим электронные конфигурации атомов от натрия до кальция включительно. Заметим, что в каждом случае расположение внутренних электронов совпадает с конфигурацией неона, поэтому для краткости будем обозначать его как (Ке). Тогда получаем натрий, (Ые)35 магний, (Ке)35 алюминий, (Ые)35 3р ,. ..
и так вплоть до аргона, (Ме)35 3р . Внутренние электроны калия и кальция расположены так же, как в аргоне, и их конфигурации имеют вид (Аг)45 и (Аг)45 соответственно.
Теперь ясно просматривается связь между химическим сходством различных элементов, прекрасно выраженным Менделеевым в Периодической системе, и сходством их электронного строения.
В частности, можно заметить, что щелочные металлы имеют один неспаренный электрон на внешней 5-орбитали, а щелочноземельные металлы — два электрона на внешней 5-орбитали. В то же время для благородных газов характерно полное заполнение орбиталей 5- и р-типа. [c.54]
Относительно электронного строения графита имеются две основные точки зрения. Согласно одной из них, четвертый валентный электрон кал[c.15]
При п = 3 впервые становятся возможными (/-состояния при которых 1 = 2. Можно было бы считать, что после 3/7-состояний ближайшими состояниями с наиболее низким уровнем энергии должны быть З -состояния.
Однако -электроны проникают ва внутренние оболочки значительно сильнее, чем -электроны, и понижение энергии при этом более чем уравновешивает увеличение энергии, обусловленное переходом от п = 3 к п = 4, вследствие чего 45-уровни имеют меньшую энергию, чем З -уровни.
Поэтому калий имеет строение — 15 25 2р 35 3/> 45 , а кальций — 15 25 2р 3 3р 452. Энергия Зс -уровней меньше, чем 4/г-уровней, и поэтому 3[c.99]
Калий. Больший ионный радиус К» в сравнении с Na» обусловливает более низкие значения энергии гидратации ионов калия. Такие относительно небольшие различия в электронном строении вызывают существенные различия в биологических свойствах данных ионов. В отличие от ионов Na+ ионы К» в основном сосредоточены во внутриклеточных жидкостях, причем в большинстве случаев калий является антагонистом натрия. [c.182]
Энергетический уровень 45 лежит ниже, чем уровень 2>й, который должен был бы заполняться у элемента, следующего за аргоном. Атом калия имеет строение К 1522522р 3523р 45.
Аналогичные сдвиги уровней наблюдаются и в других местах системы Менделеева. Поэтому образуются последовательности элементов со сходными внешними электронными оболочками и недостроенными внутренними.
[c.79]
IV период начинается калием (2=19), электронное строение которого выражается формулой 15 25 2р 35 3рЧ51. Его 19-й электрон занял 45-подуровень, энергия которого ниже энергии З -подуровня (см. рис. 2.3). Внешний 45-электрон придает элементу свойства, сходные со свойствами натрия.
У кальция (2==20) 45-подуровень заполнен двумя электронами ]5 25 2р 3523рЧ5 С элемента скандия (2=21) начинается заполнение 3 -подуровня, так как он энергетически более выгоден, чем 4р-подуровень (см. рис. 2.3).
Пять орбиталей З -под-уровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (2=30). Поэтому электронное строение 8с соответствует формуле 15 25 2р 35 3р 3 45 , а цинка — ls 2s22p 35 3p 3ii 4s .
В атомах последующих элементов вплоть до инертного газа криптона (2=36) идет заполнение 4р-подуровня. В IV периоде 18 элементов. [c.51]
Региение. Молекула комплексного соединения К(КНз)4 образована нейтральным атомом калия и молекулами аммиака. Электронно-графическая формула атома калия и электронное строение молекул аммиака имеют следующий вид [c.86]
В исследовании, опубликованном одновременно с английским изданием этой книги, было экспериментально показано, что способность окислов проводить каталитическую дегидратацию или дегидрогенизацию, в согласии с мультиплетной теорией,зависит от энергии связей атомов Н, С и О реагирующих молекул с катализатором К.
У окислов А1, W, Мо, катализирующих дегидратацию сниртов, энергия связи Н — К лежит в пределах 38—50 ккал. Эта величина меньше, чем для окислов смешанно-дегидратирующего и дегидрирующего действия (окиси Се, Т1, Хт, Сг), у которых энергия связи Н — ЛГ составляет 55— 65 ккал.
Наоборот, энергия связи С — К у первой группы окислов катализаторов выше (22—33 кал), чем у второй группы (9—12 ккал). [А. А. Толстопятова и А. А. Баландин. Сб. Проблемы кинетики и катализа . Изд. АН СССР, 10, 351, 1960]. Энергии связей, в свою очередь, конечно, зависят от электронного строения вещества. (Прим.
ред. перевода). [c.168]
Высказанное Конантом, Кирнером и Хаоси положение …активирующие группы могут оказывать влияние на атом галогена в соединениях типа АСНгХ так, что атом галогена является очень реакционноспособным при его положительном и отрицательно.м значениях [269, стр. 493], получило дальнейшее развитие в работах других исследователей.
Так, Беннет и Бер ра через два года показали, что в то время как отрицательный заряд атома хлора ускоряет гидролиз,. ..положительный заряд на атоме хлора делает более быстрым его взаимодействие с иодидом калия [270, стр.
1678], Несколько другим лутем предложил решить (Проблему действия одинаковых по строению молекул в различных органических реакциях Тронов, предсказавший существование в гало-генпроизводных двух типов разрыва связи между углеродом и галоидом нейтрального (распад на радикалы.— В. К.
) я ионного, причем в последнем случае лишние электроны остаются при ядре галоида [271, стр. 1279]. Поэтому при более электроположительных углеводородных частях молекулы (алифатические производные) должен преобладать второй тип разрыва, а при электроотрицательном углеводородном остатке — первый тип.
Именно переходом от одного механизма расщепления гало-генпроизводного к другому в зависимости от характера электронного строения углеводородных частей молекул Тронов объяснил наблюдаемое им падение, а затем возрастание активности галогена при реакциях галогензамещенных молекул с аминами и алкоголятами (табл. 18). [c.77]
Предварительное замечание. Формулы электронного строения оболочек атомов построены по энергетическому признаку.
Однако не следует полагать, что эти формулы пространственно отображают какие-то стационарные системы в атоме все бурлит под непрерывным воздействием центробежных и центростремительных сил в их единстве и противоположности.
Особенно это проявляется в отношении валентных электронов.
Например, в атоме калия (К, 2 = 19) валентный электрон 4s то втягивается ядром и электрон на мгновение внедряется в атомный остов калия (пеиетрация), то дружным действием одноименно заряженных электронов остова выбрасывается из последнего. Получается, что 4s -элeктpoн как бы описывает по периферии атома замкнутую своеобразную синусоиду. Ни у ядра, ни у атома в целом четких границ нет. [c.514]
Газ т. пл., К т. кнп., к Энергия нонизацни, ккал/моль Электронное строение °298, кал-моль 1х хград 1 [c.339]
KAl(504)2 12НгО изоморфны с хромокалиевыми квасцами K r(S04)2-12НгО, и замещением иона Сг + на ион АР+ можно приготовить смешанные квасцы. В этом случае оба катиона имеют одинаковый заряд и близкие ионные радиусы (/»А1 = 53 пм, Гсг = 62 пм).
Сходны между собой ионы (г— = 72 пм), Мп2+ (г = 82 пм) и Zn2+ (г = 75 пм) несмотря на то, что катион магния имеет конфигурацию благородного газа (s p ), а другие содержат й-электроны (d и ). Близкое сходство ионов лантаноидов (см. разд. 16) также объясняется их одинаковым зарядом и примерно одинаковыми размерами ионов.
Такое сходство, которое больше зависит от заряда, чем от электронной конфигурации, можно назвать физическим — это сходство таких физических свойств соединений, как кристаллическая структура и, следовательно, растворимость и склонность к осаждению. Так, соосаждение чаще связано с одинаковыми степенями окисления, чем с природой ионов.
Например, элемент — носитель для радиоактивного индикатора не обязательно должен быть из того же химического семейства, что и радиоактивный изотоп. Технеций (VH) может соосаждаться не только с перренат-ионом, но и с перхлорат-, перйодат- и те-трафтороборат(П1)-ионами.
Соединения свинца (П) имеют примерно ту же растворимость, что и соединения тяжелых щелочноземельных элементов. Тал-лий(1) г — 150 пм) по физическим свойствам часто напоминает катион калия (г = 138 пм). Например, он образует растворимые соли—нитрат, карбонат, ортофосфат, сульфат и фторид.
Катион таллия (I) способен внедряться во многие калийсодержащие ферменты, в результате чего продукты метаболизма становятся чрезвычайно ядовитыми. Однако электронное строение катионов также может влиять на свойства соединений, например, на поляризацию анионов (см. разд. 4.5), поэтому по отношению к тяжелым галогенам катион Т1+ больше напоминает катион Ag+, чем К+. [c.388]
Разногласия между результатами исследований Урбэна и теоретическими выводами Бора заинтересовали химика Хевеши и физика Костера, и они начали поиски элемента 72. Основываясь на выводах Бора, предсказавшего электронное строение атома элемента 72 и его основную валентность (4), и руководствуясь периодическим законом Д. И.
Менделеева, они искали аналог циркония в минералах, содержащих последний. С этой целью методом рентгеноспектрального анализа были исследованы минералы циркония и в образце циркона из Норвегии установлено наличие нового элемента.
Из циркониевых препаратов методом фракционной кристаллизации комплексных фтористых солей циркония с примесью гафния и калия или аммония были сконцентрированы и выделены препараты нового элемента. Совпадение линий рентгеновских спектров нового элемента с вычисленными по закону Мозли для элемента 72 позволило Хевеши и Костеру в январе 1923 г.
сообщить об открытии нового элемента (10—12]. В честь города, в котором было совершено это открытие, элемент 72 назвали гафнием (Hafnia — латинское название Копенгагена). [c.6]
Из этой таблицы можно, в частности, видеть, что при одинаковом электронном строении анионы обладают большими размерами, чем катионы.
Если взять ряд солей типа АБ, в которых анион Б остается неизменным, а размер катиона А последовательно увеличивается, то в таком ряду при достижении определенной величины отношения радиуса А к радиусу Б может произойти изменение структуры кристаллической решетки.
Так, например, случае хлоридов щелочных металлов при достижении отношения радиуса катиона к радиусу аниона, равного 0,91, кристаллическая решетка типа Na l (в которой кристаллизуются хлориды лития, натрия и калия) ме1няется на тип s l (в которой кристаллизуется хлорид цезия). [c.14]
Ранее (1, 2] сообщалось, что метильные производные азо тистых гетероциклов образуют в, растворах амида калия в жидком аммиаке гетероциклические карбанионы типа Не1СНг .
В настоящей и последующих статьях этой серии на основе изучения электронных и ИК-спектров таких растворов рассмотрено более подробно влияние как внутренних (характер и расположение заместителей в гетероцикле, аннелирова-ние бензольных колец, природа гетероатома), так и внешних (свойства среды, природа противоиона) факторов на характеристики электронного строения карбанионов. [c.107]
Таким образом, из элементов 1А-группы физиологически активны Ь , НЬ, Сз, а Ыа и К — жизненно необходимы. Близость физико-химических свойств и Ыа, обусловленная сходством электронного строения их атомов, проявляется и в биологическом действии катионов (накопление во внеклеточной жидкости, взаимозамещаемость).
Аналогичный характер биологического действия катионов элементов больших периодов — К» «, КЬ+, Сз» (накопление во внутриклеточной жидкости, взаимозамещаемость) также обусловлен сходством их электронного строения и физико-химических свойств. На этом основано применение препаратов натрия и калия при отравлении солями лития и рубидия.
[c.240]
Смотреть страницы где упоминается термин Калий электронное строение: [c.67] [c.29] [c.56] [c.374] [c.375] [c.51] [c.289] [c.72] [c.42] [c.212] [c.42] [c.212] [c.26] [c.536] [c.143] [c.72] [c.149] [c.41] [c.62] [c.92] Основы общей химии Том 2 Издание 3 (1973) — [ c.21 , c.89 , c.210 , c.210 , c.217 , c.227 ]
Электронное строение
электронами электронное строение
© 2019 chem21.info Реклама на сайте
Источник: https://www.chem21.info/info/1182013/




