Аммиак – это летучее водородное соединение (нитрид водорода), которое играет ведущую роль в современной промышленности.
Хоть его и открыли лишь в восемнадцатом веке, но он был известен человеку с незапамятных времен. Водный раствор аммиака – это нашатырный спирт. Данное вещество содержится в продуктах разложения живых организмов и моче. Поэтому при распаде органики (останков растений, животных) выделяется аммиак, и от этого появляется резкий запах гниения (нашатыря).
История аммиака

- Аммиак был открыт в конце восемнадцатого века британским химиком Джозефом Пристли – одним из основоположников современной химии, который совершил также множество важных открытий в других сферах науки (физике, биологии, оптике).
- Например, в списках его изобретений есть: газированная вода, за которую он получил медаль Лондонского Королевского общества, и всем известный ластик (раньше для стирания графита все пользовались хлебом).
- Нельзя отрицать того, что Джозеф Пристли сделал огромный вклад в химию, особенно в области газов, однако многие свои достижения он совершил случайно.
- Джозеф Пристли получил аммиак методом нагревания хлорида аммония (нашатырь) с гидроксидом кальция (гашеная известь) и затем собрал выделившийся газ в ртутной ванной.
Ртутная ванная – это специальный прибор, созданный Пристли для концентрирования газов. При комнатной температуре ртуть является жидкостью с высокой плотностью, что не позволяет ей абсорбировать газы. Их ученый легко выделял из веществ, нагревая над поверхностью ртути.
- Уравнение аммиака:
- 2NH4Cl + Ca(OH)2 = NH3 + CaCl2.
- После открытия Джозефом Пристли аммиака, его изучение не стояло на месте.
- В 1784 был установлен состав этого вещества химиком Луи Бертолле, который разложил его на исходные элементы электрическим разрядом.
- Именование «нашатырь» он получил уже в 1787 году от латинского названия нашатырной щелочи, а само наименование «аммиак», которым мы привыкли пользоваться, ввел Яков Дмитриевич Захаров в 1801 году.
Но вот что интересно. За сто лет до Джозефа Пристли и его открытия аммиака, ученый Роберт Бойль наблюдал некое явление, при котором палочка, предварительно смоченная в соляной кислоте, начинала дымить, когда ее подносили к газу, выделяющемуся при сжигании навоза.
Это объясняется тем, что кислота и аммиак вступали в реакцию, и в ее продуктах содержался хлорид аммония, частицы которого и создавали дым. Получается, что экспериментальными методами аммиак был выявлен давно, но его нахождение в мире было доказано намного позже.
Состав молекулы
Молекула аммиака (NH3) имеет форму тетраэдра с атомом азота в вершине. В ней находятся четыре электронных облака, которые перекрываются вдоль линии связи, следовательно, в молекуле содержатся исключительно сигма-связи.
По сравнению с водородом азот имеет большую электроотрицательность, поэтому общие электронные пары в молекуле смещены в его сторону.
И так как в аммиаке везде одинарные связи, то тип гибридизации – sp3, а угол между электронными облаками равен 109 градусам.
Способы получения

В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
N2 + 3H2 ⇄ 2NH3 + Q
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
- 3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
- 4. Или нагреванием хлорида аммония с концентрированной щелочью:
- NH4Cl + NaOH = NaCl + NH3↑ + H2O
Применение

Аммиак – это незаменимое и действительно нужное вещество, без которого мировая промышленность замедлила бы свое движение. Область его применения широка: он задействован во всех производственных процессах человека, начиная от заводов и лабораторий, заканчивая медициной. Его преимущества в том, что он экологически чист и является довольно дешевым продуктом.
Области применения аммиака:
- Химическая промышленность. Его используют в производстве удобрений, полимеров, азотной кислоты, взрывчатых веществ, в качестве растворителя (жидкий аммиак).
- Холодильные установки. Аммиак испаряется с поглощением большого количества тепла из окружающей среды, так как обладает определенными термодинамическими свойствами. Холодильные системы, основанные на его применении более чем эффективны, поэтому он является главным хладагентом в промышленности.
- Медицина. Нашатырный спирт или 10 % раствор аммиака используют при выведении из обморочного состояния (раздражение рецепторов слизистой оболочки носа способствует стимуляции дыхания), обработке рук хирурга, возбуждении рвоты и так далее.
- Текстильная промышленность. С его помощью получают синтетические волокна. Также аммиак используют при очистке или окрашивании различных тканей.
Физические свойства
Вот какие физические свойства присущи аммиаку:
- При нормальных условиях является газом.
- Бесцветный.
- Имеет резкий запах.
- Ядовит и очень токсичен.
- Очень хорошо растворим в воде (один объем воды на семьсот объемов аммиака) и ряде органических веществ.
- Температура плавления составляет -80 °С.
- Температура кипения – около -36 °С.
- Является взрывоопасным и горючим веществом.
- Примерно вдвое легче воздуха.
- Имеет молекулярную кристаллическую решетку, соответственно, он легкоплавкий и непрочный.
- Молярная масса аммиака равна 17 грамм/моль.
- При нагревании в кислородной среде разлагается на воду и азот.
Химические свойства аммиака

Аммиак является сильным восстановителем, так как степень окисления азота в молекуле минимальная. Он способен также к окислительным свойствам, что случается намного реже.
Реакции с аммиаком:
- С кислотами аммиак образует соли аммония, разлагающиеся при нагревании. С соляной кислотой аммиак составляет хлорид аммония, а с серной — сульфат аммония.
NH3 + HCL = NH4CL
NH3 + H2SO4 = (NH4)2SO4
- С кислородом при нагревании образуется азот, а при участии катализатора (Pt) получается оксид азота.
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
- С водой образуется неустойчивый гидрат аммиака.
NH3 + H2O = NH3 × H2O
Аммиак способен проявлять щелочные свойства, поэтому при взаимодействии с водой он образует слабое основание – NH4OH. Но на самом деле такого соединения не существует, поэтому формулу следует записывать так: NH3 × H2O.
- 2NH3 + 3CuO = 3Cu + N2 + 3H2O
- 8NH3 + 3Cl2 =N2 + 6NH4Cl
- 3NH3 + ЗН2О + AlCl3 = Al(OH)3↓ + 3NH4Cl
Соединения аммиака
Есть несколько типов сложных веществ, образующихся при взаимодействии с аммиаком:
- Соли аммония. Они образуются в результате реакций аммиака с кислотами и разлагаются при нагревании.
- Амиды. Это соли, которые получают, действуя на щелочные металлы аммиаком.
- Гидразин. Это вещество, которое получают в результате окисления аммиака гипохлоритом натрия в присутствии желатина.
- Амины. Аммиак взаимодействует с галогеноалканами в качестве реакции присоединения, образуя соли.
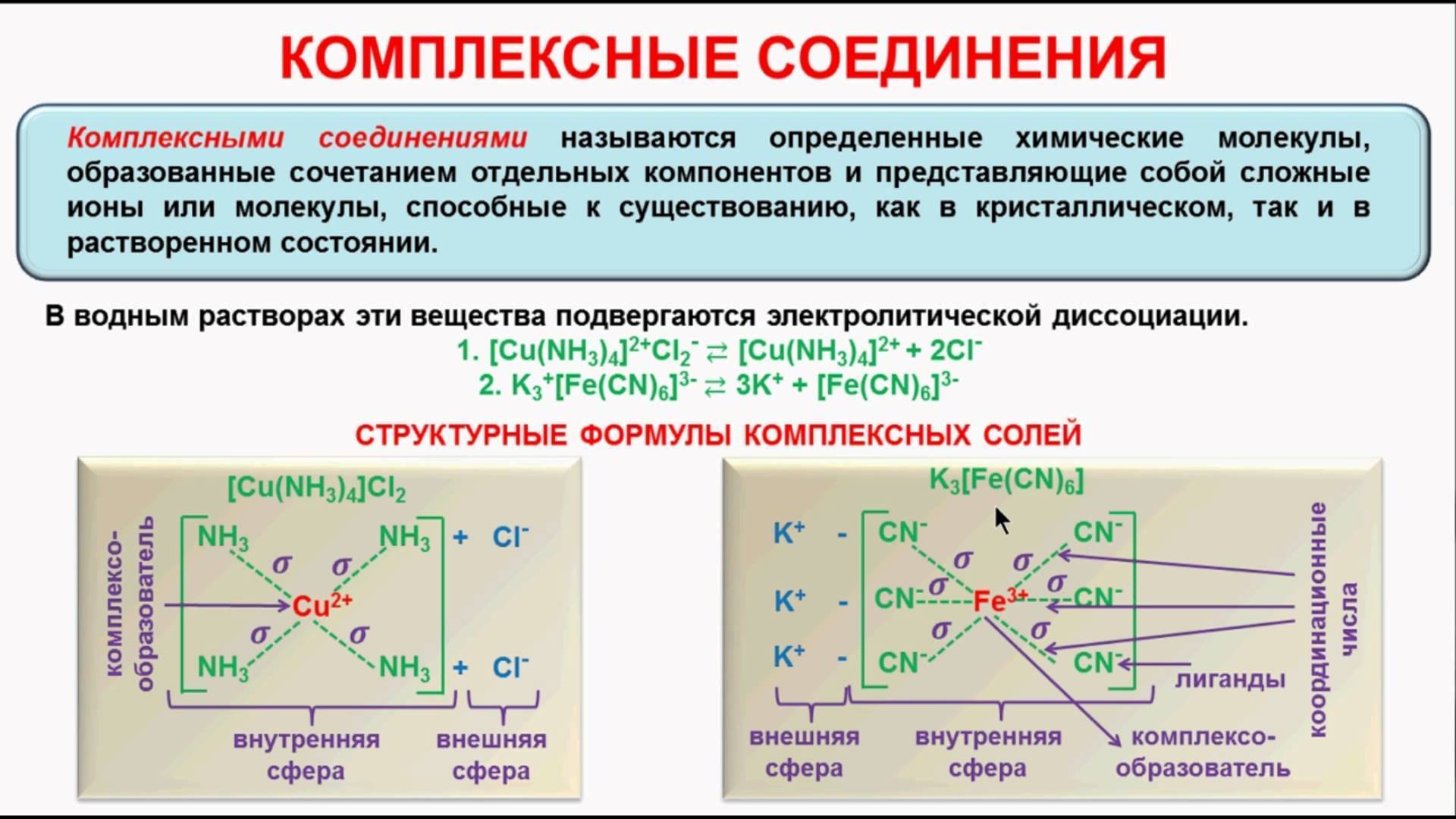
- Аммиакаты. С серебром и солями меди аммиак образует комплексные соли.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Агрегатные состояния

Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
Отравление аммиаком

Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Симптомы отравления
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Последствия отравления
После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.
Источник: https://www.syl.ru/article/430916/ammiak—eto-nashatyirnyiy-spirt-formula-svoystva-i-primenenie-ammiaka
Аммиак, получение, свойства, химические реакции
![]()
![]()
![]()
![]()
- Аммиак, NH3 – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
- Аммиак, формула, газ, характеристики
- Аммиак, жидкость, твердое тело, характеристики
- Физические свойства аммиака
- Химические свойства аммиака
- Получение аммиака в промышленности и лаборатории
- Химические реакции – уравнения получения аммиака
- Применение и использование аммиака
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:

Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/ammiak-poluchenie-svoystva-himicheskie-reaktsii/
Химические свойства аммиака | Дистанционные уроки
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков.

Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
Интересными химическими свойствами молекула аммиака обязана атому азота — p-элемент элемент 2-го периода V группы периодической системы имеет на внешнем энергетическом уровне 5 электронов.

На 3 ковалентных связи с водородом расходуются 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют неподеленную электронную пару.
Именно эта свободная неподеленная пара электронов определяет многие химические свойства аммиака.
- Образование иона аммония:
NH3 + H+ → NH4+ —
— у аммиака есть неподеленная электронная пара, а у иона водорода есть абсолютно свободная орбиталь;
- молекула аммиака полярна — отрицательный заряд двух электронов и положительный — от трех водородов, поэтому вещество хорошо растворимо в воде, более того, водный раствор аммиака — широко известный «нашатырный спирт» — жидкость с очень характерным запахом
Формулу такого раствора часто записывают вот в таком виде:
NH3 + H2O → NH3•H2O или NH4OH
NH4OH — гидроксид аммония. Т.к. азот притягивает к себе водород из воды, то по химическим свойствам аммиак — слабое основание, т.е. очень слабо диссоциирует на NH4+ (ион аммония) и OH— — гидроксид-ион.
- соответственно, водород «любит» все, что содержит водород, например, кислоты:
NH3 + HСl → NH4Cl — хлорид аммония
- к химическим свойствам аммиака относится и вытеснение металлов из водных растворов солей:
2NH3 + CuSO4 = (NH4)2SO4 + Cu
- к химическим свойствам аммиака относятся и реакции окисления:
2NH3 + 6KMnO4+ 6KOH → 6K2MnO4+N2 + 6H2O
(аммиак окисляется до азота)
В чистом кислороде он сгорает бледно-желтым пламенем:

- аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Качественные реакции на аммиак:
- изменение окраски индикатора в водном растворе аммиака (щелочная среда):
- лакмус — становится синим,
фенолфталеин — малиновым, - метиловый-оранжевый — желтым;
- если к пробирке с раствором NH3 (NH3•H2O или NH4OH) поднести палочку, смоченную в концентрированной соляной кислоте HCl – будет выделяться видимый белый дым – образуется хлорид аммония (NH4Cl);

Свойства солей аммония:
- ионная кристаллическая решетка;
- в растворе диссоциируют:
NH4X → NH4+ + X—
- подвергаются гидролизу с образованием кислой среды:
гидролиз по катиону:
- NH4Сl + H2O → NH3 ↑+ H2O + HCl (кислая среда)
- гидролиз по катиону и аниону:
- (NH4)2СO3 + H2O → 2NH3 ↑+ 2H2O + СO2 ↑ (нейтральная среда)
- свойства солей аммония соответствуют свойствам всех других солей — взаимодействие с основаниями, другими солями и кислотами. Главные условия протекания таких реакций до конца — образование газа, осадка или малодиссоциирующего вещества;
- важное химическое свойство солей аммония — разложение при нагревании:

Последняя реакция — разложение бихромата аммония часто используется в заданиях С3 ЕГЭ по химии (химический эксперимент), так что стоит ее выучить.
Химические свойства аммиака обусловлены строением молекулы, т.е. электронной конфигурацией атома азота. Т.к. в заданиях ГИА и ЕГЭ уделяется много внимания как самому аммиаку, так и его соединениям, то эту тему надо знать хорошо.
Обсуждение: «Химические свойства аммиака»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximicheskie-svojstva-ammiaka.html
Формула Аммиака структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: NH3
Химический состав Аммиака
| N | Азот | 14.007 | 1 | 82,2% |
| H | Водород | 1.008 | 3 | 17,8% |
Молекулярная масса: 17,031
Аммиа́к (нитрид водорода) — химическое соединение с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта и мочи).
Плотность аммиака почти вдвое меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007[1].
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не даёт возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твёрдый аммиак — бесцветные кубические кристаллы.
keywords формула, аммиак, структурная, химическая, брутто, химия Description Формула Аммиака химическая структурная, брутто. Формулы химических элементов и веществ. Сайт о Формулах. Формулы по математике. Формулы по физике.
Источник: http://formula-info.ru/khimicheskie-formuly/a/formula-ammiaka-strukturnaya-khimicheskaya
Cвойства аммиака
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.
Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
| Взаимодействие | Продукты реакции | Уравнение |
| С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
| С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
| С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
| С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
| С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
| С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |
Рис. 3. Горение аммиака.
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель.
Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины.
Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Средняя оценка: 4.3. Всего получено оценок: 231.
Источник: https://obrazovaka.ru/himiya/svoystva-ammiaka-himicheskie-fizicheskie.html
ПОИСК
| Рис. 6. Схема электронного строения молекулы аммиака |  |
Общая характеристика элементов главной подгруппы V группы периодической системы. Азот. Строение атома, строение молекулы, степени окисления. Круговорот азота в природе. Получение, физические и химические свойства азота. Аммиак, строение молекулы, получение, физические и химические свойства. Восстановительные свойства аммиака. Аммиачная вода. Соли аммония, их получение. Термическое разложение солей аммония. Оксиды азота, их получение и основные химические свойства. Азотистая кислота. Окислительно-восстановительные свойства соединений азота со степенью окисления +3. Азотная кислота, ее получение и химические свойства. Окислительные свойства азотной кислоты в реакциях взаимодействия с металлами и неметаллами. Царская водка. Соли азотной кислоты, их термическое разложение. Азотные удобрения. Фосфор, строение атома, степени окисления. Аллотропия. Физические и химические свойства. Фосфин. Фосфиды, их гидролиз. Оксиды фосфора (III) и (V), их получение, свойства. Ортофосфор-ная кислота, ее получение. Одно-, двух- и трехзамещен-ные фосфаты. Их растворимость и гидролиз. Метафос-форная кислота, ее общая характеристика. Фосфорные удобрения. [c.7]
Гибридизация в молекулах воды и аммиака. Строение молекул воды, аммиака и аналогичных им соединений было уже рассмотрено в предположении, что образуется чистая р-связь. При этом было рассчитано, что угол НХН должен быть равен 90°, т. е. значению, намного отклоняющемуся от опытных данных как для воды, так и для аммиака. Строение молекул этих соединений можно рассмотреть, предположив гибридизацию связей [12]. [c.195]
РиС 1Х-3. Строение молекулы аммиака. [c.384]
Строение молекул некоторых сложных веществ — аммиака, воды, диоксида углерода и метана — можно изобразить схемами [c.104]
Пространственное строение молекулы аммиака рассмотрено в разд. 4.5.5 п [c.428]
Трифторид азота NF3 в обычных условиях — бесцветный газ (т. кип. —129°С, т. пл. —209°С). Получают его при окислении аммиака фтором. Молекула NFs имеет пирамидальное строение (см. рис. 38), dNF=l,37A, FNF=102°. В отличие от H3N дипольный момент NF3 очень мал, всего 0,2D (стр. 81).
Электронодонорных свойств NF3 практически не проявляет. По отношению к нагреванию и различным химическим воздействиям трифторид весьма устойчив, вступает в реакции только выше 100°С.
В воде он практически нерастворим, гидролиз начинает протекать лишь при пропускании электрической искры через смесь его с водным паром. [c.397]
Электронная структура н пространственное строение молекулы аммиака рассмотрены в 43. В жидком аммиаке молекулы NHj ((i=l,48D) связаны между собой водородными связями, что обусловливает сравнительно высокую температуру кипения аммиака (—33,4°С), не соответствующую его малой молекулярной массе (17 а. е. м.). [c.399]
Что общего и чем отличаются по своему строению молекулы метана, аммиака и воды [c.84]
Составьте электронные схемы строения молекул водорода, хлора, азота, воды и аммиака. [c.45]
Молекулы, состоящие из трех или более атомов с полярными связями, могут быть как полярными, так и неполярными. Это зависит от симметрии строения молекул. Например, молекулы воды и аммиака полярны, распределение электрических зарядов у них такое, что электрические центры тяжести положительных и отрицательных зарядов не совпадут [c.94]
Строение молекул и химические свойства. Строение молекул аминов аналогично строению молекулы аммиака, и поэтому свойства этих веществ сходны. В их молекулах атом азота имеет одну неподеленную пару электронов. [c.5]
Для многих молекул о симметрии равновесной конфигурации (но не о расстояниях) удается судить уже по самому существованию или отсутствию спектра. Так, ИК-вращательный спектр аммиака указывает на пирамидальное строение молекулы, поскольку плоская молекула ХУз не имеет дипольного момента и неактивна в ИК-спектре.
Аналогично существование вращательного ИК-спектра молекулы НгО указывает на нелинейность молекулы, так как линейные симметричные молекулы неполярны. Так как ИК- и МВ-вращательные спектры связаны с наличием дипольного момента, то, изучая эффект Штарка в МВС, можно определить дипольный момент люлекулы. [c.
170]
Опишите строение молекулы аммиака и объясните высокую яолярность молекулы, резко выраженную склонность к донорно- [c.62]
Еще будучи студентом третьего курса, В. С. Гутыри под руководством доцента Е. Познера участвовал в научно-исследовательских работах лаборатории количественного анализа АКИМ им. М. А. Азизбекова. Первая его публикация посвящена применению газообразного аммиака для количественного определения алюминия (1932 г.).
Позднее он занимался изучением строения органических соединений, что нашло отражение в ряде статей, посвященных вопросам пространственных форм углеродного тетраэдра, строения молекулы бензола, структуры поливалентных связей, зависимости структурных констант молекулярной рефракции и парахора от характера связей. [c.
4]
Сказанное проиллюстрируем на примере строения молекул метана, аммиака и воды. Центральные атомы этих молекул образуют химические связи за счет электронов 5р -гибридных орбиталей. У атома углерода на четыре 5/ -гибридные орбитали приходится четыре электрона [c.67]
Выше отмечалось, что валентные углы в молекулах Н2О и N1 ] не точно соответствуют расположению р-орбиталей и это обусловлено некоторым вкладом 5-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация.
Электронное строение молекул воды и аммиака выражается схемами, показанными иа с. 91. Четыре пары электронов в этих молекулах занимают четыре орбитали, которые близки к гибридным.
Отличие валентных углов от тетраэдрических объясняется тем, что гибридизация в данном случае неполная. [c.94]
Химические свойства аммиака определяются особенностями строения молекулы ЫНз. [c.131]
Строение молекулы. Азот образует с водородом несколько соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова [c.106]
Выше указывалось, что валентные углы в молекулах Н2О н ННз не точно соответствуют расположению р-орбнталей и это обусловлено некоторым вкладом -электронов в образование химической связи. Такой вклад есть ни что иное, как гибридизация. Электронное строение молекул воды и аммиака выражается схемами [c.88]
Рассмотрим электронное строение молекулы аммиака. Атом азота имеет пять валентных электронов, три из них участвуют в образовании трех а-связей с атомами водорода, каждый из которых при- [c.83]
Аммиак. Строение молекулы. Окислительно-зосстановительные свойства. Растворение в воде, гидрат аммиака и e o свойства. Соли аммония, их гидролиз и термическое разлсясенис. Получение аммиака в лаборатории и в промышленности. [c.133]
Строение молекулы МНз рассмотрено ранее (см. рис. 3.4). Она имеет форму пирамиды. Химическая связь Ы—Н полярная положительный заряд сосредоточен на атомах водорода, отрицательный — на атоме азота. Вследствие этого между молекулами аммиака образуется водородная связь, что можно изобразить так [c.189]
БОРАЗОЛ BзNзHe — бесцветная прозрачная жидкость, т. кип. 55° С по строению молекулы, физическим и химическим свойствам напоминает бензол. Получают при нагревании диборана ВгНа в струе аммиака. [c.46]
На месте, оставшемся после крушения теории радикалов, Жерар начал строить новое здание, подойдя к органической молекуле не со стороны ее углеродистого радикала, а как бы с противоположной точки зрения со стороны функциональной группы.
Не претендуя на познание строения молекулы, опираясь лишь на известные аналогии в поведении веществ, Жерар сформулировал теорию типов, согласно которой органические соединения можно сопоставлять с простейшими неорганическими веществами (водород, хлористый водород, вода, аммиак) и рассматривать их как аналоги неорганических молекул, в которых вместо водорода помещены органические остатки. Теория типов содействовала становлению учения о валентности, поскольку стало ясным, какое число атомов или групп может быть связано с водородом, кислородом, азотом. Максимальной вершины теория типов достигла в работах Кекуле, который установил тип метана и тем самым открыл четырехвалент-ность углерода. Кекуле принадлежит также огромная заслуга в том, что он обнаружил способность атомов углерода насыщать валентность друг друга, т, е. образовывать цепи. И все же Кекуле не сделал решающего шага, необходимого для того, чтобы стать творцом принципиально новой теории последователь Жерара, он продолжал считать химическую конституцию тел непознаваемой, а свои формулы — лишь удобным способом описания некоторых превращений и аналогий веществ. [c.8]
В качестве примера определения геометрической конфигурации молекул, содержащих неэквивалентные электронные пары рассмотрим строение молекулы аммиака NHз. В данной молекуле азот (электронная конфигурация 7N…
25 2р 2р 2р ) и три атома водорода ( И 1з ) образуют за счет (1 + 1)-взаимодействий 3 поделенные электронные пары. Четвертая — неподеленная электронная пара принадлежала атому азота и до образования связей. Таким образом, на электронной оболочке азота в молекуле NHз находятся 4 электронные пары.
Если бы все эти пары были эквивалентными, то они распо.пагались бы [c.134]
При обобщении знаний учащихся о структуре веществ весьма эффективно использование наложений графопособий для характеристики геометрии и пространственного строения молекул (например, молекул фтороводорода и воды, воды и аммиака, аммиака и метана).
При изучении типов гибридизации электронных орбиталей метод наложения позволяет проследить последовательность изменения энергий связей, форм электронных облаков, величин валентных углов и т. д., что обеспечивает более целенаправленное понимание теоретических вопросов.
Новые возможности открывают прием, обратный наложению,— снятие транспарантов, что позволяет выделить детали, укрупнить их, освободив фон от других частей изображения.
Так, в обучении химии снятие дает возможность выделить формулы веществ в уравнениях реакций, тепловые эффекты реакций, показать закономерность изменения свойств, физических констант и т. д. [c.130]
Рассмотрим несколько простых примеров. Из двух мыслимых вариантов (а и б) строения молекулы аммиака (рис. 63) выбираем б, поскольку измерения показывают, что молекула полярна (см. также стр. 179). Мы синтезировали дихлорбензол СвН4С1г. Какой из трех [c.139]
Возникает и такой вопрос если для молекул воды и аммиака характерна 5р -гибридизация, то почему угол между связями получается значительно меньше по сравнению с тетраэдрическим Чтобы ответить на этот вопрос, обратимся к схемам строения молекул метана СН4, аммиака ЫНз и воды НаО (см. рис. 17).
Как видно из рисунка 17, а, у атома углерода все четыре 5/ -гибридные орбитали заполнены свя-зываюш,ими электронными парами. У атома азота (рис. 17, б) только три 5р-гибрндные орбитали заполнены связывающими электронными парами, а четвертая 5р -гибридная орбиталь заполнена неподеленной электронной парой. У атома же кислорода (рис.
17, в) связывающими электронными парами заняты только две р -гибридные орбитали, а две другие заполнены поделенными электронными парами. Следовательно, отклонение от тетраэдрического угла (109°28 ) обусловлено действием неподеленных электронных пар, находящихся на яр -гибридиых орбиталях.
У атома азота одна такая пара, поэтому угол отклонения от тетраэдрического небольшой и составляет 107,3°. У атома кислорода их уже две, поэтому угол отклонения от тетраэдрического больше и составляет 104,5°. [c.79]
Фтористый водород выше 19,5 °С представляет собой бесцветный газ с резким раздражаюш им дыхательные пути действием, а ниже указанной температуры кипения — легкоподвижную бесцветную жидкость.
Благодаря особенностям химического строения молекула НР характеризуется высоким значением электрического момента диполя (0,64-Кл-м), превосходящим электрический момент диполя воды, сернистого газа и аммиака.
Жидкий фторид водорода имеет большую величину диэлектрической постоянной, равную 83,6 при О °С, НР ассоциирован за счет водородных связей в (НР) , где п изменяется от 1 до 4 в парах, а в жидком фтористом водороде л>4. [c.353]
Моменты днполей связей. МО в двухатомных и многоатомных молекулах с полярными связями. Строение молекул гидридов. Строение молекулы диборана. Тетраэдрическая пятиатомная молекула метана. Пирамидальная четырехатомная молекула аммиака. Уголковая трехатомная молекула воды. Двухатомная молекула фтористого водорода. [c.298]
Источник: https://www.chem21.info/info/6632/
Амины: способы получения, строение и свойства
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Строение аминов
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | МетиламинCH3-NH2 | ДиметиламинCH3-NH-CH3 | Триметиламин(CH3)3N |
| Ароматические | ФениламинC6H5-NH2 | Дифениламин(C6H5)2NH | Трифениламин(C6H5)3N |
| Смешанные | МетилфениламинCH3-NH-C6H5 | Диметилфениламин(CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
- При наличии одинаковых радикалов используют приставки ди и три.
- CH3-NH2 Метиламин
- СH3CH2-NH2 Этиламин
- CH3-CH2-NH-CH3 Метилэтиламин
- (CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например.Формуле С4Н11N соответствуют амины положения аминогруппы. |
| 1-Аминобутан (н-бутиламин) | 2-Аминобутан (втор-бутиламин) |
Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
| Пропиламин(первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин(третичный амин) |
Физические свойства аминов
- При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
- Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
- Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
- Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
- Амины также способны к образованию водородных связей с водой:
- Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
| Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов: |
| Аммиак :NH3 | Первичный амин R–:NH2 |
| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
- Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
- При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
- Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
- Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Видеоопыт бромирования анилина можно посмотреть здесь.
Получение аминов
Первичные амины можно получить восстановлением нитросоединений.
- Восстановление сульфидом аммония (реакция Зинина):
- Алюминий или цинк в щелочной среде.
- Алюминий и цинк реагируют с щелочами с образованием гидроксокомплексов.
- В щелочной и нейтральной среде получаются амины.
- Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
- При этом образуются не сами амины, а соли аминов:
- Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
- При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
- Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Источник: https://chemege.ru/aminy/
Физические и химические свойства аммиака
Билет № 24
1. Аммиак: состав молекулы, химическая связь в молекуле. Физические и химические свойства аммиака
Молекулярная формула аммиака NH3. Три атома водорода соединены с азотом ковалентными полярными связями (азот более электроотрицателен). В образовании связей принимают участие три неспаренных электрона азота и по одному электрону водорода. Структурная формула:
H – N – H
|
H
Молекула аммиака имеет форму треугольной пирамиды, в вершинах которой находятся атомы азота и водорода.Угол между связями N–H около 107°
Аммиак — бесцветный газ с характерным резким запахом. Легче воздуха, его можно собирать в перевернутые вверх дном сосуды.
Аммиак хорошо растворяется в воде (в 1 литре воды при комнатной температуре растворяется около 700 литров аммиака). При повышенном давлении аммиак легко переходит в жидкое состояние.
При последующем испарении поглощается много тепла, поэтому его используют в качестве хладагента в холодильных установках.
Аммиак химически активен.
Наличие у атома азота неподелённой электронной пары, не участвующей в образовании связей, делает возможным присоединение протона и образования еще одной, донорно-акцепторной связи, обозначаемой стрелкой:
H
l
[H – N → H ]+
l
H
- Ион аммония образуется, например, при растворении аммиака в воде:
- NH3 + H2O NH4+ + OH−
- Поэтому раствор аммиака обладает щелочными свойствами и окрашивает индикатор фенолфталеин в малиновый цвет.
- Аммиак взаимодействует с кислотами. Если близко поднести стеклянные палочки, смоченные концентрированным раствором аммиака и концентрированной соляной кислотой, образуется «дым» из кристалликов хлорида аммония:
- NH3 + HCl = NH4Cl
- Аммиак горит в кислороде с образованием молекулярного азота:
- 4NH3 + 3O2 = 2N2 + 6H2O
- В присутствии платины в качестве катализатора, азот аммиака окисляется до оксида азота (II):
- 4NH3 + 5O2 = 4NO + 6H2O
Эта реакция используется в производстве азотной кислоты и азотных удобрений. 10%-ный раствор аммиака в воде используется в медицине под названием «нашатырный спирт».
При нагревании аммиак разлагается (реакция обратная синтезу):
2NH3 N2 + 3H2
2. Опыт. Распознавание раствора соли серной кислоты среди трех предложенных растворов солей
- Для распознавания соли серной кислоты капаем в каждую пробирку раствор хлорида бария.
Там, где находится сульфат, выпадет белый кристаллический осадок, нерастворимый в концентрированной азотной кислоте:
- Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
- или в ионном виде:
- Ba2+ + SO42−= BaSO4↓
- Если среди растворов будет карбонат (тоже выпадает в осадок с Ba2+):
- Делим каждый раствор на две порции и капаем в первую тройку соляную кислоту. В пробирке с карбонатом выделится газ.
- Оставшиеся два раствора испытываем на сульфат.
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-24.htm




