Одним из наиболее распространенных металлов в земной коре после алюминия считается железо.
Физические и химические свойства его таковы, что оно обладает отличной электропроводностью, теплопроводностью и ковкостью, имеет серебристо-белый цвет и высокую химическую реакционную способность быстро коррозировать при высокой влажности воздуха или больших температурах. Находясь в мелкодисперсном состоянии, оно в чистом кислороде горит и самовоспламеняется на воздухе.
Начало истории железа
В третьем тысячелетии до н. э. люди стали добывать и научились обрабатывать бронзу и медь. Широкого применения из-за дороговизны они не получили. Продолжались поиски нового металла. История железа началась в первом веке до н. э. В природе его можно встретить только в виде соединений с кислородом.
Для получения чистого металла необходимо отделить последний элемент. Расплавить железо долго не удавалось, так как его надо было нагреть до 1539 градусов. И только с появлением сыродутных печей в первом тысячелетии до новой эры стали получать этот металл.
На первых порах он был хрупким, содержал много шлаков.
 С появлением горнов качество железа значительно улучшилось. Дальнейшую обработку оно проходило в кузнеце, где ударами молота отделялся шлак. Ковка стала одним из главных видов обработки металла, а кузнечное дело незаменимой отраслью производства. Железо в чистом виде – это очень мягкий металл. В основном его используют в сплаве с углеродом. Эта добавка усиливает такое физическое свойство железа, как твердость. Дешевый материал вскоре широко проник во все сферы деятельности человека и сделал переворот в развитии общества. Ведь еще в древние времена железные изделия покрывались толстым слоем золота. Оно имело высокую цену по сравнению с благородным металлом.
С появлением горнов качество железа значительно улучшилось. Дальнейшую обработку оно проходило в кузнеце, где ударами молота отделялся шлак. Ковка стала одним из главных видов обработки металла, а кузнечное дело незаменимой отраслью производства. Железо в чистом виде – это очень мягкий металл. В основном его используют в сплаве с углеродом. Эта добавка усиливает такое физическое свойство железа, как твердость. Дешевый материал вскоре широко проник во все сферы деятельности человека и сделал переворот в развитии общества. Ведь еще в древние времена железные изделия покрывались толстым слоем золота. Оно имело высокую цену по сравнению с благородным металлом.
Железо в природе
Одного алюминия в литосфере содержится больше, чем железа. В природе его можно встретить только в виде соединений. Трехвалентное железо, вступая в реакцию, окрашивает почву в бурый цвет и придает песку желтоватый оттенок.
Оксиды и сульфиды железа разбросаны в земной коре, иногда наблюдаются скопления минералов, из которых впоследствии и добывают металл. Содержание двухвалентного железа в некоторых минеральных источниках придает воде особый привкус.
 Ржавая вода, текущая из старых водопроводных труб, окрашивается за счет трехвалентного металла. Его атомы находятся и в организме человека. Они содержатся в гемоглобине (железосодержащем белке) крови, который снабжает организм кислородом и выводит углекислый газ. В составе некоторых метеоритов содержится чистое железо, иногда встречаются целые слитки.
Ржавая вода, текущая из старых водопроводных труб, окрашивается за счет трехвалентного металла. Его атомы находятся и в организме человека. Они содержатся в гемоглобине (железосодержащем белке) крови, который снабжает организм кислородом и выводит углекислый газ. В составе некоторых метеоритов содержится чистое железо, иногда встречаются целые слитки.
Какими физическими свойствами железо обладает?
Это пластичный серебристо-белого цвета металл с сероватым оттенком, имеющий металлический блеск. Он является хорошим проводником электрического тока и теплоты. Благодаря пластичности он прекрасно поддается ковке и прокатке.
Железо не растворяется в воде, но разжижается в ртути, плавится при температуре 1539 и кипит при 2862 градусов по Цельсию, имеет плотность 7,9 г/см³.
Особенностью физических свойств железа является то, что металл притягивается магнитом и после аннулирования внешнего магнитного поля хранит намагниченность. Используя эти свойства его можно применять для изготовления магнитов.
Химические свойства
Железо обладает следующими свойствами:
- на воздухе и в воде легко окисляется, покрываясь ржавчиной;
- в кислороде накаленная проволока горит (при этом образуется окалина в виде оксида железа);
- при температуре 700–900 градусов по Цельсию вступает в реакцию с парами воды;
- при нагревании реагирует с неметаллами (хлором, серой, бромом);
- вступает в реакции с разбавленными кислотами, в результате получаются соли железа и водород;
- не растворяется в щелочах;
- способно вытеснить металлы из растворов их солей (железный гвоздь, в растворе медного купороса, покрывается красным налетом, — это выделяется медь);
- в концентрированных щелочах при кипячении проявляется амфотерность железа.
Особенность свойств
Одним из физических свойств железа является ферромагнитность. На практике с магнитными свойствами этого материала приходится встречаться часто. Это — единственный металл, который обладает такой редкостной чертой.
 Под действием магнитного поля происходит намагничивание железа. Сформировавшиеся магнитные свойства металл еще долго сохраняет и сам остается магнитом. Такое исключительное явление объясняется тем, что структура железа содержит большое количество свободных электронов, способных передвигаться.
Под действием магнитного поля происходит намагничивание железа. Сформировавшиеся магнитные свойства металл еще долго сохраняет и сам остается магнитом. Такое исключительное явление объясняется тем, что структура железа содержит большое количество свободных электронов, способных передвигаться.
Запасы и добыча
Одним из самых распространенных элементов на земле является железо. По содержанию в земной коре занимает четвертое место. Известно множество руд, которые содержат его, например, магнитный и бурый железняк.
Металл в промышленности получают в основном из руд гематита и магнетита при помощи доменного процесса. Вначале происходит его восстановление углеродом в печи при высокой температуре 2000 градусов по Цельсию.
 Для этого сверху в доменную печь подают железную руду, кокс и флюс, а снизу нагнетается поток горячего воздуха. Также применяют и прямой процесс получения железа. Измельченную руду перемешивают со специальной глиной, получая окатыши. Далее их обжигают и с помощью водорода обрабатывают в шахтной печи, где оно легко восстанавливается. Получают твердое железо, а потом переплавляют его в электрических печах. Чистый металл восстанавливают из оксидов при помощи электролиза водных растворов солей.
Для этого сверху в доменную печь подают железную руду, кокс и флюс, а снизу нагнетается поток горячего воздуха. Также применяют и прямой процесс получения железа. Измельченную руду перемешивают со специальной глиной, получая окатыши. Далее их обжигают и с помощью водорода обрабатывают в шахтной печи, где оно легко восстанавливается. Получают твердое железо, а потом переплавляют его в электрических печах. Чистый металл восстанавливают из оксидов при помощи электролиза водных растворов солей.
Преимущества железа
Основные физические свойства вещества железа дают ему и сплавам следующие преимущества перед другими металлами:
- Обладают твердостью и прочностью, сохраняя упругость. У разных сплавов эти качества неодинаковы и зависят от легирующих добавок, способов производства и термообработки.
- Большое разнообразие чугуна и сталей позволяют использовать их для любых нужд в народном хозяйстве.
- Высокие магнитные свойства металла незаменимы для изготовления магнитопроводов.

- Выполнимость легкой механической обработки, благодаря физическим свойствам железа, дает возможность из его сплавов получать листы, прутки, балки, трубы, фасонные профили.
- Значительная ковкость материала позволяет использовать его для декоративных изделий.
- Низкая стоимость сплавов.
Недостатки
Кроме большого числа положительных качеств, есть и ряд отрицательных свойств металла:
- Изделия подвержены коррозии. Для устранения этого нежелательного эффекта с помощью легирования получают нержавеющие стали, а в остальных случаях делают специальную антикоррозийную обработку конструкций и деталей.
- Железо накапливает статическое электричество, поэтому изделия, содержащие его, подвергаются электрохимической коррозии и также требуют дополнительной обработки.
- Удельный вес металла составляет 7,13 г/см³. Это физическое свойство железа придает конструкциям и деталям повышенный вес.
Состав и структура
У железа по кристаллическому признаку есть четыре модификации, которые отличаются структурой и параметрами решетки. Для выплавки сплавов именно наличие фазовых переходов и легирующих добавок имеет существенное значение. Различают следующие состояния:
- Альфа-фаза. Она сохраняется до 769 градусов по Цельсию. В этом состоянии железо сохраняет свойства ферромагнетика и обладает объемно-центрированной решеткой кубического типа.
- Бета-фаза. Существует при температуре от 769 до 917 градусов по Цельсию. Имеет немного другие параметры решетки, чем в первом случае. Все физические свойства железа остаются прежними за исключением магнитных, их оно утрачивает.
- Гамма-фаза. Строение решетки становится гранецентрированным. Такая фаза проявляется в диапазоне 917–1394 градусов Цельсия.
- Омега-фаза. Такое состояние металла появляется при температуре выше 1394 градусов Цельсия. От прежней отличается только параметрами решетки.
 Железо – самый востребованный металл в мире. Больше 90 процентов всего металлургического производства приходится именно на него.
Железо – самый востребованный металл в мире. Больше 90 процентов всего металлургического производства приходится именно на него.
Применение
Люди начали использовать сначала метеоритное железо, которое ценили выше золота. С тех пор область применения этого металла только расширялась. Ниже представлено применение железа, на основе его физических свойств:
- ферромагнитные оксиды используют для производства магнитных материалов: промышленных установок, холодильников, сувениров;
- оксиды железа применяют как минеральные краски;
- хлорид железа незаменим в радиолюбительской практике;
- сульфаты железа используют в текстильной промышленности;
- магнитная окись железа – один из важных материалов для производства устройств долговременной компьютерной памяти;
- ультрадисперсный порошок железа находит применение в черно-белых лазерных принтерах;
- прочность металла позволяет изготовлять оружие и броню;
- износостойкий чугун можно использовать для производства тормозов, дисков сцепления, а также деталей для насосов;
- жаростойкий – для доменных, термических, мартеновских печей;
- жаропрочный – для компрессорного оборудования, дизельных двигателей;
- высококачественная сталь используется для газопроводов, корпуса отопительных котлов, сушилок, стиральных и посудомоечных машин.
Заключение
Под железом часто подразумевают не сам метал, а его сплав — низкоуглеродистую электротехническую сталь.
Получение чистого железа довольно сложный процесс, и поэтому его используют только для производства магнитных материалов.
Как уже отмечалось, что исключительное физическое свойство простого вещества железа – это ферромагнетизм, т. е. способность намагничиваться в присутствии магнитного поля.
 Магнитные свойства чистого металла до 200 раз превышают такие же показатели технической стали. На это свойство влияет и зернистость металла. Чем крупнее зерно, тем выше магнитные свойства. В некоторой степени оказывает влияние и механическая обработка. Такое чистое железо, удовлетворяющее этим требованиям, используют для получения магнитных материалов.
Магнитные свойства чистого металла до 200 раз превышают такие же показатели технической стали. На это свойство влияет и зернистость металла. Чем крупнее зерно, тем выше магнитные свойства. В некоторой степени оказывает влияние и механическая обработка. Такое чистое железо, удовлетворяющее этим требованиям, используют для получения магнитных материалов.
Источник: https://www.syl.ru/article/369165/himicheskie-i-fizicheskie-svoystva-jeleza-primenenie
Железо

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе.
В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum).
Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА

Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью.
Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже.
Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность.
Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля.
А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
Запасы и добыча
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O).
Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды.
В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд.
Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород.
Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия).
В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n.
В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд.
Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера.
Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
Физические свойства
Оптические свойства
Кристаллографические свойства
Источник: http://mineralpro.ru/minerals/iron/
Железо и его соединения
Кларк в земной коре 4,65 % по массе (4-е место по распространенности среди элементов, 2-е — среди металлов). В свободном виде почти не встречается. Основные формы рудоносных минералов — оксиды и сульфиды: магнетит Fe3O4, гематит Fe2O3, пирротин FeS, пирит FeS2 (железный колчедан).
В организме человека содержится около 5 г железа, большая часть его (70%) входит в состав гемоглобина крови.

Физические свойства
В свободном состоянии железо — серебристо-белый металл с сероватым оттенком. Чистое железо пластично, обладает ферромагнитными свойствами. На практике обычно используются сплавы железа — чугуны и стали.
Fe — самый главный и самый распространенный элемент из девяти d-металлов побочной подгруппы VIII группы. Вместе с кобальтом и никелем образует «семейство железа».
При образовании соединений с другими элементами чаще использует 2 или 3 электрона (В = II, III ).
Железо, как и почти все d-элементы VIII группы, не проявляет высшую валентность, равную номеру группы. Его максимальная валентность достигает VI и проявляется крайне редко.
Наиболее характерны соединения, в которых атомы Fe находятся в степенях окисления +2 и +3.
| Fe+2 | Fe+3 | Fe+6 | ||
| Оксиды | FeOосновный | Fe2O3основный со слабыми признаками амфотерости | FeO3 — не выделен | |
| Гидроксиды | Fe(OH)2 слабое основание | Fe(OH)3 ↔ HFeO2 + H2O | H2FeO4кислота, в свободном состоянии не выделена | |
| Соли | FeCl2, FeSO4, Fe(NO3)2 и др. | Тип IFeCl3 | Тип IIKFeO2 | K2FeO4BaFeO4SrFeO4ферраты (IV) |
Способы получения железа
1. Техническое железо (в сплаве с углеродом и другими примесями) получают карботермическим восстановлением его природных соединений по схеме:

- Восстановление происходит постепенно, в 3 стадии:
- 1) 3Fe2O3 + СО = 2Fe3O4 + СO2
- 2) Fe3O4 + СО = 3FeO +СO2
- 3) FeO + СО = Fe + СO2
Образующийся в результате этого процесса чугун содержит более 2% углерода. В дальнейшем из чугуна получают стали — сплавы железа, содержащие менее 1,5 % углерода.
- 2. Очень чистое железо получают одним из способов:
- а) разложение пентакарбонила Fe
- Fe(CO)5 = Fe + 5СО
- б) восстановление водородом чистого FeO
- FeO + Н2 = Fe + Н2O
- в) электролиз водных растворов солей Fe+2
- FeC2O4 = Fe + 2СO2
- оксалат железа (II)
Химические свойства
- Fe — металл средней активности, проявляет общие свойства, характерные для металлов.
- Уникальной особенностью является способность к «ржавлению» во влажном воздухе:
- 4Fe + 6Н2O + 3O2 = 4Fe(OH)3
- В отсутствие влаги с сухим воздухом железо начинает заметно реагировать лишь при Т > 150°С; при прокаливании образуется «железная окалина» Fe3O4:
- 3Fe + 2O2 = Fe3O4
- В воде в отсутствие кислорода железо не растворяется. При очень высокой температуре Fe реагирует с водяным паром, вытесняя из молекул воды водород:
- 3 Fe + 4Н2O(г) = 4H2
Процесс ржавления по своему механизму является электрохимической коррозией. Продукт ржавления представлен в упрощенном виде. На самом деле образуется рыхлый слой смеси оксидов и гидроксидов переменного состава. В отличие от пленки Аl2О3, этот слой не предохраняет железо от дальнейшего разрушения.
Виды коррозии


- 2Fe + 3Cl2 = 2FeCl3
- 2Fe + 3F2 = 2FeF3
- 2Fe + 3Br2 = 2FeBr3
- Fe + I2 = FeI2
- Fe + S = FeS
- Образуются соединения, в которых преобладает ионный тип связи.
2. Взаимодействие с фосфором, углеродом, кремнием
(c N2 и Н2 железо непосредственно не соединяется, но растворяет их)
- Fe + Р = FexPy
- Fe + C = FexCy
- Fe + Si = FexSiy
- Образуются вещества переменного состава, т к. бертоллиды (в соединениях преобладает ковалентный характер связи)
3. Взаимодействие с «неокисляющими» кислотами (HCl, H2SO4 разб.)
- Fe0 + 2Н+ → Fe2+ + Н2↑
- Поскольку Fe располагается в ряду активности левее водорода (Е°Fe/Fe2+ = -0,44В), оно способно вытеснять Н2 из обычных кислот.
- Fe + 2HCl = FeCl2 + Н2↑
- Fe + H2SO4 = FeSO4 + Н2↑
4. Взаимодействие с «окисляющими» кислотами (HNO3, H2SO4 конц.)
Fe0 — 3e- → Fe3+
Концентрированные HNO3 и H2SO4 «пассивируют» железо, поэтому при обычной температуре металл в них не растворяется. При сильном нагревании происходит медленное растворение (без выделения Н2).
- В разб. HNO3 железо растворяется, переходит в раствор в виде катионов Fe3+
а анион кислоты восстанавливется до NO*: - Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2Н2O
- Очень хорошо растворяется в смеси НСl и HNO3
5. Отношение к щелочам
В водных растворах щелочей Fe не растворяется. С расплавленными щелочами реагирует только при очень высоких температурах.
6. Взаимодействие с солями менее активных металлов
Fe + CuSO4 = FeSO4 + Cu
Fe0 + Cu2+ = Fe2+ + Cu0
7. Взаимодействие с газообразным монооксидом углерода (t = 200°C, P)
Fe(порошок) + 5CO (г) = Fe0(CO)5пентакарбонил железа
Соединения Fe(III)
Fe2O3 — оксид железа (III)
Красно-бурый порошок, н. р. в Н2O. В природе — «красный железняк».
Способы получения:
- 1) разложение гидроксида железа (III)
- 2Fe(OH)3 = Fe2O3 + 3H2O
- 2) обжиг пирита
- 4FeS2 + 11O2 = 8SO2 + 2Fe2O3
- 3) разложение нитрата
- 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Химические свойства
- Fe2O3 — основный оксид с признаками амфотерности.
- I. Основные свойства проявляются в способности реагировать с кислотами:
- Fe2О3 + 6Н+ = 2Fe3+ + ЗН2О
- Fe2О3 + 6HCI = 2FeCI3 + 3H2O
- Fe2О3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
II.
Слабокислотные свойства. В водных растворах щелочей Fe2O3 не растворяется, но при сплавлении с твердыми оксидами, щелочами и карбонатами происходит образование ферритов:
- Fe2О3 + СаО = Ca(FeО2)2
- Fe2О3 + 2NaOH = 2NaFeО2 + H2O
- Fe2О3 + MgCO3 = Mg(FeO2)2 + CO2
- III. Fe2О3 — исходное сырье для получения железа в металлургии:
- Fe2О3 + ЗС = 2Fe + ЗСО или Fe2О3 + ЗСО = 2Fe + ЗСO2
Fe(OH)3 — гидроксид железа (III)
- Получают при действии щелочей на растворимые соли Fe3+:
- FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
- В момент получения Fe(OH)3 — красно-бурый слизистоаморфный осадок.
- Гидроксид Fe(III) образуется также при окислении на влажном воздухе Fe и Fe(OH)2:
- 4Fe + 6Н2O + 3O2 = 4Fe(OH)3
- 4Fe(OH)2 + 2Н2O + O2 = 4Fe(OH)3
- Гидроксид Fe(III) является конечным продуктом гидролиза солей Fe3+.
Химические свойства
Fe(OH)3 — очень слабое основание (намного слабее, чем Fe(OH)2). Проявляет заметные кислотные свойства. Таким образом, Fe(OH)3 имеет амфотерный характер:
- 1) реакции с кислотами протекают легко:
- Fe(OH)3 + 3HCl = FeCl3 + 3H2O
- 2) свежий осадок Fe(OH)3 растворяется в горячих конц. растворах КОН или NaOH с образованием гидроксокомплексов:
- Fe(OH)3 + 3КОН = K3[Fe(OH)6]
- В щелочном растворе Fe(OH)3 может быть окислен до ферратов (солей не выделенной в свободном состоянии железной кислоты H2FeO4):
- 2Fe(OH)3 + 10КОН + 3Br2 = 2K2FeO4 + 6КВr + 8Н2O
Соли Fe3+
Наиболее практически важными являются: Fe2(SO4)3, FeCl3, Fe(NO3)3, Fe(SCN)3, K3[Fe(CN)6).
Характерно образование двойных солей — железных квасцов: (NH4)Fe(SO4)2•12Н2O, KFe(SO4)2• 12Н2O
Соли Fe3+ часто имеют окраску как в твердом состоянии, так и в водном растворе. Это объясняется наличием гидратированных форм или продуктов гидролиза.
Способы получения
- 1. Fe + неметалл
- 2Fe + 3Cl2 = 2FeCl3
- 2.Fe + кислота
- Fe + 4HNO3 разб = Fe(NO3)3 + NO + 2H2O
- 3. Fe2O3 + кислота
- Fe2O3 + 3H2SO4 = Fe2(SО4)3 + 3H2O
- 4. Fe(OH)3 + кислота
- Fe(OH)3 + 3HCl = FeCl3 + 3H2O
- 5. Окисление Fe2+ до Fe3+
- 2FeCl2 + Cl2 = 2FeCl3
- 2Fe2O3 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
Химические свойства
- I. Все растворимые соли Fe3+ в водных растворах сильно гидролизованы:
- Fe3+ + Н2O = FeOH2+ + Н+
- FeOH2+ + Н2O = Fe(OH)2+ + Н+
- Fe(OH)2+ Н2O = Fe(OH)3 + Н+
Водные растворы солей Fe3+ имеют сильнокислую реакцию. Соли Fe3+ с анионами слабых кислот подвергаются необратимому гидролизу.
- II. В реакциях с сильными восстановителями соли Fe3+ проявляют окислительную активность:
- 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
- Fe2(SO4)3 + H2S = 2FeSO4 + S + H2SO4
- III. При действии щелочей и водных растворов аммиака на растворы солей Fe3+ образуется осадок:
- Fe3+ + ЗОН- = Fe(OH)3
- IV. При нагревании многие соли разлагаются:
- 2FeCl3 = 2FeCl2 + Cl2
- Fe2(SO4)3 = Fe2O3 + 3SO3
- 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
- V. Качественные реакции для обнаружения катионов Fe3+:
- а) 4Fe3+ + 3[Fe(CN)6]4-желтая кровяная соль = Fe4[Fe(CN)6]3 берлинская лазурь (темно-синий осадок)
- б) Fe3+ + 3SCN- = Fe(SCN)3 роданид Fe(III) (р-р кроваво-красного цвета)
Источник: http://examchemistry.com/content/lesson/neorgveshestva/gelezo.html
Cвойства железа и реакции
Железо – металл, входит в восьмую группу периодической системы химических элементов. Он занимает 26 порядковый номер, а его атомная масса равняется 56. Обозначается символом Fe (от латинского Ferrum).В состав атомов входят 26 протонов, 30 нейтронов, 26 электронов.
Сегодня вещество является одним из самых распространенных металлов в природе. Оно нашло широкое применение в различных отраслях промышленности.
В данной статье разберем физические и химические свойства железа, поговорим об особенностях, соединениях и применении вещества.
Основные свойства железа
Fe – простое вещество. Его главные окислительные степени – +2, +3. Перечисленные степени окисления с легкостью преобразуются друг в друга при смене восстановительно-окислительных процессов.
Это металл серебряного оттенка с повышенным химически-реакционным свойством, который легко поддается ковке. Металл подвержен коррозии при повышенных температурах и повышенной влажности.
Если поместить вещество в чистый кислород, оно поддастся горению. В мелкодисперсном состоянии оно самовозгорится.
Железо химические свойства и реакции
Ниже приведен список, где наглядно показаны химические свойства металла.
1. При обыкновенных условиях ferrum малоактивен, но при нагреве он становится активным и вступает в реакцию практически со всеми неметаллами. Особенно эта черта характерна для мелкодисперсного Fe.
2. Металл взаимодействует со сложными компонентами.
К примеру, раскаленный Fe реагирует с водяным паром при температурном режиме от 800 градусов, хотя при привычных условиях этого не происходит.
3. Если оксид железа вступает в реакцию с кислотными оксидами, получаются соли. Так, оксид Fe взаимодействует с серным оксидом, вследствие чего получается сульфат железа (FeO + SO3 = FeSO4).
Еще одним интересным фактом является то, что ни при каких условиях FeO не вступит в реакцию с водой. Кстати, вот формула, на которой видно, что при взаимодействии железа с повышенной влажностью или водой оно окисляется и поддается коррозии: 4Fe + 3O2 + 6H2O = 4Fe(OH)3.
Оксид железа свойства
А теперь поговорим об оксиде этого металлического вещества во второй степени окисления.
Получают его разными методами:
• неполное восстановление оксида третьей степени водородом;
• неполное восстановление оксида третьей степени угарным газом.
Также нередко 3FeO восстанавливают при помощи обыкновенного железа, из-за чего образуется оксид второй степени. Если нагреть гидроксид Fe, он начнет разлагаться на оксид первой степени и воду.
2FeO является обыкновенным основным оксидом. У него довольно слабые окислительные способности, в отличие от 3FeO.

Добыча
Железо – самый распространенный металл в земной коре после алюминия. Его доля составляет 5,1 процента от общей массы. Встречается, как правило, в виде самородков. Нередко он оказывается на Земле вместе с метеоритами.
В промышленности материал получают на железорудных месторождениях и в содержащих ferrum минералах.
К слову, данное вещество встречается во множестве минералов, что обуславливается естественным окрасом. На их цвет влияют концентрация и соотношение ионов.
Также ferrum находится в организмах живых существ и растений. К примеру, в человеке может присутствовать до пяти граммов этого металла.
Fe является одним из важнейших элементов в организме. Именно он поддерживает кровоток и обеспечивает нормальные процессы жизнедеятельности. Если происходит дефицит, образуется малокровие в человеческом организме.
Физические характеристики
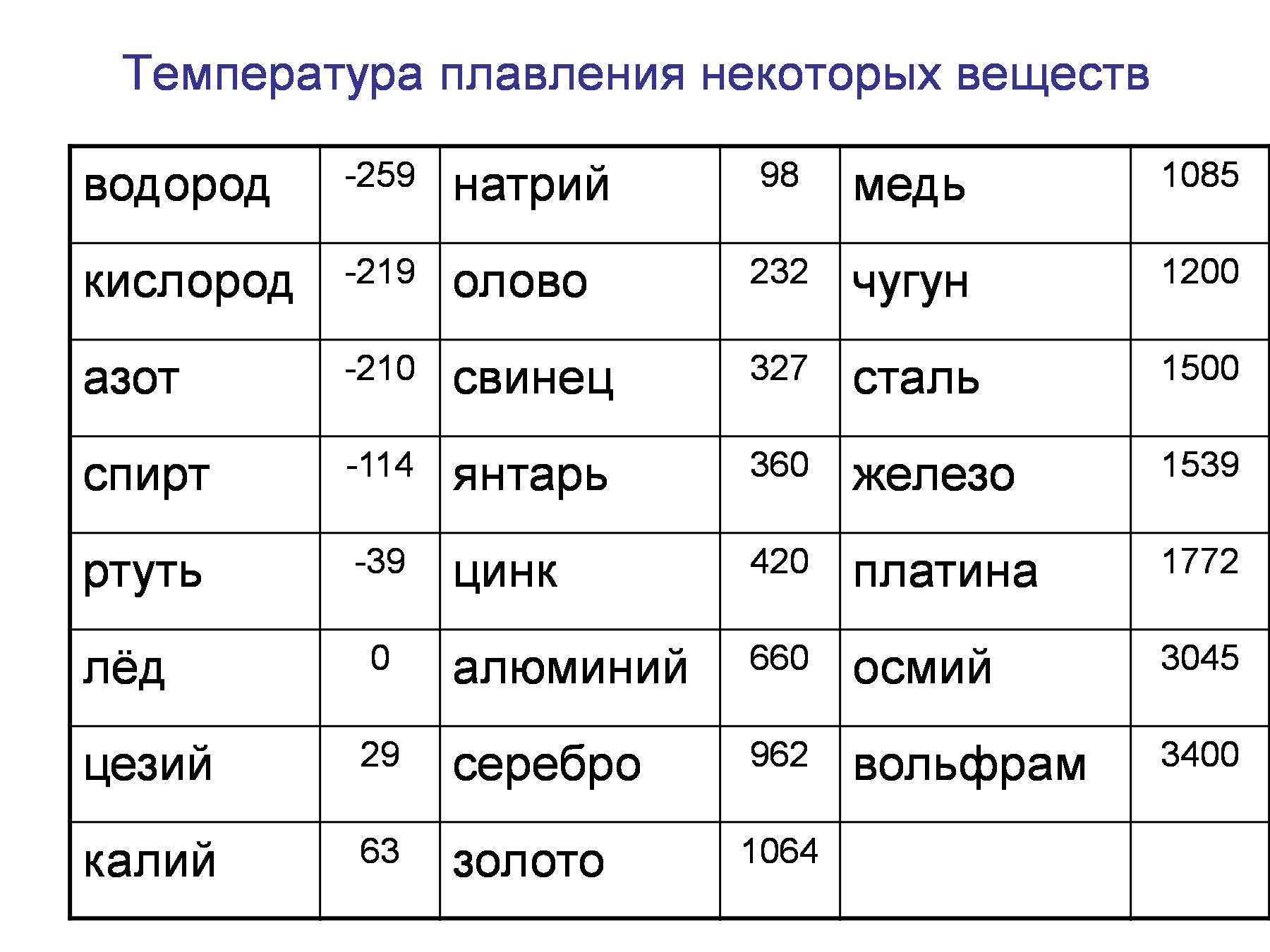
Как говорилось, материал представляет собой серебристо-белое вещество в натуральном виде. Он достаточно мягок, ковок и тягуч. Температура плавления составляет 1359 градусов по Цельсию. Для сравнения приведем таблицу, в которой указаны температурные условия для плавления других металлов.
| Название | Температура плавления | Температура кипения |
| Олово | 232 | 2 600 |
| Свинец | 327 | 1 750 |
| Медь | 1 084 | 2 562 |
| Никель | 1 455 | 2 913 |
| Серебро | 960 | 2 180 |
| Золото | 1 063 | 2 660 |
| Вольфрам | 3 420 | 5 555 |
Также ferrum имеет хорошие магнетические свойства, из-за чего используется в электротехнических машинах и аппаратах. А высокая прочность придается благодаря воздействию высоких температур при обработке.
Выделяют технически и химически чистый металл.
Так, первая разновидность является низкоуглеродистой сталью, так как содержит около 0,03% углерода, а также еще меньшее количество кислорода, азота и других веществ.
Химически чистый Fe отличается за счет почти полного отсутствия примесей. Сюда входят менее 0,01% различных веществ. Поэтому оттенок железа получается серебристым, а внешне оно напоминает платину.
Химически чистый материал противостоит ржавчине и отлично справляется с воздействиями разных кислот. Но даже незначительное количество примесей отбирает у него перечисленные характеристики.
Сферы применения
Как уже говорилось выше, этот элемент – один из самых распространенных. Это делает его недорогим, а значит, популярным. Из железа изготавливают сталь, чугун, феррит и другие сплавы. Благодаря особенным свойствам и характеристикам его применяют в различных областях жизнедеятельности.
Наибольшее применение материал нашел в металлургии. Из него производят строительные конструкции, арматуры. Конечно, в чистой форме его практически не применяют. Во-первых, это не выгодно с точки зрения расходов. Во-вторых, феррум легко поддается окислению. В основе изготовления металлоконструкций лежит чугун или сталь.
Феррум зарекомендовал себя в машиностроении: из него сооружают автомобили, корабли, авиатехнику. Также Fe применяют для производства следующих изделий:
- гири, гантели;
- ведра, лопаты;
- башенные краны;
- люки для канализаций;
- железнодорожные рельсы;
- оружие.
И это лишь малая часть предметов, изготавливающихся при помощи железа и его сплавов. Он занимает лидирующие позиции в промышленности.

В заключение
В данной статье мы поговорили о железе и его свойствах. Это популярный металл с отличными эксплуатационными показателями. Из него делают сплавы, ведь он легко поддается ковке. Помимо этого компонент играет значимую роль в организмах живых существ, а также он содержится в гемоглобине, миоглобине и множестве других ферментов.
Надеемся, публикация была интересной. Ждите новых полезных статей на нашем сайте!
Источник: https://ometallah.com/svojstva/cvojstva-zheleza-i-reaktsii.html
№26 Железо
Железо известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э.
и относятся к древнешумерской и древнеегипетской цивилизациям.
Латинское ferrum, скорее всего, заимствовано из какого-то восточного языка, скорее всего из финикийского.
Нахождение в природе и получение:
Железо — один из самых распространённых элементов на Земле и вообще в Солнечной системе. Металлическое железо в образует ядро Земли, где его содержание, по оценкам, около 90%.
Содержание железа в земной коре составляет 5 %, тем не менее и здесь из металлов железо уступает по распространённости только алюминию.
�з минералов наибольшее практическое значение имеют красный железняк (гематит, Fe2O3), магнитный железняк (магнетит, Fe3O4), бурый железняк или лимонит (FeOOH и FeOOH·nH2O).
Пирит FeS2 (серный или железный колчедан) используется в производстве серной кислоты.
Наиболее распространённым промышленным способом получения железа является доменный процесс, в основе которого восстановление оксидом углерода(II):
Fe2O3 + 3CO = 2Fe + 3CO2↑
РџСЂРё этом получается железо, содержащее РґРѕ 7% углерода Рё РґСЂСѓРіРёРµ примеси — чугун. Чугун РІ дальнейшем перерабатывают РІ более чистое железо — сталь, удаляя примеси окислением РІ мартеновских печах или конвертерах. Сталь может быть легирована добавками РґСЂСѓРіРёС… металлов, для повышения ее прочности, РєРѕСЂРѕР·РёРѕРЅРЅРѕР№ стойкости Рё С‚.Рї.
Р�спользуется также РїСЂСЏРјРѕР№ СЃРїРѕСЃРѕР± получения железа, РІ котором железные окатыши РїСЂРё 1000oРЎ восстанавливают РІРѕРґРѕСЂРѕРґРѕРј, получаемым РїСЂРё конверсии метана: Fe2O3 + 3H2 = 2Fe + 3H2O↑
Физические свойства:
Железо — типичный металл, РІ СЃРІРѕР±РѕРґРЅРѕРј состоянии — серебристо-белого цвета СЃ сероватым оттенком.
Чистый металл пластичен, РєРѕРІРѕРє, различные примеси (РІ частности — углерод) повышают его твёрдость Рё хрупкость.
Обладает ярко выраженными магнитными свойствами. Tпл=1812K, Tкип=3134K.
Химические свойства:
Железо относится Рє металлам средней активности, РІ СЂСЏРґСѓ напряжений стоит РґРѕ РІРѕРґРѕСЂРѕРґР° Рё растворяется РІРѕ РјРЅРѕРіРёС… кислотах, РЅРѕ концентрированной серной Рё азотной кислотами пассивируется Рё РЅР° холоду СЃ РЅРёРјРё РЅРµ реагирует. Раскаленное железо реагирует СЃ водяным паром: 3Fe + 4H2O = Fe3O4 + 4H2↑ (раньше так получали РІРѕРґРѕСЂРѕРґ для наполнения аэростатов).
При нагревании железо реагирует со многими неметаллами, часто образуя соединения нестехиометрического состава карбиды, бориды, силициды, нитриды и др.
Наиболее характерными для железа являются степени окисления +2 и +3, известны также соединения, где железо имеет степень окисления +6.
Важнейшие соединения:
Степень окисления +2 — основный РѕРєСЃРёРґ FeO (чёрный), РіРёРґСЂРѕРєСЃРёРґ Fe(OH)2 (зеленый).
Соли железа(II) (бледно-зеленого цвета), образуют кристаллогидраты (напр.
железный купорос, FeSO4*7H2O), легко окисляются кислородом до соединений железа(III).
Степень окисления +3 — наиболее устойчивая степень окисления железа, ей соответствуют: РѕРєСЃРёРґ Fe2O3 Рё РіРёРґСЂРѕРєСЃРёРґ Fe(OH)3 (РѕР±Р° — коричневого цвета), соли железа(III) — (образуют кристаллогидраты, РІ растворах сильно гидролизованы). Рў.Рє. РѕРєСЃРёРґ железа(III) проявляет слабые основные свойства, РѕРЅ частично растворим РІ РєРѕРЅС†. щелочах, Р° РїСЂРё сплавлении СЃРѕ щелочами образует соотв. соли — ферриты: Fe2O3 + 2NaOH = 2NaFeO2 + H2O↑ РџСЂРё растворении ферриты нацело гидролизуются.
Смешаный РѕРєСЃРёРґ, Fe3O4 или FeO*Fe2O3, («Р¶РµР»РµР·РЅР°СЏ окалина») можно рассматривать также как феррит железа(II): Fe(FeO2)2. РџСЂРё взаимодействии его СЃ растворами кислот образуется смесь солей железа (II) Рё (III).
Для железа РІ степени окисления +2 Рё +3 характерно образование многочисленных комплексных соединений, например таких как гексацианоферрат(II) калия K4[Fe(CN)6] («Р¶РµР»С‚ая кровяная соль») Рё гексацианоферрат(III) калия K3[Fe(CN)6] («РєСЂР°СЃРЅР°СЏ кровяная соль»). РџСЂРё взаимодействии РёРѕРЅРѕРІ Fe3+ Рё [Fe(CN)6]4- выпадает СЏСЂРєРѕ-СЃРёРЅРёР№ осадок гексацианоферрата(II) калия-железа(III) (берлинская лазурь): FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl. Рто качественная реакция для обнаружения РёРѕРЅРѕРІ Fe3+.
Аналогичная реакция используется для открытия РёРѕРЅРѕРІ железа(II): FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCl; («С‚урнбулева СЃРёРЅСЊ»).
Степень окисления +6 — Ферраты — соли РЅРµ существующей РІ СЃРІРѕР±РѕРґРЅРѕРј РІРёРґРµ железной кислоты H2FeO4.
Рто соединения фиолетового цвета, РїРѕ окислительным свойствам напоминающие перманганаты, Р° РїРѕ растворимости — сульфаты. Ферраты — сильные окислители.
Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи: 2Fe(OH)3 + 3Cl2 + 10KOH = 2K2FeO4 + 6KCl + 8H2O
Применение
— Железо является основным компонентом сталей Рё чугунов — важнейших конструкционных материалов.
— Железо может входить РІ состав сплавов РЅР° РѕСЃРЅРѕРІРµ РґСЂСѓРіРёС… металлов — например, никелевых.
— Железо применяется РІ качестве анода РІ железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Биологическая роль и физиологическое действие
Железо входит в состав гемоглобина крови, обеспечивая, за счет своих окислительно-восстановительных свойств, ее важнейшую функцию, транспорт кислорода в ткани организма. В крови взрослого человека содержится около 4 г железа, его недостаток приводит к заболеванию железодефицитной анемией. Восполнить недостаток железа можно за счет пищевых продуктов, содержащих железо в хорошо усвояемой форме (печень, мясо, бобовые) или медикаментов.
�збыточное накопление железа в организме оказывает токсическое действие. ПДК железа в воде 0,3 мг/л.
Аксенова �рина, Пуртова Ксения, ТюмГУ, 502(1) группа, 2013 г.
Источник: http://www.kontren.narod.ru/x_el/info26.htm
Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа
Данный урок посвящен изучению темы «Свойства железа». Вы познакомитесь со свойствами химического элемента железа, строением его атома и характерными степенями окисления. Также в уроке будут рассмотрены физические и химические свойства простого и сложных веществ, образованных железом.
- I. Фильм: “Физические и химические свойства железа”
- II. «Появление железа»
- Появление железа в человеческой цивилизации положило начало железному веку.
Откуда же древние люди брали железо в то время, когда еще не умели добывать его из руды? Железо в переводе с шумерского языка – это металл, “капнувший с неба, небесный”. Первое железо, с которым столкнулось человечество, было железом из метеоритов. Впервые доказал, что “железные камни падают с неба”, в 1775 г. русский ученый П.С.
Палас, который привез в Петербург глыбу самородного железного метеорита весом 600 кг. Самым крупным железным метеоритом является найденный в 1920 г. в Юго-Западной Африке метеорит “Гоба” весом около 60 т. Вспомним гробницу Тутанхамона: золото, золото. Великолепная работа восхищает, блеск слепит глаза. Но вот что пишет К.
Керрам в книге “Боги, гробницы, ученые” о маленьком железном амулете Тутанхамона: “Амулет относится к числу наиболее ранних изделий Египта, и …в гробнице, наполненной чуть ли не до отказа золотом, именно эта скромная находка имела наибольшую с точки зрения истории культуры ценность”.
Всего несколько железных изделий было найдено в гробнице фараона, среди них железный амулет бога Гора, небольшой кинжальчик с железным клинком и золотой рукояткой, маленькая железная скамеечка “Урс”.
Ученые предполагают, что именно страны Малой Азии, где проживали племена хеттов, были местом возникновения черной металлургии. В Европу железо пришло из Малой Азии уже в I тыс. до н.э.; так в Европе начался железный век.
Знаменитую булатную сталь (или булат) делали на Востоке еще во времена Аристотеля (IV в. до н.э.). Но технология ее изготовления держалась в секрете много веков.
Мне приснилась иная печальПро седую дамасскую сталь.Я увидел, как сталь закалялась,Как из юных рабов одногоВыбирали, кормили его,Чтобы плоть его сил набиралась.Выжидали положенный срок,А потом раскаленный клинокВ мускулистую плоть погружали,Вынимали готовый клинок.Крепче стали, не видел Восток,
Крепче стали и горше печали.
Поскольку булат – это сталь с очень большой твердостью и упругостью, изготовленные из нее изделия обладают способностью не тупиться, будучи остро заточенными. Раскрыл секрет булата русский металлург П.П. Аносов. Он очень медленно охлаждал раскаленную сталь в специальном растворе технического масла, подогретого до определенной температуры; в процессе охлаждения сталь ковалась.
- III. Положение железа в периодической таблице химических элементов и строение его атома
- Железо — это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar(Fe) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
- Схема строения атома:
Источник: https://kardaeva.ru/dlya-uchenika/9-klass/94-uroki/252-zhelezo-polozhenie-zheleza-v-periodicheskoj-sisteme-i-stroenie-ego-atoma-nakhozhdenie-v-prirode-fizicheskie-i-khimicheskie-svojstva-zheleza




