Подпишись на наш Instagram, если хочешь сдать экзамены на отлично! @shpory_2020_
Простейшим циклоалканом является циклопропан

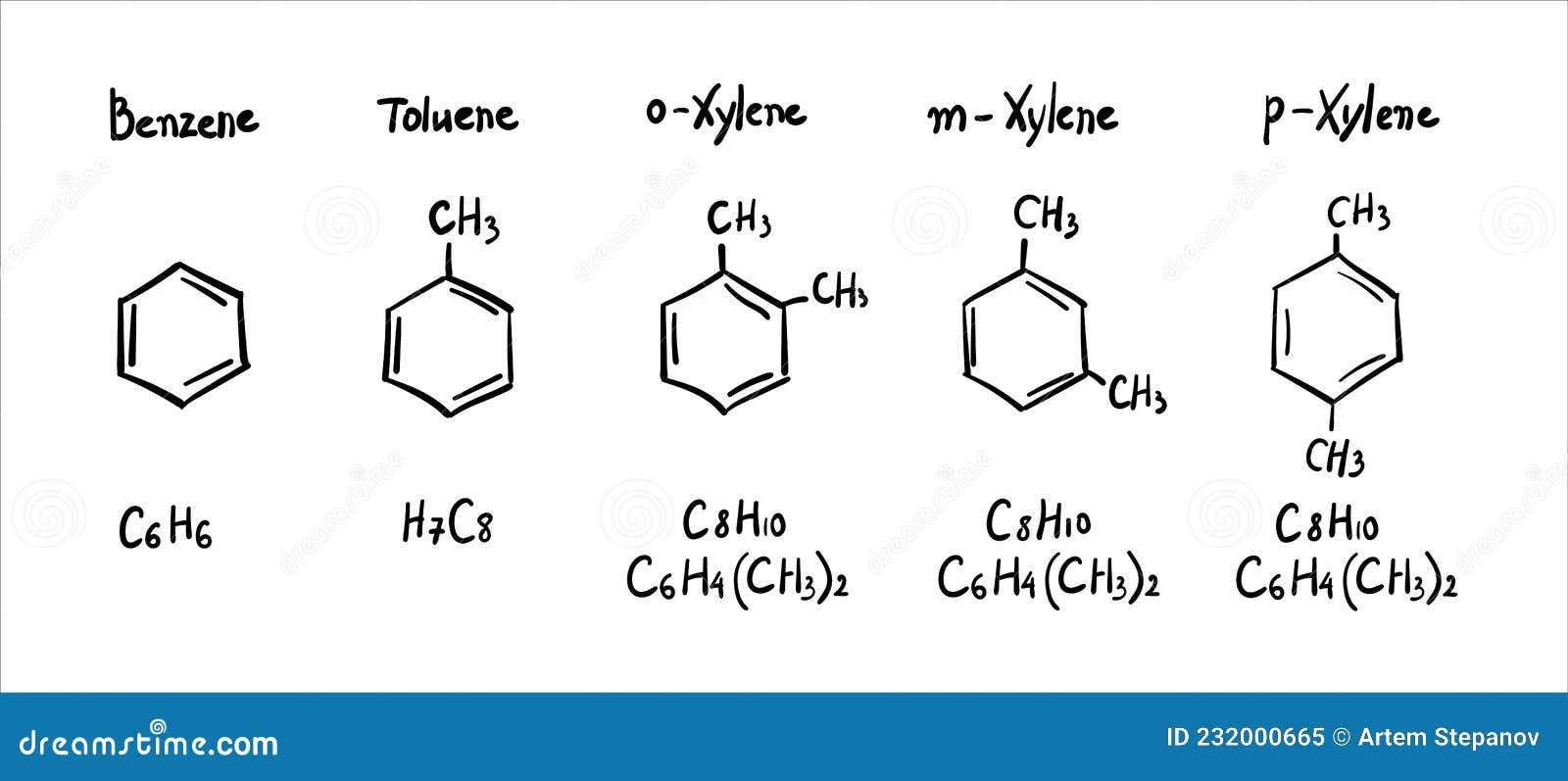
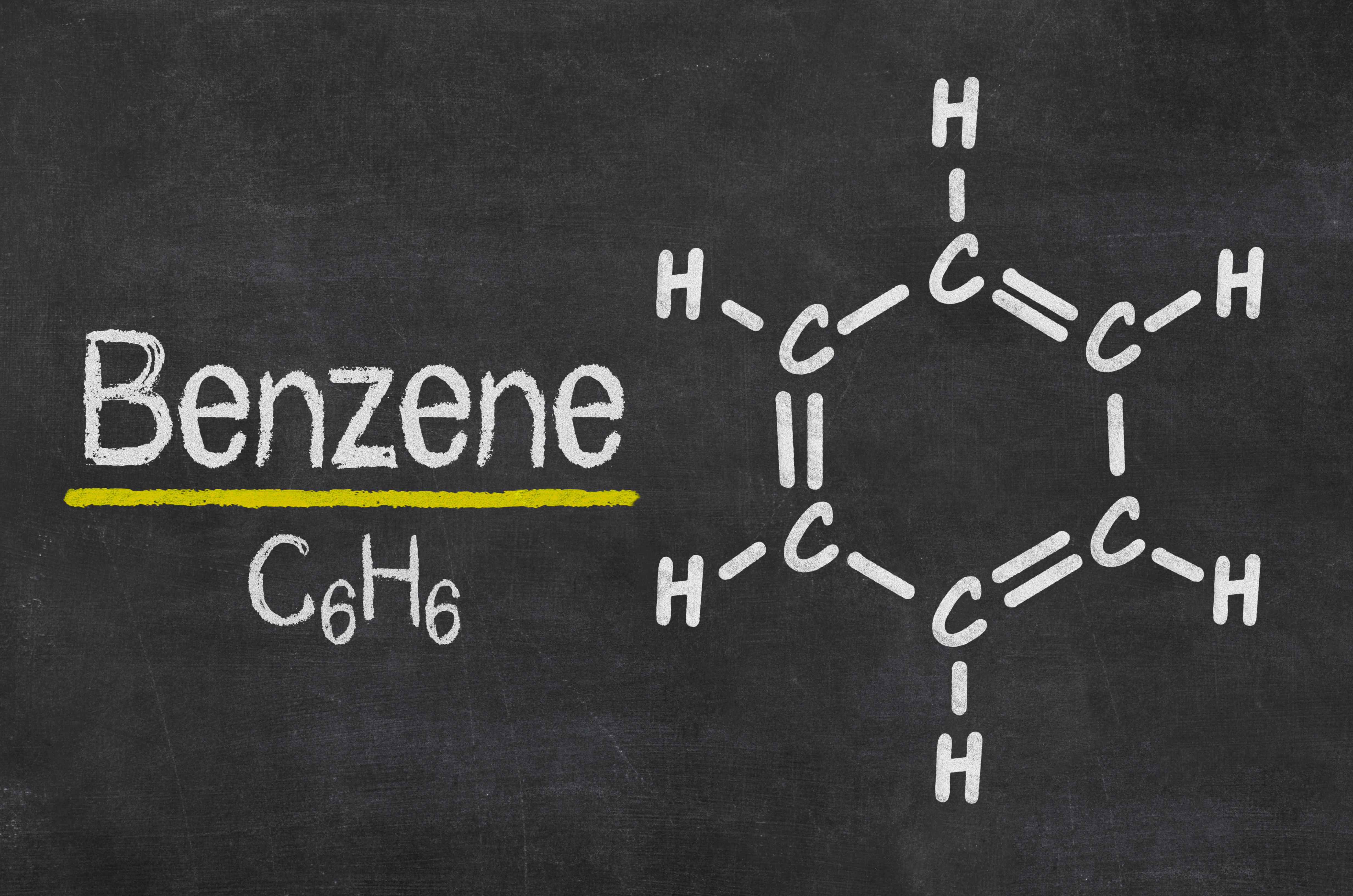
Молекулярная формула бензола — $mathrm{C_6H_6}.$
Бензол изображается таким образом потому, что хотя и является ненасыщенным соединением, не вступает в реакцию присоединения.
а) Молекула бензола имеет плоскостное строение.

Ароматическими соединениями являются а) и г)
Уравнение реакции:
Массовая доля углерода больше в молекуле бензола (меньше относительная молекулярная масса), чем в молекуле циклогексана.
Массовая доля углерода в бензоле:$omegamathrm{(C)}=dfrac{n·M_{эл.}}{M_{вещ.}};$ $omegamathrm{(C)}=dfrac{6·12}{78}=0.9231.$
Массовая доля углерода в циклогексане:$omegamathrm{(C)}=dfrac{n·M_{эл.}}{M_{вещ.}};$ $omegamathrm{(C)}=dfrac{6·12}{84}=0.8571.$

Молекулярная формула бензола $mathrm{C_6H_6},$ молекулярная формула изображённого углеводорода $mathrm{C_7H_8},$ то есть разница $mathrm{CH_2}$ — гомологическая разность.
- Дано: $mmathrm{(C_6H_5Br)}=7.85,г$
- Найти: $mmathrm{(C_6H_6)}-?$
- Решение:
- 1) Определим химическое количество бромбензола:$M_rmathrm{(C_6H_5Br)}=6A_rmathrm{(C)}+5A_rmathrm{(H)}+A_rmathrm{(Br)}=$ $72+5+80=157;$$Mmathrm{(C_6H_5Br)}=157$ г/моль;
$n=dfrac{m}{M};$ $nmathrm{(C_6H_5Br)}=dfrac{7.85,г}{157,г/моль}=0.05$ моль.
2) Составляем уравнение реакции для определения химического количества и массы израсходованного бензола:
$mathrm{ overset{x,моль}{dfrac{C_6H_6}{1,small{моль}}}+overset{0.05,моль}{dfrac{Br_2}{1,small{моль}}}(AlBr_3)
ightarrow C_6H_5Br+HBr }$$dfrac{x}{1}=dfrac{0.05}{1};$ $x=0.05$ моль;$m=n·M;$ $M_rmathrm{(C_6H_6)}=6A_rmathrm{(C)}+6A_rmathrm{(H)}=78;$
$Mmathrm{(C_6H_6)}=78$ г/моль; $mmathrm{(C_6H_6)}=0.05,small{моль}·78,small{г/моль}=3.9,small{г}.$
Ответ: $mmathrm{(C_6H_6)}=3.9,small{г}.$


Решение:

Источник: https://superresheba.by/resh/3340
Бензол — это… Что такое Бензол?
| Другие названия | фен (Лоран, 1837), фениловый водород, бензен |
| Молекулярная формула | C6H6 |
| SMILES | c1ccccc1 C1=CC=CC=C1 |
| Молярная масса | 78,11 г/моль |
| Вид | Синяя жидкость |
| Регистрационный номер CAS | 71-43-2 |
| ГОСТ | 8448-78 |
| Плотность и фазовое состояние | 0,8786 г/см³=878,6 кг/м³, жидкость |
| Растворимость в воде | 1,79 г/л при 25 °C |
| Температура плавления | 5,5 °C |
| Температура кипения | 80,1 °C |
| Вязкость | 0,652 П при 20 °C |
| Описание | Токсичен, опасен для окружающей среды, огнеопасен |
| Температура воспламенения паров | −11 °C |
| Температура самовозгорания | 562 °C |
| Близкие углеводороды | нафталин циклогексан |
| Производные | толуол |
| Если не указано другое, параметры даны для 25 °C, 100 кПа |
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом. Простейший ароматический углеводород.
Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей.
Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен.
История
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной 1651 году[1].
Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля.
Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физик-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К шестидесятым годам XIX-го века было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn.
Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода[2].
Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось на тот момент наиболее полно описать свойства бензола. [3]
Физические свойства
Бензол (жидкий)
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- Взаимодействие с хлором в присутствии катализатора:
- С6H6 + Cl2 -(FeCl3)→ С6H5Cl + HCl образуется хлорбензол
- Катализаторы содействуют созданию активной электрофильной частицы путём поляризации между атомами галогена.
- Cl-Cl + FeCl3 → Clઠ-[FeCl4]ઠ+
- С6H6 + Clઠ—Clઠ+ + FeCl3 → [С6H5Cl + FeCl4] → С6H5Cl + FeCl3 + HCl
- В отсутствие катализатора при нагревании или освещении идёт радикальная реакция замещения.
- С6H6 + 3Cl2 -(освещение)→ C6H6Cl6 образуется смесь изомеров гексахлорциклогексана
видео
- Взаимодействие с бромом (чистый):
- С6H6 + Br2 -(FeBr3 или AlCl3)→ С6H5Br + HBr образуется бромбензол
видео - С6H6 + С2H5Cl -(AlCl3)→ С6H5С2H5 + HCl образуется этилбензол
- С6H6 + HNO3 -(H2SO4)→ С6H5NO2 + H2O
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n-6), но в отличие от углеводородов ряда этилена C2H4 проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения) только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением всех связей и молекул на одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Производство
На сегодняшний день существует три принципиально различных способа производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 1 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования;
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
- Тримеризация ацетилена
- При пропускании ацетилена при 400°C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды:
- 3С2Н2 → С6H6
Применение
Значительная часть получаемого бензола используется для синтеза других продуктов:
В существенно меньших количествах бензол используется для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Ввиду высокой токсичности его содержание новыми стандартами ограничено введением до 1 %.
Биологическое действие
При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался.
В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория.
Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными.
В этом случае хроническое отравление бензолом может стать причиной лейкемии и анемии. Сильный канцероген.
Бензол и токсикомания
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Ссылки
Примечания
Источник: https://dic.academic.ru/dic.nsf/ruwiki/17383
Физические и химические свойства бензола
ОПРЕДЕЛЕНИЕ
Бензол (циклогексатриен – 1,3,5) – органическое вещество, простейший представитель ряда ароматических углеводородов.
Формула – ( mathrm{C} 6 mathrm{H} 6 ) (структурная формула – рис. 1). Молекулярная масса – 78, 11.
Рис. 1. Структурные и пространственная формулы бензола.
Все шесть атомов углерода в молекуле бензола находятся в sp2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое ( pi )-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла.
Углеводородный радикал, полученный от бензола носит название C6H5 – — фенил (Ph-).
- Химические свойства бензола
- Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
- — галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных ( mathrm{AlCl} 3, mathrm{FeCl} 3, mathrm{AlBr} 3 ))
- ( mathrm{C} 6 mathrm{H} 6+mathrm{Cl} 2=mathrm{C} 6 mathrm{H} 5-mathrm{Cl}+mathrm{HCl} );
- — нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
- ( mathrm{C}_{6} mathrm{H}_{6}+mathrm{HNO}_{3} frac{mathrm{H} 2 mathrm{SO}_{4}}{
ightarrow} mathrm{C}_{6} mathrm{H}_{5}-mathrm{NO}_{2}+mathrm{H}_{2} mathrm{O} ) - — алкилирование по Фридею-Крафтсу
- — алкилирование алкенами
- ( mathrm{C} 6 mathrm{H} 6+mathrm{CH} 2=mathrm{CH}-mathrm{CH} 3
ightarrow mathrm{C} 6 mathrm{H} 5-mathrm{CH}(mathrm{CH} 3) 2 ); - Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
- — гидрирование (реакция протекает при нагревании, катализатор – Pt)
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – ( mathrm{CGH} 6 mathrm{Cl} 6 ))
- Как и любое органическое соединение бензол вступает в реакцию горения с образованием в качестве продуктов реакции углекислого газа и воды (горит коптящим пламенем):
- ( 2 mathrm{C} 6 mathrm{H} 6+15 mathrm{O} 2
ightarrow 12 mathrm{CO} 2+6 mathrm{H} 2 mathrm{O} ). - Физические свойства бензола
Бензол – жидкость без цвета, но обладающая специфическим резким запахом. Образует с водой азеотропную смесь, хорошо смешивается с эфирами, бензином и различными органическими растворителями. Температура кипения – ( 80,1^{circ} mathrm{C} ), плавления – ( 5,5^{circ} ). Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний).
- Получение и применение бензола
- Основные способы получения бензола:
- — дегидроциклизация гексана (катализаторы – ( mathrm{Pt}, mathrm{Cr}_{3} mathrm{O}_{2} ))
- ( mathrm{CH}_{3}-left(mathrm{CH}_{2}
ight)_{4^{-}} mathrm{CH}_{3}
ightarrow mathrm{C}_{6} mathrm{H}_{6}+4 mathrm{H}_{2} uparrow ); - — дегидрирование циклогексана (реакция протекает при нагревании, катализатор – ( mathrm{Pt} ))
- ( mathrm{C}_{6} mathrm{H}_{12}
ightarrow mathrm{C}_{6} mathrm{H}_{6}+4 mathrm{H}_{2} uparrow ); - — тримеризация ацетилена (реакция протекает при нагревании до ( 600^{circ} ), катализатор – активированный уголь)
- ( 3 mathrm{HC} equiv mathrm{CH}
ightarrow mathrm{C}_{6} mathrm{H}_{6} ).
Бензол служит сырьем для производства гомологов (этилбензола, кумола), циклогексана, нитробензола, хлорбензола и др. веществ. Ранее бензол использовали в качестве присадки к бензину для повышения его октанового числа, однако, сейчас, в связи с его высокой токсичностью содержание бензола в топливе строго нормируется. Иногда бензол используют в качестве растворителя.
- Примеры решения задач
- ПРИМЕР 1
Запишите уравнения, с помощью которых можно осуществить следующие превращения: ( mathrm{CH} 4
ightarrow mathrm{C} 2 mathrm{H} 2
ightarrow mathrm{C} 6 mathrm{H} 6
ightarrow mathrm{C} 6 mathrm{H} 5 mathrm{Cl} ).
- Для получения ацетилена из метана используют следующую реакцию:
- ( 2 mathrm{CH}_{4}
ightarrow mathrm{C}_{2} mathrm{H}_{2}+3 mathrm{H}_{2} uparrowleft(mathrm{t}^{circ}=1400^{circ} mathrm{C}
ight) ). - Получение бензола из ацетилена возможно по реакции тримеризации ацетилена, протекающей при нагревании ( t^{circ}=600^{circ} C ) и в присутствии активированного угля:
- ( 3 mathrm{C}_{2} mathrm{H}_{2}
ightarrow mathrm{C}_{6} mathrm{H}_{6} ). - Реакция хлорирования бензола с получением в качестве продукта хлорбензола осуществляется в присутствии хлорида железа (III):
- ( mathrm{C}_{6} mathrm{H}_{6}+mathrm{Cl}_{2}
ightarrow mathrm{C}_{6} mathrm{H}_{5} mathrm{Cl}+mathrm{HCl} ). - ПРИМЕР 2
К 39 г бензола в присутствии хлорида железа (III) добавили 1 моль бромной воды. Какое количество вещества и сколько граммов каких продуктов при этом получилось?
Запишем уравнение реакции бромирования бензола в присутствии хлорида железа (III):
( mathrm{C}_{6} mathrm{H}_{6}+mathrm{Br}_{2}
ightarrow mathrm{C}_{6} mathrm{H}_{5} mathrm{Br}+mathrm{HBr} ).
Продуктами реакции являются бромбензол и бромоводород. Молярная масса бензола, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 78 г/моль. Найдем количество вещества бензола:
( mathrm{n}left(mathrm{C}_{6} mathrm{H}_{6}
ight)=mathrm{m}left(mathrm{C}_{6} mathrm{H}_{6}
ight) / mathrm{M}left(mathrm{C}_{6} mathrm{H}_{6}
ight) );
( nleft(C_{6} H_{6}
ight)=39 / 78=0,5 ) моль.
По условию задачи бензол вступил в реакцию с 1 моль брома. Следовательно, бензол находится в недостатке и дальнейшие расчеты будем производить по бензолу.
Согласно уравнению реакции ( nleft(C_{6} H_{6}
ight) : nleft(C_{6} H_{5} B r
ight) : n(H B r)=1 : 1 : 1 ), следовательно ( nleft(C_{6} mathrm{H}_{6}
ight)=nleft(C_{6} H_{5} B r
ight)=: n(H B r)=0,5 )моль.
Тогда, массы бромбензола и бромоводорода будут равны:
( mathrm{m}left(mathrm{C}_{6} mathrm{H}_{5} mathrm{Br}
ight)=mathrm{n}left(mathrm{C}_{6} mathrm{H}_{5} mathrm{Br}
ight) imes mathrm{M}left(mathrm{C}_{6} mathrm{H}_{5} mathrm{B} mathrm{r}
ight) );
( mathrm{m}(mathrm{HBr})=mathrm{n}(mathrm{HBr}) imes mathrm{M}(mathrm{HBr}) ).
Молярные массы бромбензола и бромоводорода, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 157 и 81 г/моль, соответственно.
- ( mathrm{m}left(mathrm{C}_{6} mathrm{H}_{5} mathrm{Br}
ight)=0,5 imes 157=78,5 mathrm{г} ); - ( mathrm{m}(mathrm{HBr})=0,5 imes 81=40,5 mathrm{г} ).
Продуктами реакции являются бромбензол и бромоводород. Массы бромбензола и бромоводорода – 78,5 и 40,5 г, соответственно.
Источник: https://sciterm.ru/spravochnik/fizicheskie-i-himicheskie-svojstva-benzola/
Плотность бензола и толуола при различных температурах
Приведены таблицы значений плотности бензола C6H6 и толуола C7H8 при различных температурах. Плотность в таблицах дана для жидкого состояния этих веществ в размерности кг/м3.
Бензол и толуол относятся к ненасыщенным ароматическим углеводородам (гомологический ряд CnH2n−6) и при нормальных условиях представляют собой жидкости легче воды с резким специфическим запахом.
Молярная масса бензола составляет 78,11 г/моль, толуола — 92,13 г/моль. Бензол является более тяжелой жидкостью — его плотность при 20 градусах Цельсия выше плотности толуола на 14%.
При нормальном атмосферном давлении бензол существует в виде жидкости при температурах от 5,5°С. Его температура кипения составляет 80,1°С. Выше температуры кипения плотность бензола приведена в таблице при давлении, превышающем 760 мм. рт. ст.
Плотность бензола при 20°С составляет величину 879 кг/м3 и при нагревании снижается. При температуре кипения она становится равной 815 кг/м3. Образующиеся в процессе кипения пары бензола имеют плотность 2,69 кг/м3.
| 7 | 910 | 80 | 815 |
| 20 | 879 | 90 | 804 |
| 30 | 869 | 100 | 793 |
| 40 | 858 | 120 | 769 |
| 50 | 847 | 130 | 757 |
| 60 | 836 | 140 | 745 |
| 70 | 826 | 150 | 733 |
Толуол в жидком виде (при нормальном атмосферном давлении) существует лишь в интервале температуры выше -95°С и закипает при 110,6°С. Значения плотности жидкого толуола даны в таблице в более широком диапазоне: от -90 до 150°С.
Плотность толуола при 20°С имеет значение 867 кг/м3. При росте температуры толуол, как и бензол, расширяется и становится менее плотным. Например, при температуре 100°С его плотность снижается до величины 790 кг/м3.
Следует отметить, что при температуре 150 градусов плотность толуола становится равной этому показателю у бензола и составляет 733 кг/м3. Кроме того, при дальнейшем нагреве толуола выше температуры 320°С достигается его минимальная (критическая) плотность, равная 290 кг/м3.
| -90 | 970 | 30 | 858 |
| -80 | 960 | 40 | 848 |
| -70 | 951 | 50 | 839 |
| -60 | 941 | 60 | 829 |
| -50 | 932 | 70 | 820 |
| -40 | 923 | 80 | 810 |
| -30 | 913 | 90 | 800 |
| -20 | 904 | 100 | 790 |
| -10 | 895 | 110 | 780 |
| 886 | 120 | 766 | |
| 10 | 876 | 130 | 755 |
| 20 | 867 | 140 | 744 |
| 25 | 862 | 150 | 733 |
Источники:
Источник: http://thermalinfo.ru/svojstva-zhidkostej/organicheskie-zhidkosti/plotnost-benzola-i-toluola-pri-razlichnyh-temperaturah
ПОИСК
Изучение механизма превращений бензола, циклогексана и метилциклопентана с помощью меченых атомов (гидрогенизации подвергались смеси этих веществ, в которых один из компонентов метился радиоактивным углеродом показало (см. табл.
54), что в начальный период действительно происходит накопление циклогексана, но при длительном контакте его количество уменьшается. Однако если меченым компонентом является бензол, удельная радиоактивность метилциклопентана выше активности циклогексана [c.
230] Слон бензола (удельный вес 0,88) расположится над раствором, а слой хлороформа (удельный вес 1,49)—под раствором. Хлороформ и бензо.т можно заменить четыреххлористым углеродом СС (удельный вес 1,60). [c.
140]
Никелевые катализаторы представляют собой восстановленный металлический никель на носителях (окиси алюминия, окиси хро ма и др ) Как было показано на примере гидрирования бензола, удельная каталитическая активность поверхности никеля на разных носителях остается примерно одинаковой (см табл. 2).
Аналогичная картина наблюдается и при гидрировании фенола. Измерение удельной каталитической активности никеля, нанесенного на окись церия, показало, что при парофазном гидрировании фенола она сохраняется постоянной в широком диапазоне содержания никеля в катализаторе [14] [c.89]
Сольвент (ГОСТ 1928—53) — каменноугольный, ЧМТУ 5787—57 — тяжелый и ВТУ МНП 614—57 —нефтяной)—жидкость бесцветная или от бледно-желтого до коричневого цвета, представляет собой смесь ароматических углеводородов бензольного ряда (ксилолы, толуол, триметилбензол и др.), получается в процессе очистки сырого бензола. Удельный вес — 0,865+ 0,02 температура начала перегонки сольвента каменноугольного 1 сорта 120° С, [c.235]
А как исходного, так и равновесного растворов метилового красного в бензоле. Удельная гидратированная поверхность в м 1г рассчитывается по формуле [c.105]
Какое количество углерода-14 необходимо иметь для приготовления 50 г бензола удельной активностью 0,25 мкюри/г [c.67]
Физических потерь хлора вообще не должно быть, поскольку проскок хлора в отходящие газы не допускается, но хлор может связываться примесями бензола и теряться вместе с физически теряемым хлорбензолом, что в предыдущем расчете не учтено. Отсюда следует, что возможность экономии хлора невелика и зависит главным образом от качества бензола. Удельный расход хлора можно снизить примерно на 9 кг, т. е. до 680 кг. [c.110]
В работе [11] установлено, что в реакции гидрирования бензола удельная каталитическая активность палладия на цеолитах значительно выше его активности на других носителях.
Это было связано с изменением электронного состояния палладия в результате его взаимодействия с кислотным носителем.
Очевидно, в последнем случае влияние матрицы на каталитические свойства металла должно возрастать по мере увеличения дисперсности металлических частиц. [c.82]
П pH м е ч а ни е. Таблица составлена по данным аналитической лаборатории завода. Карболит . Для приготовления спиртобензольных смесей был взят этиловый спирт 96,45% и бензол удельного веса 0,896 при 151. [c.34]
Пористые полимеры являются сорбентами с регулируемой структурой.
Подбор условий синтеза (соотношения исходных мономеров, количества и типа разбавителя) позволяет обеспечить достаточно развитую поверхность полимерных сорбентов при минимальном содержании мелких пор и, соответственно, достижение высоких критериев газохроматографического разделения.
Так, для пористых полимеров на основе стирола и дивинилбензола, в частности, установлено, что с увеличением содержания сшивающего агента (дивинил бензола) удельная поверхность возрастает, а суммарный объем пор изменяется по кривой с максимумом.
Одновременно наблюдается уменьшение плотности образцов и степени их набухания [29]. На сорбентах с большим содержанием сшивающего агента достигаются высокие значения критерия разделения, удельного удерживаемого объема, высокая эффективность разделения [30]. [c.5]
Удельный вес, проба с водой, всплываемость с раствором соли, проба с бензолом Удельный вес, содержание кетонов, бромное число, кислотное число [c.105]
Данный процесс позволяет создать гибкое промышленное производство стирола, бензола и фенолов 13 толуола и природного газа.
Себестоимость и удельные капитальные вложения при производстве стирола окислительным метилированием толуола в 1,5 раза ниже соответствующих показателей производства стирола на основе бензола и этилена.
Внедрение этого процесса возможно при достаточных ресурсах толуола. [c.176]
Первый порядок по мономеру и зависимость от корня квадратного из интенсивности света при фотохимической полимеризации были проверены для большого числа систем и при значительном изменении условий опыта.
Из экспериментальных значений скорости полимеризации получена эмпирическая константа скорости = кр (2ф a/A ()V2. В таких опытах можно измерить 1а — удельную скорость поглощения света, но измерения ф довольно сложны.
Один из методов состоит в использовании инициаторов, таких, как перекись бензола РЬСО — 00 — СОРЬ образующиеся из нее свободные радикалы фенил Рй или бензоил РЬСОО могут быть определены в полученном полимере.
В принципе на одну цепь должно приходиться но одному бензольному кольцу, это позволяет подсчитать значение ф. С другой стороны, можно определить средний молекулярный вес образовавшегося мономера и сделать вывод о числе инициированных цеией. Это также дает возможность подсчитать ф. [c.516]
В данном случае, как и при анализе смеси бензола и толуола, определяется удельное поглощение чистого соединения. Используются следующие аналитические длины волн. [c.284]
Для нахождения адсорбции при мономолекулярном заполнении (х) ограничиваются построением изотермы приблизительно по десяти точкам, охватывающим интервал относительных давлений от О до 0,5—0,6. Суммарную и удельную поверхности навесок вычисляют по приведенным ранее формулам, приняв элементарную площадку молекулы бензола равной 39 А . [c.81]
Удельная теплота плавления бензола равна 29,92 кал г температура плавления /пл.=5,5 °С. Следовательно, изменение энтропии 1 г бензола при плавлении (энтропия плавления) равно [c.93]
Для производств, работающих без нагрева, но с весьма летучими веществами по удельному весу тяжелее воздуха (спирто-эфирный слив, ацетои. сероуглерод), происходит- накопление высоких концентраций их паров в нижней зоне помещений.
В таких производствах отсос должен быть не менее двух третей воздуха из нижней зоны и одной трети из верхней. В производствах, применяющих бензол, толуол и другие растворители и где имеет место нагрев, происходит значительное накопление паров в верхних зонах.
В этом случае следует удалять из верхней зоны не менее двух третей воздуха и из нижией зоны одной трети. [c.309]
Асфальтены представляют собой порошкообразные вещества от темно-бурого до черного цвета. Они аморфны, не плавятся при нагревании, но при температурах выше 300° С разлагаются с образованием кокса и большим выделением газов. Асфальтены хрупки.
Удельный вес их больше 1 они нерастворимы в нефтяном эфире и легко растворяются в бензоле, сероуглероде, хлороформе, четыреххлористом углероде и т. д. Адсорбируются подобно смолам. Нефтяные асфальтены содержат серу и кислород, причел серы содержится всего лишь 0,5 — 1,5%, тогда как в асфальтенах из природных асфальтов количество серы доходит до 12%.
Нефтяные асфальтены являются продуктом дальнейшего изменения смол, а именно — результатом их уплотнения. [c.100]
Белый нли белый с желто-зелеиоватым оттенком кристаллический порошок, легко растворим в воде, растворим в спирте, практически не растворим в эфире н бензоле. Удельный показатель поглощения Е при длине волны 256 тр, от 610 до 650 (0,001% раствор в 0,01 н. растворе соляной кислоты) т. пл. 232—240°. [c.273]
Как видно из данных габл. 1, ви всех опытах, когда бы.1 мечен бензол, удельная активность метилциклопентана I ьиис циклогексана, а в опытах с меченым циклогексаном отношс- ие обратное.
Это в полном соответствии с данными работ [2, 3] доказывает, что метилциклолентан образуется иг только из циклогексана, но и непосредственно из бензола без десорбции в объем промежуточных продуктов с поверхпости катализатора. [c.55]
Радиоактивные вещества. Запаянные ампулы со смесью органических веществ, меченных С или Т (в том числе с эквимолярной смесью циклогексана, бензола, толуола), удельной активностью 1 мккюри. Запаянная ампула с меченым бензолом удельной акт ивностью 1 мккюри. Препарат радиоактивного s (эталон) активностью 50 000—100 000 илт мин. [c.162]
Автор настоящей статьи в течение некоторого времени разрабатывал простой метод полевого разделения берилла и кварца -и пришел к выводу, что предлагаемый ниже метод, при условии тщательного его выполнения, мог бы заметно облегчить решение этой трудной задачи.
Определение основано на различии относительной плотности этих двух минералов в разделительных диффузионных колонках со смесью бромоформа и бензола.
Удельный вес чистого кварца равен 2,65, а удельный вес чистого берилла, по Дэнну, находится в пределах от 2,63 до 2,80 обычно же он равен 2,69—2,70. [c.78]
Рис. 1,а показывает изменение удельной электропроводности раствора AI I3 в хлористом этиле при —78,5°, при постепенной замене хлористого этила бензолом. При прибавлении бензола удельная электропроводность повышается, как уже много лет [c.272]
Катализаторы, содержащие никель на 02 и алюмосиликате, изучались и в других реакциях — гидрогенизации циклопропана 200] и гидрировании бензола [201].
В первом случае было обнаружено так же, как и при исследовании гидрогенолиза этана, сильное влияние носителя на активность и селективность никеля (процесс идет по двум направлениям — гидрогенизация циклопропана до пропана и гидрогенолиз до этана и метана).
Так, удельная активность N1 на ЗЮг оказалась в 16 раз выше по сравнению с N1 на АЬОз—5102 в реакции гидрогенизации и в 44 раза выше в реакции гидрогенолиза. Во втором случае те же препараты, которые были изучены в реакции гидрогенолиза этана, сравнивались по активности в реакции гидрирования бензола.
Удельная активность катализаторов, содержащих 1 и 10% N1 на ЗЮг (см. табл. 9), в этом процессе оставалась примерно одинаковой, в то время как размер частиц изменялся в 2 раза. Таким образом, был установлен факт [201] независимости активности катализаторов N1—ЗЮ2 в реакции гидрирования бензола от степени дисперсности никеля.
Совершенно иная картина наблюдалась в случае N1—АЬОз 3102. Наряду с незначительным изменением размера кристаллов N1 (26 и 29 А, см. табл. 9), активность катализаторов в гидрировании бензола с уменьшением концентрации N1 до 1% резко падает, что, по-видимому, объясняется влиянием носителя.
В этой части цити-зуемая работа подтверждает результаты Хилла и Селвуда 202], согласно которым удельная активность катализаторов —АЬОз в той же реакции резко уменьшается с понижением концентрации N1 в области 8%, а препараты с содержанием N мелкие частицы менее активны. Напротив, активность катализаторов N1—3102 в области 1% N1, как уже было сказано, не отличается от активности 10%-ного образца. [c.63]
Обращает на себя вникание увеличение, по сравнению с бензолом, удельного веса индукционного эффекта в случае передачи влияния иэ второго в четвёртое положение в Фура-не. В случае пурина имеет место обратное явление из шестого положения во второе передаётся практически только эффект сопряжения, э о,о. [c.257]
При этом процессе масляная фракция, содержащая парафин, смешивается с растворителем высокого удельного веса. Вследствие этого фаза масло — растворитель имеет более высокий удельный вес, чем выделяющийся парафин [38]. Для этой цели применяют смеси бензола (22% объем .) и дихлорэтана (78% объеми.
) или других хлорированных углеводородов, как трихлорэтилен, четыреххлористый углерод и т. д. Таким путем удается непрерывно выделять парафин независимо от его кристаллического строения. Обычно весовое соотношение растворителя и масла поддерживают равным 3 1.
Выделенный парафин смешивают с холодным растворителем и снова центрифугируют, получая парафпп с весьма низким содержанием масла. [c.47]
Фракция с т. кип. до ПС получена в весьма незначительном количестве (по-видимому, бензол) и указывает на присутствие циклогексана. Удельный вес и показатель преломления толуола, ныделенного нами, оказались несколько более высокими по сравнению с описанными в литературе. Это различие, по-видимому, обусловливается примесью бензола. [c.63]
Деароматизация фракции 150—200°С проводилась серной кислотой с удельным весом 1,84, а фракции с температурой кмпения 200—250°С — силикагелем марки КСМ , с активностью по бензолу 11,1. [c.126]
Смешано 500 мл бензола (СсНб) и 300 мл толуола (СбНбСНз). Определить состав смеси а) в весовых процентах б) в объемных процентах в) в молярных процентах г) в моль/л, если принять удельный вес бензола 0,88, а толуола 0,87. При подсчете пренебречь температурным коэффициентом рас-п и, 0ния толуола и бензола и изменением их объема при смешении. [c.25]
В дальнейшем для более глубокого понимания механизма дегидроциклизации алканов в присутствии оксидных катализаторов был использован [21] кинетический изотопный метод, с помощью которого удалось исключить из приведенной выше схемы ряд стадий (2, 3, 6, 10).
Так, в опытах со смесями н-гексан — циклогексан- С удельная радиоактивность циклогексана не уменьшалась, т. е. из гексана не образуется нерадиоактивный циклогексан. Это означает, что последний не является промежуточным продуктом в процессе ароматизации н-гексана.
В то же время в опытах со смесями гексан — гексен- С в катализате обнаружено заметное уменьшение мольной радиоактивности гексена, что, очевидно, вызвано разбавлением меченого олефина нерадиоактивным гексеном, образующимся при дегидрировании гексана.
Полученный бензол обладал большей мольной радиоактивностью, чем непрореагировавший гексен, что говорит об образовании бензола через гексен [147]. Существенным фактом является появление в катализате меченых гексадиенов (из гемсена- С). Опыты по арома- [c.238]
Два важных свойства адсорбента—коэффициент разделения а и скорость адсорбции — в бсльшой степени зависят от среднего диаметра пор. Избирательное действие адсорбента проявляется только по отношению к тому слою молекул, который прилегает к его поверхности. Отсюда ясна зависимость избирательной адсорбции от удельной поверхности.
По-видимому, жидкость, находящаяся в центре поры, имеет тот же состав, что и жидкость вне адсорбента. Вследствие этого величина коэффициента разделения должна убывать по мере увеличения диаметра поры. С другой стороны, увеличение диаметра поры благоприятствует увеличению скорости адсорбции.
Для некоторых сортов силикагеля величина среднего диаметра поры только немного больше утроенного диаметра молекулы бензола, и в результате относительно небольшого прироста величины диаметра поры скорость адсорбции может значительно увеличиться. Идеальным является такой адсорбент, в котором достигнуто необходимое равновесие между избирательностью и скоростью адсорбции.
По мере увеличения размеров молекулы или вязкости адсорбата влияние скорости адсорбции на процесс становится более ощутимым. [c.160]
Асфальты в собственном смысле слова нерастворимы в спиртоэфирной смеси и в петролейном эфире. Они заметно растворимы в бензоле, хлороформе, сероуглероде, метилэтилнетоне (Шварц) ив циклогексане.
Они тверды при обыкновенной температуре, имеют удельный вес выше единицы и пла(вятся выше 100°, при частичном разложении. Они имеют стедующий элементарный состав С—86—90% Н—6—8,5% 8-н0,6—1,4% О—1,1—6,8% X—следы.
[c.116]
Лесли, разлагая нарафнинстый керосин в угольной трубке, нагретой до 815°, выделил олефины, третью часть которых составлял пропилен. Кабеляк пропускал пары парафина из Борислава в токе СОз через трубку, нагретую до G00—800—1000°.
При 600° 60% разл енного парафина выделялись в виде газа и 36% в виде жидкого конденсата с удельным весам 0,770 и с содержанием парафиновых углеводородов 11,8% (арсматические углеводороды отсутствовали) при 800° —18% жидких продуктов с удельным, весом 0,910, среди них бензол и толуол при 1000° — полное разложение на элементы. [c.244]
Эти смолы представляют полужидкие или твердые вещества удельного веса несколько более 1 с температурой размягчения выше 10° С и совершенно растворимые в легком бензине, бензоле, хлороформе и эфире. Смолы содержат кис.11ород и являются первым цродуктом действия кщслорода на тящедые углеводороды. По мне- [c.99]
Источник: https://www.chem21.info/info/1288863/




