Сколько глауберовой соли (Na2SO4 ⋅ 10H2O) и воды (в граммах) необходимо взять, чтобы приготовить 710 грамм 10-процентного раствора сульфата натрия (Na2SO4)?
Решение задачи
Найдем, какая масса сульфата натрия (Na2SO4) содержится в 710 г 10-процентного раствора по формуле:
![]()
- Получаем:
- m (Na2SO4) = 710 ⋅ 0,1 = 71 (г).
- Если раствор 10-процентный, то массовая доля сульфата натрия (Na2SO4) в нем 0,1.
- Рассчитаем молярные массы сульфата натрия (Na2SO4) и глауберовой соли (Na2SO4 ⋅ 10H2O):
- M (Na2SO4) = 142 (г/моль),
- M (Na2SO4 ⋅ 10H2O) = 142 + 10 ⋅ 18 = 322 (г/моль).
- Учитывая, что в 1 моль глауберовой соли (Na2SO4 ⋅ 10H2O) содержится 1 моль сульфата натрия (Na2SO4) и то, что молярные массы глауберовой соли (Na2SO4 ⋅ 10H2O) и сульфата натрия (Na2SO4) соответственно равны 322 и 142 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
- Получаем:
- m (Na2SO4) = 142 (г),
- m (Na2SO4 ⋅ 10H2O) = 322 (г).
- Найдем, какое количество (в граммах) глауберовой соли (Na2SO4 ⋅ 10H2O) содержит 71 г сульфата натрия (Na2SO4). Составим пропорцию:
- в 322 г глауберовой соли содержится 142 г Na2SO4
- в х г глауберовой соли содержится 71 г Na2SO4
- Откуда:
![]()
 глауберова соль
глауберова соль
Следовательно масса глауберовой соли (Na2SO4 ⋅ 10H2O), которую необходимо взять для приготовления заданного раствора, равна 161 г.
Вычислим массу воды, которую нужно взять для приготовления заданного раствора, по формуле:
![]()
Получаем:
m (H2O) = 710 – 161 = 549 (г).
Ответ:
масса глауберовой соли равна 161 грамм; масса воды равна 549 грамм.
Источник: https://himik.pro/rastvory/glauberova-sol-prigotovlenie-rastvora
Сульфат натрия: формула и применение
Содержание
Рассказать ВКонтакте Поделиться в Одноклассниках Поделиться в Facebook
Применение сульфата натрия (Na2SO4) связано с изготовлением шампуней, порошков, слабительных медицинских препаратов, продуктов питания.
Химический элемент используется химической, текстильной, кожевенной промышленностями.
Он обладает как рядом преимуществ, так и недостатков, среди которых ломкость волос при мытье шампунями, где присутствуют ингредиенты производного типа лаурил- и лауретсульфаты.
Что такое сульфат натрия
Сульфат натрия – это вещество, имеющее название-аналог натрия сернокислого и определяющего целый класс солей серной кислоты из разряда натриевых.
Глауберова соль – это декагидрат вышеуказанной субстанции, применяемый ранее для очищения кишечника после отравления как слабительное.
В современной Америке и России с этой целью сернокислый натрий вместе с его гидратами не разрешено применять как одиночное действующее вещество.

Формула
Формула сульфата натрия в его безводном варианте обозначается как Na2SO4 с молярной массой 142 г/моль, не имеет цвета, обладает кристаллической формой.
В природных условиях безводный натриевый сульфат находится как минерал тенардит. До температуры тридцати четырех градусов элемент устойчив.
Если увеличить температуру и добавить воду, вещество преобразуется в глауберову соль (название минерала – мирабилит).
Свойства
Свойства сульфата натрия следующие:
- форма кристаллов – ромбовидная;
- цвет отсутствует;
- кипение и плавление происходит без разложения;
- в воде растворение проходит быстро;
- реакция с водородом запускается при температурном диапазоне от 550 до 600 градусов;
- вступает во взаимодействие с серной кислотой.
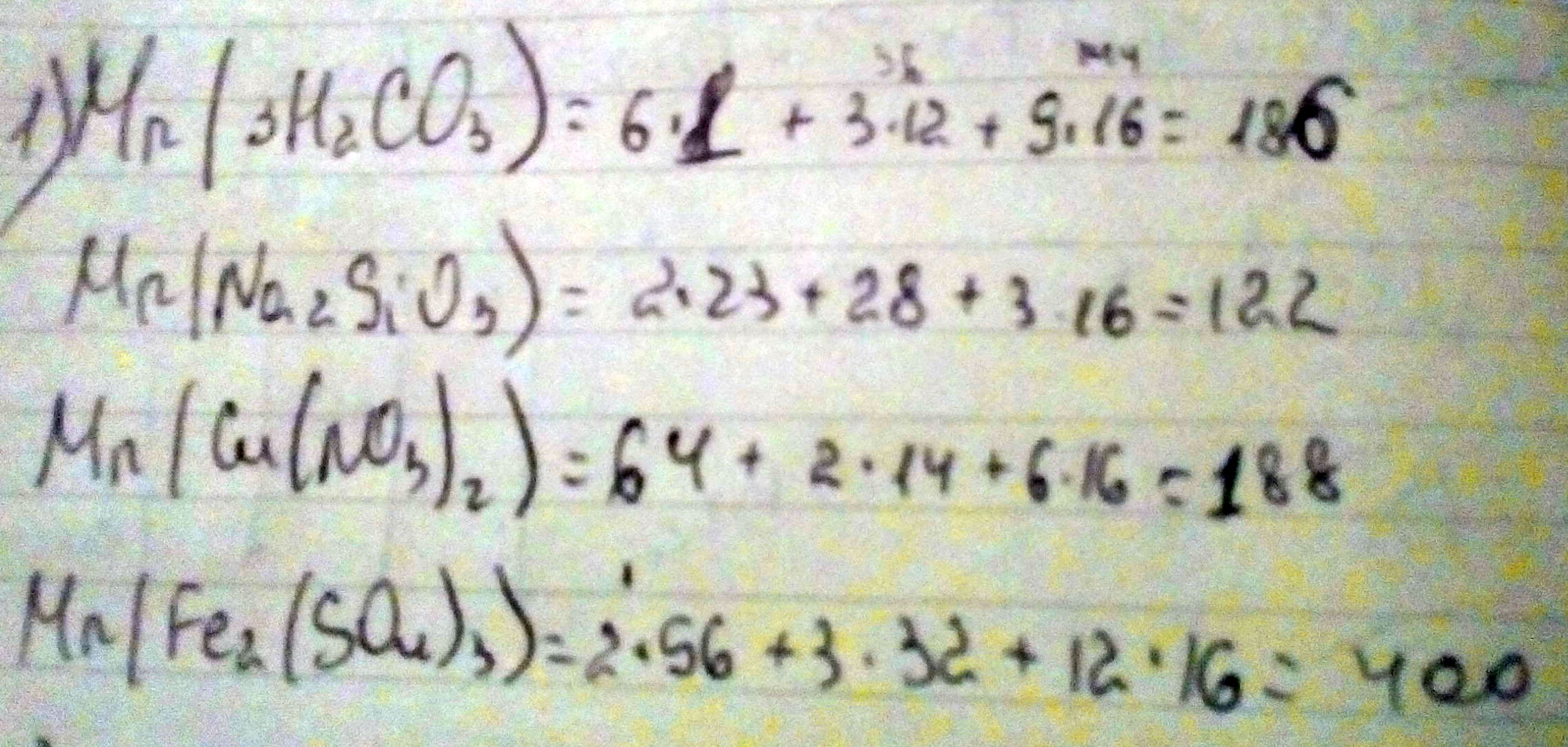
Применение сульфата натрия в промышленности
Применение сульфата натрия в промышленности имеет много ответвлений, начиная от производства стиральных порошков, заканчивая использованием как пищевой добавки. Сферы использования:
- Пищевая промышленность. Раствор сульфата натрия добавляется к продуктам под кодом E514 для регулирования кислотности, отбеливания, увеличения срока сохранности пищи, стабилизатора окраски. Производители отправляют его в вяленую рыбную продукцию, законсервированные фрукты, овощи, желе, мармелад, кондитерские изделия, приправы. На молекулярном уровне вещество связывает ацетальдегид в вине, предотвращая окисление напитка. Для здоровья добавка вредна, как и все вещества с присутствием E, она оказывает разрушительное действие на витамины E, B1.
- Химическая и косметическая промышленность. Для изготовления моющих средств: шампуня, порошка, геля для душа, средства для мытья полов.
- Медицина. Встречается в препаратах, оказывающих слабительный эффект, замедляет всасывание яда в кишечнике.
- Может встречаться как средство обезвоживания в научных лабораториях для замещения сульфата магния, так как стоит дешевле, а получение отнимает меньше времени.
- Другие сферы применения – производство стекла, цветная металлургия, кожевенная и текстильная промышленность.
Сульфат натрия в шампунях
На этикетке он обозначается SLS (sodium laureth sulfate) – это лауретсульфат натрия, изобретенный первоначально для мытья танков во время второй мировой войны, но из-за отличных качеств по отмыванию и красивой пенки вещество перешло в косметическую промышленность. Сульфат натрия в шампунях присутствует очень часто. Еще более концентрированным и вредным считается лаурилсульфат.

Хотя слух о связи лаурет- и лаурилсульфатов с возникновением рака был опровергнут американским токсикологическим колледжем, эти компоненты оказывают определенное плохое действие на кожу и волосы.
Если слишком часто применять шампуни с этими добавками, можно получить сухие, тусклые волосы, воспаление кожи головы.
Натуральные заменители: лаурил глюкозид, лаурет сульфосукцинат, кокоглюкозид могут меньше пениться, но более полезны для умывания.
Натрий сернокислый
Элемент способствует выведению желчи, препятствует всасыванию отравляющих веществ.
Натрий сернокислый задерживает жидкость в кишечнике, а ее накопление стимулирует перистальтику и опорожнение желудочно-кишечного тракта.
Такой эффект вещества используется для производства солевых слабительных препаратов. Имеет вид порошка, который нужно пить как водный раствор. Начинает действовать спустя 5 часов после приема внутрь.
Инструкция по применению
Показания:
- подготовительный этап перед хирургическим вмешательством в кишечник;
- затяжные запоры;
- отравление едой;
- совместно с другими препаратами для очищения от гельминтов.
Инструкция по применению сульфата натрия:
Перед употреблением порошок заливается кипяченой теплой водой (четвертью стакана) из расчета 1 грамм на год жизни для ребенка и от 15 до 30 грамм для взрослого. Пьется натощак.
Нельзя употреблять беременным, людям с воспалительными заболеваниями ЖКТ, во время кормления грудью, месячных, при геморрое. Стоит воздержаться от его применения старикам и людям с сильным истощением организма.
Перед употреблением стоит получить одобрение доктора и внимательно прочесть инструкцию.
Видео
 Чем опасны сульфаты и парабены
Чем опасны сульфаты и парабены
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Источник: https://sovets.net/12303-sulfat-natriya.html
Молярная масса сульфата натрия
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!

Температура кипения 1430oС, плавления 884oС. Хорошо растворяется в воде (не гидролизуется).
Рис. 1. Сульфат натрия. Внешний вид.
Брутто-формула сульфата натрия – Na2SO4. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
- Mr(Na2SO4) = 2×Ar(Na) + Ar(S) + 4×Ar(O);
- Mr(Na2SO4) = 2×23 + 32 + 4×16 = 46 + 32 + 64 = 142.
- Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса сульфата натрия равна 142 г/моль.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
ru.solverbook.com
Сульфат натрия Na2SO4
Сульфат натрия
- Средняя соль серной кислоты h3SO4 и гидроксида натрия NaOH.
- Химическая формула
- Na2SO4
Получение
Природные источники
Сульфат натрия встречается в виде минерала тенардита, а кристаллогидрат Na2SO4.10h3O – в виде мирабилита или глауберовой соли.
Лабораторные методы получения
- Сульфат натрия получают взаимодействием серной кислоты с гидроксидом или карбонатом натрия:
- h3SO4 + 2NaOH = Na2SO4 + 2h3O;
- h3SO4 + Na2CO3 =Na2SO4 + h3O + CO2↑.
Получение сульфата натрия в промышленности
- В промышленности сульфат натрия получали из хлорида натрия и серной кислоты:
- h3SO4 + 2NaCl =Na2SO4 + 2HCl↑,
- но сейчас это не имеет смысла – достаточно природных источников.
Свойства сульфата натрия
Физические свойства
Свойство Описание
| Внешний вид | Кристаллическое вещество белого цвета |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см3 |
| Температура плавления | 883°С |
| Cтандартная мольная энтальпия образования при 298К ΔH°298, кДж/моль | −1387,9 (т)2 |
| Стандартная мольная энтропия при 298 К S°298, Дж/(моль•К) | 149,58 (т) |
| Стандартная мольная теплоемкость при 298 К Cp298, Дж/(моль•К) | 127,3 |
| Растворимость в воде, г/100 г | при 0°С — 4,5 при 20°С — 19,2 при 32,4°С — 49,8 при 100°С — 42,3 |
Химические свойства
- При растворении в воде сульфат натрия диссоциирует на ионы:
- Na2SO4↔ 2Na++ SO42-.
- Раствор имеет нейтральную реакцию.
- При взаимодействии с кислотами образует кислые соли:
- Na2SO4 + HСl = NaHSO4 + NaCl.
- Вступает в реакции обмена с образованием нерастворимых сульфатов:
- Na2SO4 + CaCl2 = 2NaCl + CaSO4↓,
- Na2SO4 + SrCl2 = 2NaCl + SrSO4↓,
- Na2SO4 + BaCl2 = 2NaCl + BaSO4↓.
Применение
Сульфат натрия используют как компонент шихты в производстве стекла; используется при сульфатной варке целлюлозы, при крашении хлопчато-бумажных тканей.
Применяется он также и в химической промышленности как сырье для получения силикатов Na, Na2S, h3SO4, (Nh5)2SO4, соды и др. В медицине сульфат натрия изредка применяют как слабительное.
В пищевой промышленности он известен как пищевая добавка Е514. Сульфат натрия используют в качестве регулятора кислотности.
Относится к малоопасным веществам (4 класс опасности), но при передозировке в пищевых продуктов приводит к расстройствам пищеварения.
Пример решения задачи с сульфатом натрия
- Назовите 5 способов получения сульфата натрия.
- Решение
- h3SO4 + 2NaOH = Na2SO4 + 2h3O;
- h3SO4 + Na2CO3 =Na2SO4 + h3O + CO2↑;
- SO3 + Na2O = Na2SO4;
- NaHSO4 + NaOH = Na2S04 + h30;
- h3SO4 + 2NaHCO3 =Na2SO4 + 2h3O + 2CO2↑.
- studwork.org
Сульфат натрия — это… Что такое Сульфат натрия?
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
Свойства
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10h3O.
Нахождение в природе
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10h3O образует минерал мирабилит (глауберову соль).
Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4h3O, глауберит Na2SO4·CaSO4.
Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
Промышленный способ получения сульфата натрия — взаимодействие NaCl с h3SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается соляная кислота.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья. Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют для получении сульфатной целлюлозы, в текстильной, кожевенной промышленности и в цветной металлургии.
В медицине и ветеринарии ранее широко использовался в качестве солевого слабительного средства, применяется также как компонент в средствах для промывания носа.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
Зарегистрирован в качестве пищевой добавки E514.
См. также
Литература
- Реми Г. Курс неорганической химии. Т.2. — М., 1966
Ссылки
dic.academic.ru
Сульфат натрия: свойства и все характеристики
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!

Кристаллизуется из водных растворов с десятью молекулами воды (Na2SO4×10h3O) и в таком виде называется глауберовой солью по имени немецкого врача и химика И.Р. Глаубера, который первым получил её действием серной кислоты на хлорид натрия.
Рис. 1. Сульфат натрия. Внешний вид.
Таблица 1. Физические свойства сульфата натрия.
| Молекулярная формула | Na2SO4 |
| Молярная масса | 142 |
| Плотность (20oС), г/см3 | 2,68 |
| Температура плавления, oС | 883 |
| Растворимость в воде (20oС), г/100 мл | 19,2 |
Получение сульфата натрия
Основной промышленный способ получения сульфата натрия мало чем отличается, от того, что использовал И.Р. Глаубер, когда впервые получил эту соль. Реакция обмена между серной кислотой и хлоридом натрия, проводимая при нагревании до 500oС в специальной печи:
2NaCl + h3SO4 = Na2SO4 + 2HCl↑.
Кроме этого сульфат натрия встречается в природе в виде минерала тенардита (безводный) и мирабилита (гидрат).
Химические свойства сульфата натрия
- В водном растворе сульфат натрия диссоциирует на ионы:
- Na2SO4↔ 2Na+ + SO42-.
- Твердый сульфат натрия взаимодействует с концентрированнойсерной кислотой
- Na2SO4 + h3SO4 (conc) = 2NaHSO4 (solution).
- Вступает в реакции обмена с кислотными оксидами (1), гидроксидами (2) и солями (3):
- Na2SO4 + SO3 = Na2S2O7 (1);
- Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH (2);
- Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl (3).
- Сульфат натрия восстанавливается водородом (4) и углеродом (5):
- Na2SO4 + 4h3 = Na2S + 4h3O (t = 550 – 600oC6 kat = Fe2O3) (4);
- Na2SO4 + 2C + CaCO3 = Na2CO3 + CaS + CO2 (t = 1000oC) (5).
Применение сульфата натрия
Безводный сульфат натрия применяется для изготовления стекла. Раньше эту соль использовали в качестве одного из составляющих стиральных порошков и другим моющих средств. Кроме этого сульфат натрия нашел применение в текстильной промышленности, кожевенном деле, производстве цветных металлов, а также в химическом анализе.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
ru.solverbook.com
Сульфат натрия
- Сульфат натрия
- ГОСТ 4166-76
- Na2SO4
- Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
- Сернокислый натрий может быть в качестве гранул или порошка белого цвета, в некоторых случаях допускается серый оттенок.
Сульфат натрия (сернокислый натрий) представляет собой бесцветные кристаллы.
Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10h3O.
Получение сульфата натрия:
- Промышленный способ получения сульфата натрия — взаимодействие NaCl с h3SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
- В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
- Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
2 N a C l + H 2 S O 4 ⟶ N a 2 S O 4 + 2 H C l {displaystyle {mathsf {2NaCl+H_{2}SO_{4}longrightarrow Na_{2}SO_{4}+2HCl}}}
Применение сульфата натрия:
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тыс. тонн сульфата натрия.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Cернокислый натрий (сульфат натрия) нередко применяется в стекольном производстве. Кроме этого, данный продукт используют в цветной металлургии, кожевенной, текстильной промышленности, для получения сульфатной целлюлозы.
Помимо этого, сульфат натрия нашел свое применение в медицине и ветеринарии. В этих областях он применяется как компонент в средствах, предназначенных для промывания носа, а также как солевое слабительное средство.
Он известен и как пищевая добавка.
Этот продукт в небольших количествах используется и в химических лабораториях как обезвоживающее средство.
Стоит отметить и то, что сернокислый натрий (сульфат натрия) нашел широкое применение и в строительстве. Там он необходим как ускоритель схватывания бетонной смеси и в качестве противоморозной добавки. Используется он и как наполнитель при изготовлении синтетических моющих средств.
Зарегистрирован в качестве пищевой добавки E514.
himmax.ru
Сульфат натрия безводный
- Сульфат натрия безводный
- ГОСТ 4166-76
- Na2SO4
- Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
- Сернокислый натрий может быть в качестве гранул или порошка белого цвета, в некоторых случаях допускается серый оттенок.
Сульфат натрия (сернокислый натрий) представляет собой бесцветные кристаллы.
Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10h3O.
Получение сульфата натрия:
- Промышленный способ получения сульфата натрия — взаимодействие NaCl с h3SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
- В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
- Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение сульфата натрия:
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тыс. тонн сульфата натрия.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Cернокислый натрий (сульфат натрия) нередко применяется в стекольном производстве. Кроме этого, данный продукт используют в цветной металлургии, кожевенной, текстильной промышленности, для получения сульфатной целлюлозы.
Помимо этого, сульфат натрия нашел свое применение в медицине и ветеринарии. В этих областях он применяется как компонент в средствах, предназначенных для промывания носа, а также как солевое слабительное средство.
Он известен и как пищевая добавка.
Этот продукт в небольших количествах используется и в химических лабораториях как обезвоживающее средство.
Стоит отметить и то, что сернокислый натрий (сульфат натрия) нашел широкое применение и в строительстве. Там он необходим как ускоритель схватывания бетонной смеси и в качестве противоморозной добавки. Используется он и как наполнитель при изготовлении синтетических моющих средств.
Зарегистрирован в качестве пищевой добавки E514.
himmax.ru
Формула сульфата натрия в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – белое кристаллическое вещество. Плавится и кипит без разложения.
Образует кристаллогидрат с формулой .
Химические свойства сульфата натрия
- Сульфат натрия хорошо растворяется в воде (гидролиз отсутствует), среда раствора нейтральная:
- При нагревании до температуры взаимодействует с водородом:
- Вступает в реакции обмена:
- Реагирует с концентрированной серной кислотой:
Получение
Сульфат натрия можно получить, например, при взаимодействии хлорида натрия с концентрированной серной кислотой:
Данная соль также образуется при взаимодействии сульфида натрия с кислородом при температуре выше :
Применение
- Сульфат натрия раньше широко применялся в моющих средствах.
- В России он используется для этих целей до сих пор.
- Данная соль находит применение в стекольной промышленности, в органическом синтезе, в неорганических лабораториях, в текстильной промышленности и в цветной металлургии.
- Зарегистрирован как пищевая добавка E514.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
ru.solverbook.com
Источник: https://blogsummit.ru/zdorove/molyarnaya-massa-sulfata-natriya.html
Тиосульфат натрия
Тиосульфат натрия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
Содержание
- 1 Получение
- 2 Физические и химические свойства
- 3 Применение

- окислением полисульфидов Na;
- кипячение избытка серы с Na2SO3:
Na2SO3 + S → Na2S2O3
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
4SO2 + 2H2S + 6 NaOH → 3Na2S2O3 + 5H2O
- кипячение избытка серы с гидроксидом натрия:
4 S + 6 NaOH → 2Na2S + Na2S2O3 + 3H2O
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
2NaNO2 + 2 S → Na2S2O3 + N2O
- растворение сульфида натрия в воде в присутствии кислорода воздуха:
2Na2S + 2 O2 + H2O → Na2S2O3 + 2 NaOH
Физические и химические свойства
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль.
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C)).
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100оС.
При нагревании до 220 °C распадается по схеме:
4Na2S2O3 → 3Na2SO4 + Na2S + 4 S
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Na2S2O3 + 4 Cl2 + 5H2O → 2H2SO4 + 2 NaCl + 6 HCl
Более слабыми или медленно действующими окислителями, например, йодом, переводится в соли тетратионовой кислоты:
2Na2S2O3 + I2 → Na2S4O6 + 2 NaI
Приведённая реакция очень важна, так как служит основой йодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия йодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Na2S2O3 + H2SO4 → Na2SO4 + H2O + S + SO2
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
Применение
- для удаления следов хлора после отбеливания тканей;
- для извлечения серебра из руд;
- фиксаж в фотографии;
- реактив в йодометрии;
- противоядие при отравлении: As, Br, Hg и другими тяжёлыми металлами, цианидами (переводит их в роданиды) и др.;
- для дезинфекции кишечника;
- для лечения чесотки (совместно с соляной кислотой);
- противовоспалительное и противоожоговое средство;
- как среда для определения молекулярных весов по понижению точки замерзания (криоскопическая константа 4,26°);
- в пищевой промышленности зарегистрирован в качестве пищевой добавки E539;
- добавки для бетона;
- для очищения тканей от йода;
- марлевые повязки, пропитанные раствором тиосульфатом натрия, использовали для защиты органов дыхания от отравляющего вещества хлора в Первую мировую войну;
- антидот при передозировке лидокаина.
Источник: https://chem.ru/tiosulfat-natrija.html
Сульфат Натрия
Сернокислый натрий, натрия сульфат.
Химические свойства
Сульфат Натрия, что это? Данное химическое соединение – это натриевая соль серной кислоты. Формула Сульфат Натрия: Na2SO4. Это бесцветные кристаллы, устойчивые в безводной форме при температуре от 33 градусов Цельсия.
При температуре ниже средство образует кристаллогидраты, формула Na2SO4•10H2O. Соленый на вкус кристаллический порошок имеет молярную массу 142 грамма на моль.
В естественной среде вещество содержится в минерале тенардит, кристаллогидрат образует соединение мирабилит (глауберова соль). Вещество можно обнаружить в различных формах в рапе, на дне соленых озер.
Химические свойства. Что такое Сульфат Натрия? Формула Сульфат Натрия: Na2SO4.
Соединение проявляет свойства средней соли, так как образовано сильной серной к-ой и гидроксидом натрия (слабое основание).
Вещество не подвергается гидролизу, так как не имеет в составе «слабого иона». Смесь гидросульфата и Сульфата Натрия может вступить в реакцию с раствором гидроксида натрия.
При электролизе раствора (водного) Натрия Сульфата на катоде выделяется водород, а на аноде кислород (из воды), в результате в катодном пространстве происходит обогащение ионами натрия, в анодном – ионами SO42- и водорода.
Качественная реакция на Сульфат Натрия проводится по аналогии с качественной реакцией на сульфат-ионы.
К соли серной кислоты добавляют р-р хлорида бария, в результате чего образуется белый кристаллический осадок сульфата бария и соляная кислота.
Отличить сульфат- от сульфит -иона можно с помощью азотной кислоты (раствор), полученный осадок при ее добавлении не растворится.
Вещество можно получить в промышленных масштабах при взаимодействии хлорида натрия с серной кислотой в специализированных печах, при высокой температуре от 500 до 550 градусов, побочных продуктом реакции является хлороводород. Но в связи с наличием больших запасов природного сырья, этот метод не применяют.
Сульфат Натрия можно использовать на производстве синтетических чистящих и моющих средств; при производстве стекла и целлюлозы; средство используют в текстильной промышленности, цветной металлургии, в кожевельной промышленности.
Применяется в виде обезвоживающего средства в хим. лабораториях, в связи с тем, что оно дешево стоит и легко отфильтровывается. В медицине лекарство используют в качестве солевого слабительного и добавляют в состав растворов для промывания носа.
Средство используют в виде пищевой добавки под кодом E514.
Фармакологическое действие
Слабительное.
Фармакодинамика и фармакокинетика
Вещество постепенно всасывается в кишечнике, повышается осмотическое давление, начинает накапливаться жидкость, происходит раздражение рецепторов кишечной слизистой и усиление перистальтики ЖКТ. Каловые массы разжижаются и быстро эвакуируются. Происходит полное очищение кишечника по всей длине.
Эффект от приема солевого слабительного проявляется в течение 4-6 иногда 14 часов. Вещество также обладает желчегонными свойствами, его можно применять для ликвидации отечности.
Показания к применению
Натрия сульфат используют:
- в качестве слабительного средства при лечении острых запоров;
- во время подготовки к операциям, диагностическим и терапевтическим процедурам в области кишечника;
- при пищевом отравлении;
- для проведения противоглистной терапии для эвакуации продуктов жизнедеятельности и погибших паразитов.
Для чего внутривенно назначают тиосульфат натрия? Для лечения аллергии, невралгии, артрита.
Противопоказания
Средство противопоказано:
Побочные действия
- Понос, тошнота, кишечные колики, частые позывы к мочеиспусканию;
- Электролитные нарушения, сердечная аритмия, гипокалиемия, головокружение;
- Общая слабость, жажда, голод, озноб;
- Раздражение в перианальной области.
Сульфат Натрия, инструкция по применению (Способ и дозировка)
Раствор применяют в соответствии с рекомендациями врача. Назначают от 15 до 30 грамм вещества в р-ре за один прием. Для детей дозировку корректируют. Рекомендуется принимать лекарство на пустой желудок.
Передозировка
Нет данных о передозировке.
Взаимодействие
Диарея, возникающая после приема лек. средства может повлиять на процесс абсорбции других препаратов. Принимать лекарства рекомендуется не позднее, чем за час до начала эвакуации кала.
Условия продажи
Нужен рецепт.
Особые указания
- Во время лечения рекомендуется пить достаточное количестве воды и другой жидкости.
- Следует соблюдать осторожность при назначении препарата пациентам с сердечно-сосудистыми заболеваниями.
- При проявлении вздутия живота, метеоризма, сильных болей в области пищеварительной системы рекомендуется прервать лечение и обратится к врачу.
При беременности и лактации
Лекарство, как правило, не назначают во время беременности и при кормлении грудью.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Порошок для приготовления раствора Лавакол, Мовипреп; Галстена, Лимфомиозот, Натриум Сульфурикум Соль Доктора Шюсслера №10 и так далее.
Отзывы
Отзывов о Сульфате Натрия немного, его чаще всего применяют в условиях стационара или по рекомендации врача. Следует грамотно использовать лекарственное средство и соблюдать рекомендации специалистов, в таком случае, побочные реакции проявляться не будут.
Цена Натрия Сульфата, где купить
Купить Сульфат Натрия можно по рецепту в аптеке. Цена на препарат Лавакол примерно 170 рублей за 15 саше по 14 грамм слабительного.
Источник: https://medside.ru/sulfat-natriya
Сульфат натрия — это… Что такое Сульфат натрия?
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
Свойства
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Нахождение в природе
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль).
Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4.
Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается соляная кислота.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья. Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют для получении сульфатной целлюлозы, в текстильной, кожевенной промышленности и в цветной металлургии.
В медицине и ветеринарии ранее широко использовался в качестве солевого слабительного средства, применяется также как компонент в средствах для промывания носа.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
Зарегистрирован в качестве пищевой добавки E514.
См. также
Литература
- Реми Г. Курс неорганической химии. Т.2. — М., 1966
Ссылки
Источник: https://dic.academic.ru/dic.nsf/ruwiki/202007
Сульфат натрия
- Сульфат натрия
- ГОСТ 4166-76
- Na2SO4
- Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
- Сернокислый натрий может быть в качестве гранул или порошка белого цвета, в некоторых случаях допускается серый оттенок.
Сульфат натрия (сернокислый натрий) представляет собой бесцветные кристаллы.
Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Получение сульфата натрия:
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
2 N a C l + H 2 S O 4 ⟶ N a 2 S O 4 + 2 H C l {displaystyle {mathsf {2NaCl+H_{2}SO_{4}longrightarrow Na_{2}SO_{4}+2HCl}}}
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение сульфата натрия:
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тыс. тонн сульфата натрия.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Cернокислый натрий (сульфат натрия) нередко применяется в стекольном производстве. Кроме этого, данный продукт используют в цветной металлургии, кожевенной, текстильной промышленности, для получения сульфатной целлюлозы.
Помимо этого, сульфат натрия нашел свое применение в медицине и ветеринарии. В этих областях он применяется как компонент в средствах, предназначенных для промывания носа, а также как солевое слабительное средство.
Он известен и как пищевая добавка.
Этот продукт в небольших количествах используется и в химических лабораториях как обезвоживающее средство.
Стоит отметить и то, что сернокислый натрий (сульфат натрия) нашел широкое применение и в строительстве. Там он необходим как ускоритель схватывания бетонной смеси и в качестве противоморозной добавки. Используется он и как наполнитель при изготовлении синтетических моющих средств.
Зарегистрирован в качестве пищевой добавки E514.
Источник: http://himmax.ru/index.php/produktsiya/30-reaktivy/4701-sulfat-natriya
Массовая доля элемента в соединении: задачи
Массовая доля элемента в соединении показывает, какую долю составляет масса данного элемента в соединении.
Для того, чтобы рассчитывать массовую долю, нужно правильно рассчитывать молекулярную массу и обязательно учитывать число атомов каждого элемента.
Кстати, иногда требуется решить по химии и обратную задачу: зная массовую долю, составлять формулы. Теперь потренируемся на примерах.
pixabay.com
Пример 1.
Определите массовые доли элементов в сульфате натрия.
Решение:
Формула сульфата натрия Na2SO4. Молекулярная масса Na2SO4 2*23+32+4*16=142 (мы взяли атомные массы элементов из таблицы Менделеева и умножили их на нужные индексы: атомов натрия в формуле 2, атом серы 1, атомов кислорода 4).
- Рассчитываем массовые доли, составляя пропорции.
- Массовая доля натрия:
- 142 (молекулярная масса Na2SO4) – 100%
- 2*23 (берём атомную массу натрия, умноженную на 2, потому что у нас 2 атома Na) – X%
- X=2*23*100/142=32,4%
- Массовая доля серы:
- 142 (молекулярная масса Na2SO4) – 100%
- 32 (берём атомную S) –Y%
- Y=32*100/142=22,5%
- Массовая доля кислорода:
- 142 (молекулярная масса Na2SO4) – 100%
- 4*16 (берём атомную массу кислорода, умноженную на 4, потому что у нас 4 атома О) –Z%
- Z=4*16*100/142=45,1%
Ответ: в сульфате натрия массовая доля натрия 32,4%, массовая доля серы 22,5%, массовая доля кислорода 45,1% (проверим себя. При сложении всех массовых долей должно получиться 100%. У нас 32,4+22,5+45,1=100).
Пример 2
Это сложный пример, который может встретиться на огэ по химии. Но, разобравшись в нём без репетитора по химии, вы точно поймёте, что такое массовая доля. Итак, нужно определить массовые доли в нитрате меди (II).
Решение:
Формула нитрата меди (II) Cu(NO3)2. Обратите внимание, что здесь имеется кислотный остаток NO3, заключённый в скобки. Индекс 2 относится ко всему кислотному остатку! Это крайне важно для правильного расчёта! То есть в нашем соединении Cu(NO3)2 есть 1 атом меди Cu и два кислотных остатка NO3, то есть 2 атома азота и 2*3=6 атомов кислорода. Обязательно поймите это!
Теперь переходим к расчёту молекулярной массы Cu(NO3)2 (как всегда, берём атомные массы элементов из таблицы Менделеева). Она составляет 64+2*14+6*16=188. Далее рассчитываем массовые доли.
- Для меди:
- 188 – 100%
- 64 – Х%
- Х=64*100/188=34,0%
- Для азота:
- 188 – 100%
- 28 – Y%
- Y=28*100/188=14,9%
- Для кислорода:
- 188 – 100%
- 96 – Z%
- Z=96*100/188=51,1%
- Ответ: в нитрате меди (II) массовая доля меди 34,0%, массовая доля азота 14,9%, массовая доля кислорода 51,1% (для проверки сложим все массовые доли 34,0+14,9+51,1=100, всё верно).
Пример 3
Обратная задача. По массовым долям элементов в соединении нужно определить формулу. Известно, что в соединение входят калий К, марганец Mn и кислород О. Массовая доля калия 24,7%, массовая доля марганца 34,8%, массовая доля кислорода 40,5%. Определите формулу.
Решение:
У нас будет формула соединения
Нам нужно найти Х, Y и Z. Для начала найдём в периодической таблице атомные массы элементов: атомная масса калия 39, марганца 55, кислорода 16. Теперь вспомним, что массовая доля показывает нам вклад каждого элемента в массу вещества. Отсюда следует, что, разделив массовую долю на атомную массу, мы получим число атомов в соединении. То есть здесь:
· атомов калия 27,4/39=0,6 (27,4 – массовая доля калия, она дана в условии. 39 – атомная масса калия, взятая из таблицы Менделеева)
· атомов марганца 34,8/55=0,6 (34,8 – массовая доля марганца, она дана в условии. 55 – атомная масса марганца, взятая из таблицы Менделеева).
· атомов кислорода 40,5/16=2,5 (40,5 – массовая доля кислорода, она дана в условии. 16 – атомная масса кислорода, взятая из таблицы Менделеева)
Таким образом, у нас получились индексы Х, Y и Z, которые нам были нужны: Х=0,6, Y=0,6 и Z=2,5. Но индексы не могут быть нецелыми, ведь они показывают, сколько атомов элемента входит в вещества. А число атомов всегда целое. Поэтому наши дробные Х, Y и Z нужно привести к целому виду. Для этого мы просто разделим их все на наименьшее число (у нас это 0,6). Тогда получаем:
- Х=0,6/0,6=1,
- Y=0,6/0,6=1,
- Z=2,5/0,6=4 (тут получается чуть больше, но округляем до целого числа).
- Теперь мы знаем индексы и можем сказать, что соединение входит 1 атом калия, 1 атом марганца и 4 атома кислорода.
- Ответ: формула соединения KMnO4.
Пишите, пожалуйста, в х, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник: https://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/5c69a6882fc51a00ae4a9dc7
Сульфат натрия — Sodium sulfate
Сульфат натрия (также известный как сульфат натрия или сульфат соды ) представляет собой неорганическое соединение с формулой Na 2 SO 4 , а также нескольких родственных гидратов .
Все формы являются белыми твердыми веществами, которые хорошо растворимы в воде. С годовой производительностью 6 миллионов тонн , то декагидрат является основным товаром химических продуктов.
Он в основном используется для производства моющих средств и в процессе крафт бумаги варки целлюлозы .
формы
- Безводный сульфат натрия, известный как редкий минерал тенардит , используемый в качестве сушильного агента в органическом синтезе .
- Гептагидрат сульфат натрия, очень редкая форма.
- Десятиводной сульфат натрия, известный как минеральный мирабилит , широко используются химической промышленностью . Он также известен как глауберовой соли.
история
Декагидрат сульфата натрия известен как глауберовой соли после голландского / Немецкий химик и аптекарь Глаубер (1604-1670), который открыл его в 1625 году в австрийской родниковой водой.
Он назвал его сал Mirabilis (чудотворная соль), из — за своих целебных свойств: кристаллы были использованы в качестве общего назначения слабительного , до более сложных альтернатив не произошло в 1900 — х годах.
В 18 — м века, глауберова соль начала использовать в качестве сырья для промышленного производства кальцинированной соды ( карбонат натрия ), путем взаимодействия с калийным ( карбонатом калия ).
Спрос на кальцинированную соду увеличился и подаче сульфата натрия пришлось увеличить в линии.
Таким образом, в девятнадцатом веке, крупномасштабный Леблан процесс , производя синтетический сульфат натрия в качестве ключевого промежуточного соединения, стал основным методом производства кальцинированной соды.
Химические свойства
Сульфат натрия представляет собой типичный электростатический связанный ионный сульфат. Наличие свободного сульфата в растворе указывает легким образованием нерастворимых сульфатов , когда эти растворы обрабатывают Ba 2+ или Pb 2+ солей:
Na 2 SO 4 + BaCl 2 → 2 NaCl + BaSO 4
Сульфат натрия инертен по отношению к большинству окисляющих или восстанавливающих агентов . При высоких температурах, он может быть превращен в сульфид натрия путем карботермического (высокотемпературного нагрева с древесным углем и т.д.):
Na 2 SO 4 + 2 C → Na 2 S + 2 СО 2
Эта реакция была использована в процессе Леблан , отработавший промышленный маршрут к карбонатом натрия .
Сульфат натрия вступает в реакцию с серной кислотой с образованием кислой соли бисульфата натрия :
Na 2 SO 4 + Н 2 SO 4 ⇌ 2 NaHSO 4
Сульфат натрия показывает умеренную тенденцию к образованию двойных солей . Только квасцы , образованные с обычными трехвалентный металлами являются NaAl (SO 4 ) 2 (нестабильные выше 39 ° С) и NaCr (SO 4 ) 2 , в отличии от сульфата калия и сульфата аммония , которые образуют много стабильных квасцов.
Двойные соли с некоторыми другими щелочных сульфатов металлов известны, в том числе Na 2 SO 4 · 3K 2 SO 4 , который встречается в природе в виде минерала aphthitalite . Формирование глазерита по реакции сульфата натрия с хлоридом калия было использовано в качестве основы способа получения сульфата калия , а удобрение .
Другие соли включают в себя двойные 3NA 2 SO 4 · CaSO 4 , 3Na 2 SO 4 · MgSO 4 ( vanthoffite ) и NaF · Na 2 SO 4 .
Физические свойства
Сульфат натрия обладает необычными характеристиками растворимости в воде. Его растворимость в воде возрастает в десять раз больше , чем в пределах от 0 ° С до 32.384 ° С, где она достигает максимум 49,7 г / 100 мл.
В этой точке кривой растворимости меняет наклон, и растворимость становится практически не зависит от температуры. Эта температура , при 32.
384 ° С, что соответствует выпуску кристаллической воды и плавления гидратированной соли, служит в качестве точного опорного температуры для термометра калибровки .
График , показывающий растворимость Na 2 SO 4 от температуры.
Состав
Кристаллы декагидрата состоят из [Na (OH 2 ) 6 ] + ионы с октаэдрической молекулярной геометрии . Эти октаэдрические кромки таким образом, что доля восемь из 10 молекул воды , связанные с натрием и две другими являются интерстициальными, представляют собой водород , связанный с сульфатом.
Эти катионы связаны с сульфат — анионов через водородных связей . Расстояния Na-O в 240 ч . Кристаллический сульфат натрия декагидрат также необычна среди гидратированных солей в наличии измеримой остаточной энтропии (энтропия при абсолютном нуле ) от 6,32 Дж · К -1 · моль -1 .
Это приписывается его способность распределять воду гораздо быстрее , по сравнению с большинством гидратов.
производство
Мирового производства сульфата натрия, почти исключительно в виде декагидрата составляет примерно 5,5 до 6 миллионов тонн в год (мт / A). В 1985 году производство составило 4,5 млн т / а, половина из природных источников, а половина от химического производства.
После 2000 года на стабильном уровне до 2006 года, добыча природного увеличилась до 4 млн т / а, а химическое производство снизилось до 1,5 до 2 м / а, в общей сложности 5,5 до 6 Mt / а.
Для всех применений, естественно, производятся и химическим способом сульфат натрия практически взаимозаменяемыми.
Природные источники
Две трети мирового производства в декагидрата (глауберовой соли) от природной минеральной форме мирабилита , например , как найти в озерных мест в южной провинции Саскачеван .
В 1990 году , Мексика и Испания были основными мировыми производителями природного сульфата натрия (каждый около 500 тысяч тонн ), с Россией , США и Канаде около 350.000 тонн каждый.
Природные ресурсы оцениваются в более чем 1 миллиард тонн.
Основные производители 200000 до 1500000 тонн / год в 2006 году были Searles Valley Minerals (Калифорния, США), Бортовые Промышленные минералы (Саскачеван, Канада), Química — дель — Рей (Коауила, Мексика), Minera — де — Санта — Марта и Criaderos Minerales Y Derivados, также известный как Grupo Crimidesa (Бургос, Испания), Minera — де — Санта — Марта (Толедо, Испания), Sulquisa (Мадрид, Испания), Чэнду Sanlian Tianquan Chemical ( Тяньцюань , Сычуань, Китай), Hongze Yinzhu Chemical Group ( Hongze район , Цзянсу, Китай), Nafine Химическая группа промышленности [ ж ] (Шаньси, Китай), провинция Сычуань Chuanmei Мирабилит ( 万胜镇 [ ж ] , Дунпо , Meishan , Сычуань, Китай), и Kuchuksulphat ОАО (Алтайский край, Сибирь, Россия).
Безводный сульфат натрия происходит в засушливых условиях , как минеральная тенардит . Он медленно поворачивается к Мирабилиту во влажном воздухе. Сульфат натрия также найден как глауберит , сульфат натрия минерал кальция. Оба минерала является менее распространенным , чем мирабилит.
Химическая индустрия
Примерно одна треть мирового сульфата натрия образуется в качестве побочного продукта других процессов в химической промышленности. Большая часть этого производства является химически присущим первичным процессом, и лишь незначительно экономичным. Усилие промышленности, следовательно, производство сульфата натрия в качестве побочного продукта снижается.
Наиболее важное производство сульфата натрия является химическим течение соляной кислоты производства, либо из хлорида натрия (соли) и серной кислоты , в процессе Mannheim , или из диоксида серы в процессе Hargreaves . В результате чего сульфат натрия из этих процессов известен как соли пирога .
Мангейм: 2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4
Харгривз: 4 NaCl + 2 SO 2 + O 2 + 2 Н 2 O → 4 HCl + 2 Na 2 SO 4
Второе из основных производства сульфата натрия являются процессами , где излишки гидроксид натрия является нейтрализован с помощью серной кислоты, в применении в больших масштабах в производстве вискозы . Этот метод также применяется регулярно и удобный лабораторный препарат.
2 NaOH ( AQ ) + H 2 SO 4 (водн) → Na 2 SO 4 (р) + 2 Н 2 О ( л )
В лаборатории также могут быть синтезированы в результате реакции между бикарбонатом натрия и сульфатом магния .
2NaHCO 3 + MgSO 4 → Na 2 SO 4 + Mg (OH) 2 + 2CO 2
Ранее, сульфат натрия был также побочным продуктом производства дихромата натрия , где серная кислота добавляют к раствору хромата натрия образуя дихромат натрия, или впоследствии хромовую кислоту. Альтернативно, сульфат натрия или был сформирован в производстве карбоната лития , хелатирующих агентов , резорцина , аскорбиновая кислота , кремнеземных пигментов, азотной кислоты и фенола .
Насыпная сульфат натрия обычно очищают с помощью формы десятиводной, так как безводная форма имеет тенденцию привлекать железо соединений и органические соединения . Безводная форма легко получают из гидратированной формы по осторожному нагреванию.
Основной сульфат натрия побочного продукта производители 50-80 Mt / а в 2006 году включают Elementis хрома (хром промышленности, замок Hayne, NC, США), Lenzing AG (200 млн т / д, вискоза промышленность, Ленцинг, Австрия), Addiseo (ранее Rhodia, метионин промышленность, Les Roches-Руссильон, Франция), Elementis (хром промышленности, Стоктон-он-Тис, Великобритания), Сикоку Chemicals (Токушима, Япония) и Виско-R (район промышленности, Россия).
Приложения
Сульфат натрия используется для сухой органической жидкости. Здесь комки форму, что указывает на присутствие воды в органической жидкости.
Путем дальнейшего применение сульфата натрия жидкость может быть доведена до сухости, указанного здесь отсутствие слипания.
сырьевые отрасли промышленности
С США о ценах на $ 30 за тонну в 1970 году до $ 90 за тонну качества соли торт, и $ 130 для лучших сортов, сульфат натрия является очень дешевым материалом.
Самое большое использование в качестве наполнителя в порошкообразных дома моющих средств для стирки, потребляя прибл. 50% мирового производства.
Это использование ослабевает , как отечественные потребители все больше и больше переключения уплотнить или жидкие моющие средства , которые не содержат сульфат натрия.
Другие ранее использовались главным образом для сульфата натрия, в частности , в США и Канаде, находится в процессе сульфатного для производства древесной массы . Органики , присутствующие в «черном щелоке» от этого процесса сжигают для получения тепла, необходимо , чтобы управлять уменьшением сульфата натрия до сульфида натрия .
Тем не менее, благодаря достижениям в тепловой эффективности процесса восстановления Kraft в начале 1960 — х годов, более эффективное восстановление серы была достигнута , и потребность в сульфат натрия макияж был значительно сокращен.
Таким образом, использование сульфата натрия в США и канадской целлюлозно — бумажной промышленности снизилась с 1400000 тонн в год , в 1970 году только ок. 150000 тонн в 2006 году.
Стекла промышленность обеспечивает еще одно существенного применение для сульфата натрия, в качестве второго по величине применения в Европе.
Сульфат натрия используется в качестве рафинирования агента , чтобы помочь удалить мелкие пузырьки воздуха из расплавленного стекла. Это флюсы стекла, а также предотвращает образование отбросов расплава стекла в процессе очистки.
Стекольной промышленности в Европе потребляли с 1970 по 2006 год стабильные 110000 тонн в год.
Сульфат натрия имеет важное значение при производстве текстильных изделий , в частности , в Японии, где он является самым большим приложением.
Сульфат натрия помогает в «выравнивание», уменьшение отрицательных зарядов на волокна так , что красители могут проникать равномерно.
В отличии от альтернативного хлорида натрия , не разъедать нержавеющие стали сосудами , используемых при крашении. Это приложение в Японии и США потребляли в 2006 году примерно 100 000 тонн.
Пищевая промышленность
Сульфат натрия используется в качестве разбавителя для пищевых красителей. Он известен как номер Е аддитивной E514 .
Тепловое хранение
Емкость запоминающего устройства высокой температуры в фазовом переходе из твердых в жидкость, и предпочтительно, температура изменения фазы 32 ° C (90 ° F) делают этот материал особенно подходит для хранения низкосортного солнечного тепла для последующего выпуска в пространстве отопительных систем. В некоторых случа х материал включается в тепловых плиток, которые размещаются в мансардном пространстве в то время как в других применениях соль вводят в клетки, окруженные солнечной нагретой воды. Изменение фазы обеспечивает существенное снижение массы материала, необходимое для эффективного хранения тепла (теплоты плавления сульфата натрия декагидрата составляет 82 кДж / моль или 252 кДж / кг), с дальнейшим преимуществом консистенции температуры до тех пор, а достаточное количество материала в соответствующей фазе доступен.
Для охлаждения приложений, смесь с общим хлорида натрия соли (NaCl) , снижает температуру плавления до 18 ° C (64 ° F). Теплота плавления NaCl · Na 2 SO 4 · 10H 2 O, фактически увеличилась незначительно до 286 кДж / кг.
Небольшие приложения
В лаборатории, сульфат натрия безводного широко используются в качестве инертного агента сушки , для удаления следов воды из органических растворов. Это более эффективно, но медленнее действия, чем аналогичный агент сульфат магния .
Он эффективен только ниже примерно 30 ° С, но он может быть использован с различными материалами , поскольку он химически довольно инертен.
Сульфат натрия добавляют к раствору до тех пор , кристаллы больше не слипаются; два видео — роликов (смотрите выше) демонстрируют , как кристаллы комок , когда еще влажные, но некоторые кристаллы свободно течь , как только образец сухой.
Глауберова соль, то декагидратный исторически использовались в качестве слабительного средства . Он эффективен для удаления некоторых лекарственных препаратов , таких как парацетамол (ацетаминофен) из организма, например, после передозировки.
В 1953 году, сульфат натрия был предложен для теплового хранения в пассивных солнечных отопительных системах. Это имеет преимущество его необычных свойств растворимости, а также высокая теплота кристаллизации (78.2 кДж / моль).
Другие применения сульфата натрия включают де-глазурь окна, крахмал производства, в качестве добавки в ковровых освежители, и в качестве добавки в корм для крупного рогатого скота.
По крайней мере одна компания, Thermaltake, делает портативный компьютер холод мат (iXoft Notebook Cooler) с использованием сульфата натрия декагидрат внутри стеганого пластиковой прокладки. Материал медленно превращается в жидкость и рециркулирует, выравнивающая температуру ноутбука и действовать в качестве изоляции.
безопасности
Несмотря на то, сульфат натрия , как правило , рассматривается как нетоксичный, следует использовать с осторожностью. Пыль может вызвать временное астмы или раздражение глаз; этот риск можно предотвратить с помощью защиты глаз и маски бумаги. Транспорт не не ограничивается, а не фраз риски или фраза безопасности применяется.
Рекомендации
внешняя ссылка
Источник: https://ru.qwe.wiki/wiki/Sodium_sulfate




