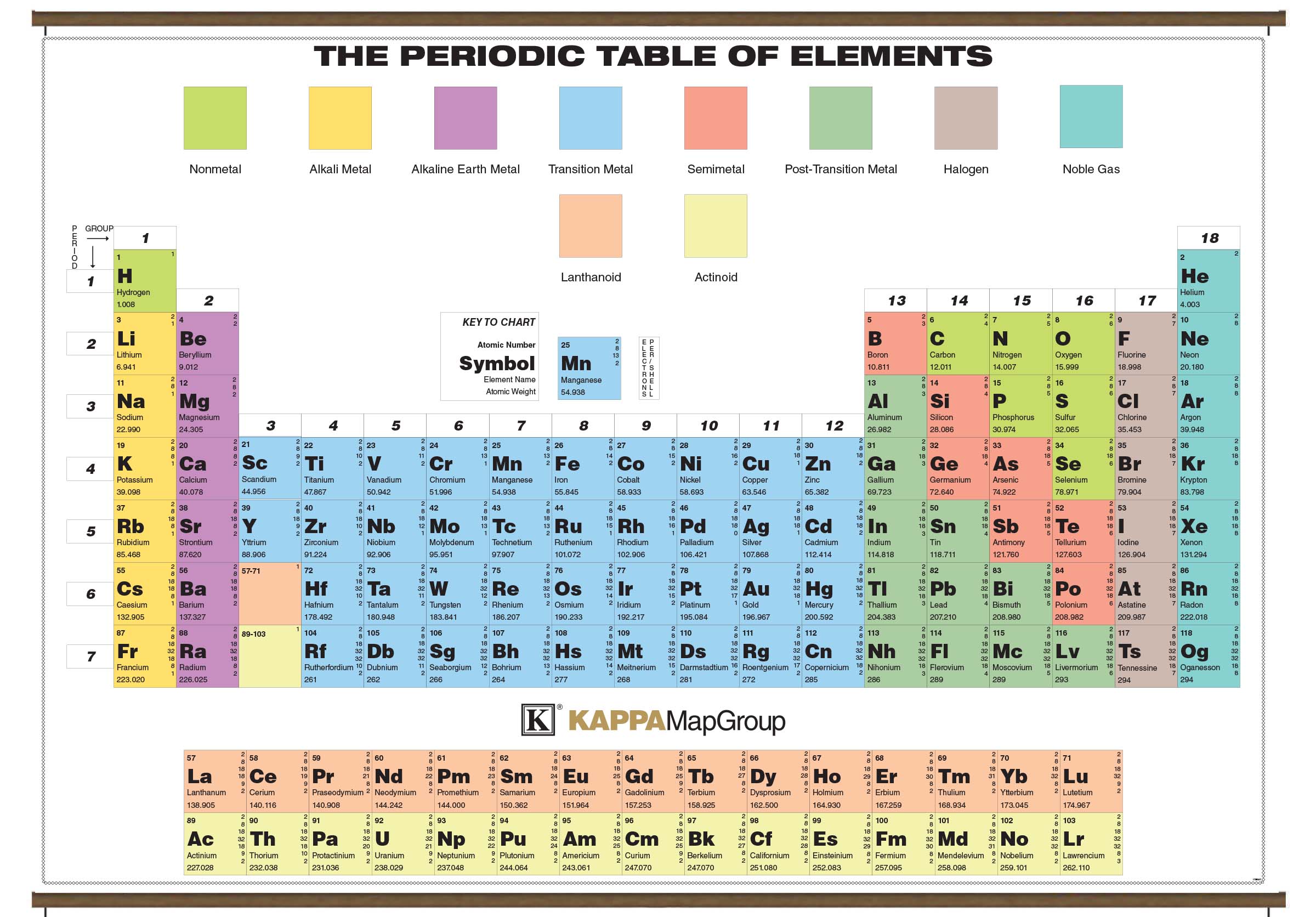
Самоучитель по химии › Неорганическая химия
Содержание
- Щелочные металлы
- Щелочноземельные металлы
- Выводы
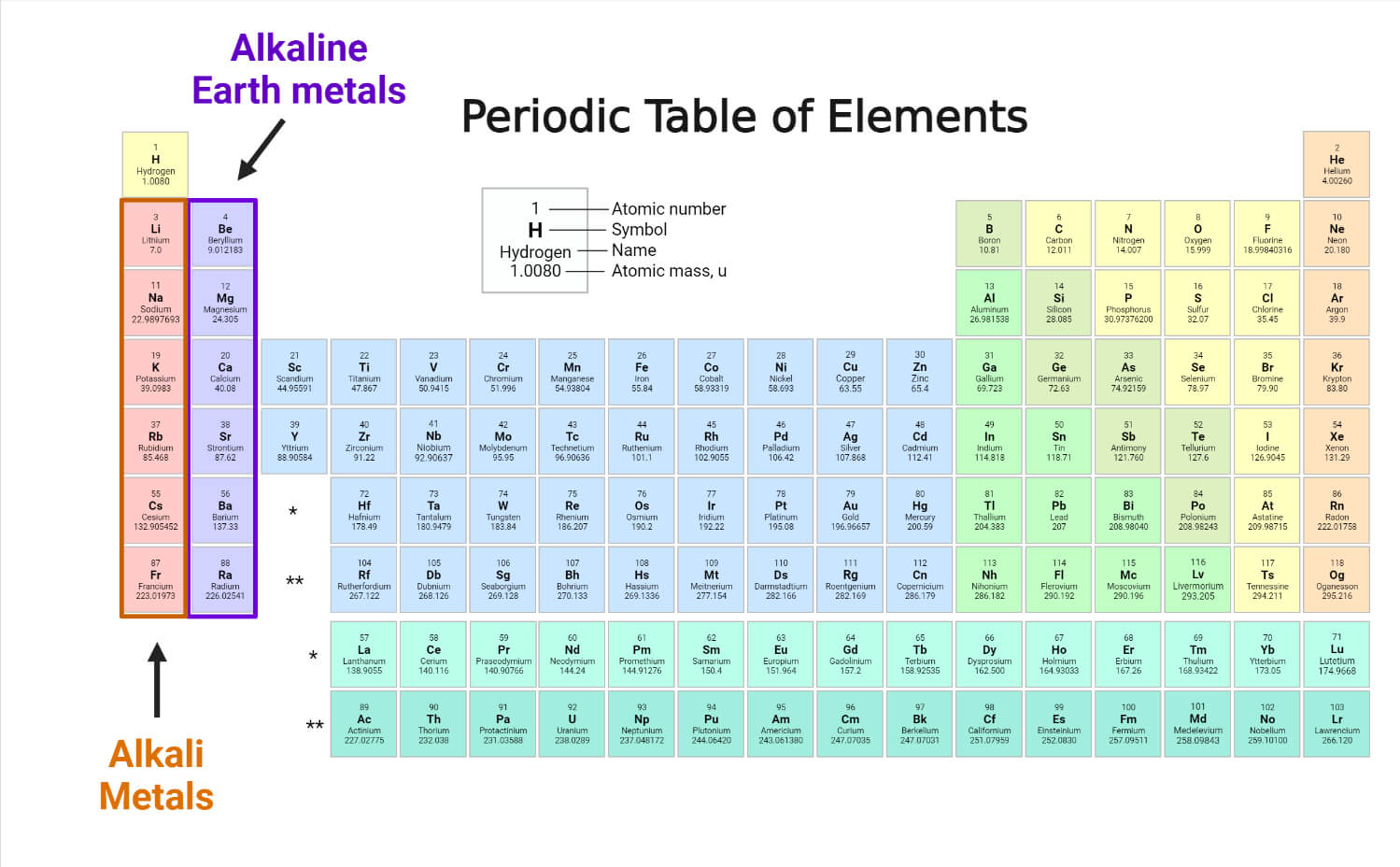
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
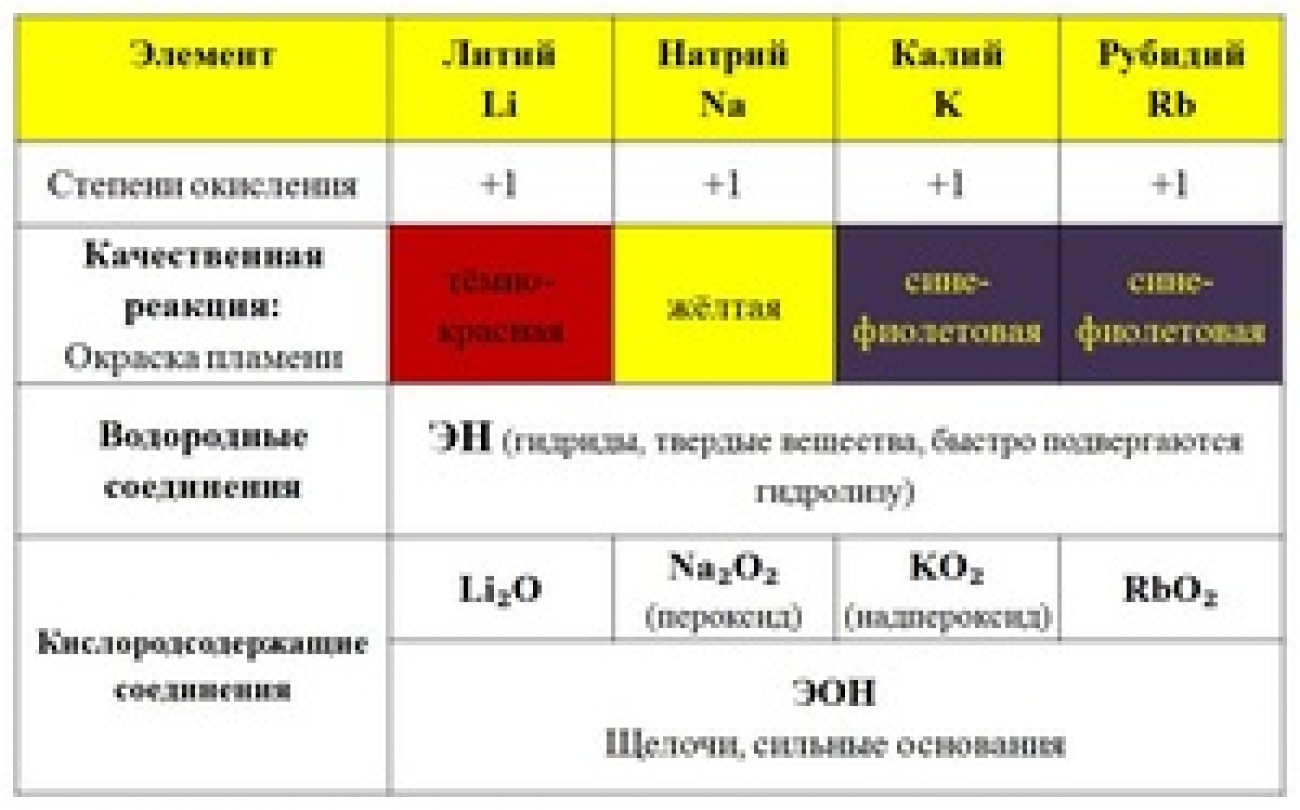
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны.
А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях).
Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает

Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
![]()
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
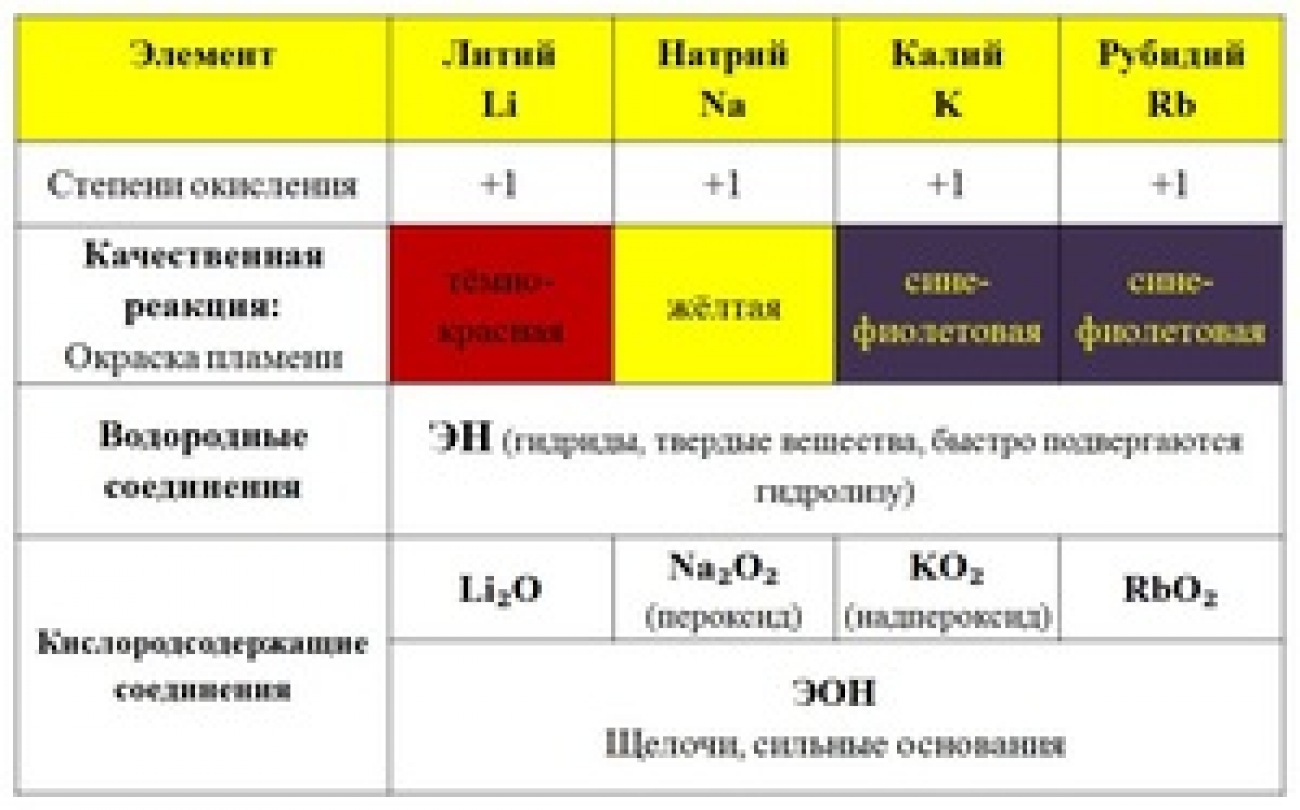
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:

Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
![]()
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:

Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
![]()
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др.
Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы.
Эти вещества применяются и в технических целях.
Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
Вопросы
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na+ и OH– притягиваются слабее, чем Са2+ и ОН–.
- Поэтому первые два элемента этой подгруппы не образуют щелочей:
- Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
- Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
- Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
- Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
- Имея два валентных электрона: …4s2, кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
- Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
- Рассмотрим как происходит взаимодействие кальция с азотом:
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
- Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
- Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).
Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
- Са(ОН)2 + СO2 →
- Са(ОН)2 + H3PO4 →
- Са(ОН)2 + Na2CO3 →
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
- Накипь, конечно, можно растворить при помощи соляной кислоты:
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
- Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.
Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Источник: https://himi4ka.ru/samouchitel-po-himii/urok-9-shhelochnye-i-shhjolochnozemelnye-metally.html
Щёлочноземельные металлы — основные свойства, характеристика и список элементов


Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева

Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
- Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
- Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
Физические свойства щелочноземельных металлов
- Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
- Показатели плотности и температуры плавления представлены в таблице:

Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
- Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
- 4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
- С кислородом образуют реакцию горения и оксид:
- 2Mg + O2 = 2MgO.
- Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
- Mg + 2H2O = Mg(OH)2 + H2,
- Вa + 2H2O = Вa(OH)2 + H2.
- Также реагируют с неметаллами:
- Bа + Cl2 = BаCl2 — хлорид бериллия;
- Ca + Br2 = CaBr2 — бромид кальция;
- Sr + H2 = SrH2 — гидрид стронция.
- Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
- Магний, кальций и стронций получают электролизом расплавов солей.
- Барий получают с помощью восстановления оксида.
- При нагревании фторида бария получают сам металл.
Качественные реакции
- Одна из качественных реакций-окрашивание пламени.
- Список возможных цветов пламени при нагревании данных элементов:
- Ca — темно-оранжевый;
- Sr — насыщенный красный;
- Ba — светло-зеленый или классический зеленый.
Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов

Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Источник: https://nauka.club/khimiya/shchyelochnozemelnye-metally.html
Щелочноземельные металлы
К понятию щелочноземельных металлов относится часть элементов II группы системы Менделеева: бериллий, магний, кальций, стронций, барий, радий. Четыре последних металла имеют наиболее ярко выраженные признаки щелочноземельной классификации, поэтому в некоторых источниках бериллий и магний не включают в список, ограничиваясь четырьмя элементами.
Свое название металла получили благодаря тому, что при взаимодействии их оксидов с водой образуется щелочная среда.
Физические свойства щелочноземельных металлов: все элементы имеют серый металлический цвет, при нормальных условиях имеют твердую структуру, с ростом порядкового номера увеличивается их плотность, имеют очень высокую температуру плавления.
В отличие от щелочных металлов, элементы данной группы не режутся ножом (за исключением стронция). Химические свойства щелочноземельных металлов: имеют два валентных электрона, активность растет с повышением порядкового номера, в реакциях выступают в качестве восстановителя.
Характеристика щелочноземельных металлов свидетельствует об их высокой активности. В особенности это относится к элементам с большим порядковым номером. Например, бериллий в нормальных условиях не ступает во взаимодействие с кислородом и галогенами.
Для запуска механизма реагирования его необходимо нагреть до температуры свыше 600 градусов по Цельсию. Магний в нормальных условиях имеет на поверхности оксидную пленку и также не реагирует с кислородом. Кальций окисляется, но достаточно медленно.
А вот стронций, барий и радий окисляются практически мгновенно, поэтому их хранят в безкислородной среде под керосиновым слоем.
Все оксиды усиливают основные свойства с ростом порядкового номера металла. Гидроксид бериллия представляет собой амфотерное соединение, которое не реагирует с водой, но хорошо растворяется в кислотах.
Гидроксид магния является слабой щелочью, нерастворимой в воде, но реагирующей с сильными кислотами. Гидроксид кальция — сильное, малорастворимое в воде основание, реагирующее с кислотами. Гидроксиды бария и стронция относятся к сильным основаниям, хорошо растворимым в воде.
А гидроксид радия — это одна из сильнейших щелочей, которая хорошо реагирует с водой и практически всеми видами кислот.
Способы получения
Получают гидроксиды щелочноземельных металлов путем воздействия воды на чистый элемент. Реакция протекает при комнатных условиях (кроме бериллия, для которого требуется повышение температуры) с выделением водорода. При нагревании все щелочноземельные металлы реагируют с галогенами.
Полученные соединения используются в производстве большого ассортимента продукции от химических удобрений до сверхточных деталей микропроцессора.
Соединения щелочноземельных металлов проявляют такую же высокую активность, как и чистые элементы, поэтому их используют во многих химических реакциях.

Чаще всего это происходит при реакциях обмена, когда необходимо вытеснить из вещества менее активный металл. В окислительно-восстановительных реакциях принимают участие в качестве сильного восстановителя. Двухвалентные катионы кальция и магния придает воде так называемую жесткость.
Преодоление этого явления происходит путем осаждения ионов при помощи физического воздействия или добавления в воду специальных смягчающих веществ. Соли щелочноземельных металлов образуются путем растворения элементов в кислоте либо в результате реакций обмена.
Полученные соединения имеют прочную ковалентную связь, поэтому обладают невысокой электропроводностью.
В природе щелочноземельные металлы не могут находиться в чистом виде, так как быстро вступают во взаимодействие с окружающей средой, образую химические соединения. Они входят в состав минералов и горных пород, содержащихся в толще земной коры.
Наиболее распространен кальций, немного уступает ему магний, довольно часто встречаются барий и стронций. Бериллий относится к редким металлам, а радий — к очень редким. За все время, которое прошло с момента открытия радия, во всем мире было добыто всего полтора килограмма чистого металла.
Как и большинство радиоактивных элементов, радий имеет изотопы, коих у него насчитывается четыре штуки.

Получают щелочноземельные металлы путем разложения сложных веществ и выделения из них чистого вещества. Бериллий добывают путем восстановления его из фторида при воздействии высокой температуры. Барий восстанавливает из его оксида. Кальций, магний и стронций получают путем электролиза их хлоридного расплава.
Сложнее всего синтезировать чистый радий. Его добывают путем воздействия на урановую руду. По подсчетам ученых в среднем на одну тонну руды приходится 3 грамма чистого радия, хотя встречаются и богатые месторождения, в которых содержится целых 25 грамм на тонну.
Для выделения металла используются методы осаждения, дробной кристаллизации и ионного обмена.
Применение щелочноземельных металлов
Спектр применения щелочноземельных металлов очень обширен и охватывает многие отрасли. Бериллий в большинстве случаев используется в качестве легирующей добавки в различные сплавы.
Он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии.
Также благодаря слабому поглощению радиоактивного излучения бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Магний используют как один из восстановителей при получении титана. Его сплавы отличаются высокой прочностью и легкостью, поэтому используются при производстве самолетов, автомобилей, ракет.
Оксид магния горит ярким ослепительным пламенем, что нашло отражение в военном деле, где он используется для изготовления зажигательных и трассирующих снарядов, сигнальных ракет и светошумовых гранат.
Является одним из важнейших элементов для регуляции нормального процесса жизнедеятельности организма, поэтому входит в состав некоторых лекарств.

Кальций в чистом виде практически не применяют. Он нужен для восстановления других металлов из их соединений, а также в производстве препаратов для укрепления костной ткани.
Стронций используют для восстановления других металлов и в качестве основного компонента для производства сверхпроводящих материалов. Барий добавляют во многие сплавы, которые предназначены для работы в агрессивной среде, так как он обладает отличными защитными свойствами.
Радий используется в медицине для кратковременного облучения кожи при лечении злокачественных образований.
Источник: https://promplace.ru/vidy-metallov-i-klassifikaciya-staty/shelochnozemelnye-metally-1495.htm
Щелочноземельные металлы
-
 Щелочноземельные металлы отличаются химической активностью, поэтому в чистом виде не встречаются. Входят в состав минералов. Больше всего на Земле кальция — он содержится в мраморах, гранитах, известняках. Барий и радий встречаются редко. Радий всегда сопутствует урановым рудам.СвойстваВсе элементы — твердые вещества, ножом можно резать только стронций. Все — серебристо-серые, обладают такими классическими металлическими свойствами, как электропроводность и теплопроводность.Химическая активность возрастает по мере увеличения размера атома, от бериллия к радию. Бериллий покрывается на воздухе оксидной пленкой и дальше уже вступает в реакции только со фтором или при очень высоких температурах. Магний тоже окисляется на поверхности и далее ведет себя достаточно пассивно. Кальций постепенно весь окисляется во влажном воздухе, горит, стоит его слегка нагреть, растворяется в воде. Барий, стронций и радий на воздухе взаимодействуют не только с кислородом, но и с азотом, поэтому для хранения их помещают в герметичные емкости и заливают керосином.
Щелочноземельные металлы отличаются химической активностью, поэтому в чистом виде не встречаются. Входят в состав минералов. Больше всего на Земле кальция — он содержится в мраморах, гранитах, известняках. Барий и радий встречаются редко. Радий всегда сопутствует урановым рудам.СвойстваВсе элементы — твердые вещества, ножом можно резать только стронций. Все — серебристо-серые, обладают такими классическими металлическими свойствами, как электропроводность и теплопроводность.Химическая активность возрастает по мере увеличения размера атома, от бериллия к радию. Бериллий покрывается на воздухе оксидной пленкой и дальше уже вступает в реакции только со фтором или при очень высоких температурах. Магний тоже окисляется на поверхности и далее ведет себя достаточно пассивно. Кальций постепенно весь окисляется во влажном воздухе, горит, стоит его слегка нагреть, растворяется в воде. Барий, стронций и радий на воздухе взаимодействуют не только с кислородом, но и с азотом, поэтому для хранения их помещают в герметичные емкости и заливают керосином.
Кальций окись Магний металлический (стружка) Магнесальт (бишофит) Щелочноземельные металлы растворяются в кислотах, образуют соли. С водой образуют щелочи, сила которых растет от магния к радию. Все, кроме бериллия и магния, легко реагируют с неметаллами.Cа и Mg являются важными биогенными элементами. Кальций нужен для скелета, зубов животных и людей, работы мышц; регулирует свертываемость крови.Магний содержится в живых клетках, он есть в хлорофилле, способствует функционированию ферментных реакций, нервной системы, синтезу нуклеиновых кислот. В очень небольших количествах в нашем организме есть и стронций. Барий, радий, бериллий и их соединения токсичны для всего живого.Применение
- Бериллий входит в состав большого количества минералов, например, изумруда, аквамарина, гелиодора. Используется при выпуске сплавов, в том числе для атомных станций; топлива для ракет.
- Кальций — составная часть многих стройматериалов. Востребован в производстве огнеупорных материалов, топлива, лекарственных веществ.
- Магний — легкий металл, хорошо поддающийся обработке ковкой, прокатом и т.п. Обладает восстановительными свойствами, востребованными в металлотермии. Входит в состав многих современных магниевых сплавов; из них изготавливают листы, профили, детали, для которых имеет значение вес, например, корпуса ноутбуков, смартфонов. Магниевые сплавы нужны в авиационной, автомобильной, электронной, космической, военной, приборостроительной отраслях. Магний содержится в магнезите, бишофите (магнесальте), карналлите, доломите и др. Соли магния определяют жесткость воды, их много в морской воде.
- Стронций и его соли содержатся как примеси во многих минералах.
 Промышленное значение имеют целестин и стронцианит. Основные сферы применения — радиоэлектроника; металлургия (легирование сплавов, удаление серы из сталей, чугуна, меди); атомная энергетика; пиротехника (окрашивает пламя в ярко-красный цвет); производство магнитных материалов, чистого урана, сверхпроводящей керамики; изготовление вакуумных приборов, химических источников тока. Изотоп стронция применяется в медицине как средство против злокачественных опухолей.
Промышленное значение имеют целестин и стронцианит. Основные сферы применения — радиоэлектроника; металлургия (легирование сплавов, удаление серы из сталей, чугуна, меди); атомная энергетика; пиротехника (окрашивает пламя в ярко-красный цвет); производство магнитных материалов, чистого урана, сверхпроводящей керамики; изготовление вакуумных приборов, химических источников тока. Изотоп стронция применяется в медицине как средство против злокачественных опухолей. - Барий добывают из таких минералов, как барит, витерит. Соединения бария применяются в атомной энергетике, вакуумных приборах, для получения оптических линз, стекол для урановых стержней, пьезоэлектрических приборов, сверхпроводящей керамики; источников тока; металлических жидких теплоносителей. Сульфат бария не водорастворим, поэтому не токсичен. Используется в рентгеноскопии как контрастное вещество.
- Радий — самый редкий элемент из группы щелочноземельных металлов. К настоящему времени, ученые всего мира смогли получить лишь 1,5 кг чистого вещества. Радиоактивен. Востребован в ядерных исследованиях, в медицинских целях для облучения опухолей. В 70-х годах на основе радия часто делали светящиеся краски для подсветки элементов приборов, стрелок и т.п. Сейчас от этой практики отказались, так как радий очень опасен для человека, даже в микроскопических дозах.
Источник: https://pcgroup.ru/blog/schelochnozemelnye-metally/
Щелочноземельные металлы
Химия
Элементы подгруппы кальция носят название щелочноземельных металлов. Происхождение этого названия связано с тем, что их окислы («земли» алхимиков) сообщают воде щелочную реакцию. К щёлочноземельным металлам чаще относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию.
Распространённость:
На долю кальция приходится 1,5% общего числа атомов земной коры, тогда как содержание в ней радия очень мало (8- 10-12%). Промежуточные элементы — стронций (0,008) и барий (0,005%)—стоят ближе к кальцию. Барий открыт в 1774 г., стронций — в 1792 г. Элементарные Ca, Sr и Ва впервые получены в 1808 г.
Природный кальций слагается из изотопов с массовыми числами 40 (96,97%), 42 (0,64), 43 (0,14), 44 (2,06), 46 (0,003), 48 (0,19); стронций — 84 (0,56%), 86 (9,86), 87 (7,02), 88 (82,56); барий—130 (0,10%), 132 (0,10), 134 (2,42), 135 (6,59), 136 (7,81), 137 (11,32), 138 (71,66).
Из изотопов радия основное значение имеет встречающийся в природе 226Ra (средняя продолжительность жизни атома 2340 лет).
- Соединения кальция (известняк, гипс) были известны и практически использовались еще в глубокой древности. Помимо различных силикатных пород Са, Sr и Ва встречаются главным образом в виде своих труднорастворимых углекислых и сернокислых солей, каковыми являются минералы:
- СаС03 — кальцит CaS04 — ангидрит
- SrC03 — стронцианит SrS04 — целестин
- ВаС03 — витерит BaS04 — тяжелый шпат
- CaMg(CO3)2- доломит MgCO3 — магнезит
Углекислый кальций в виде известняка и мела иногда образует целые горные хребты. Значительно реже встречается окристаллизованная форма СаСО3 — мрамор.
Для сернокислого кальция наиболее типично нахождение в виде минерала гипса (CaSO4 • 2Н20), месторождения которого нередко обладают громадной мощностью.
Кроме перечисленных выше важным минералом кальция является флюорит -CaF2, используемый для получения плавиковой кислоты по уравнению:
CaF2+H2 SO4(конц.)→CaSO4+HF↑
Для стронция и бария сернокислые минералы более распространены, чем углекислые. Первичные месторождения радия связаны с урановыми рудами (причем на 1000 кг урана руда содержит лишь 0,3 г радия).
- Получение:
- Алюмотермическое получение свободных щелочноземельных металлов проводится при температурах около 1200 °С по схеме:
- ЗЭ0 + 2Аl=Аl2O3+ЗЭ
накаливанием их окислов с металлическим алюминием в высоком вакууме. При этом щелочноземельный металл отгоняется и оседает на более холодных частях установки.
В большом масштабе (порядка тысяч тонн ежегодно) вырабатывается лишь кальций, для получения которого пользуются также электролизом расплавленного СаСl2.
Процесс алюмотермии сложен тем, что при нем происходит частичное сплавление с Al2O3.Например, в случае кальция реакция идет по уравнению:
3СаО + Аl2O3→Сa3(АlO3 )2
Может иметь место также частичное сплавление образующегося щелочноземельного металла с алюминием.
Электролизер для получения металлического кальция представляет собой печь с внутренней графитовой обкладкой, охлаждаемой снизу проточной водой. В печь загружается безводный СаСl2, а электродами служат железный катод и графитовые аноды.
Процесс ведут при напряжении 20—30В, силе тока до 10 тыс. ампер, низкой температуре (около 800 °С). Благодаря последнему обстоятельству графитовая обкладка печи остается все время покрытой защитным слоем твердой соли.
Так как кальций хорошо осаждается лишь при достаточно большой плотности тока на катоде (порядка 100 а/см3), последний по мере хода электролизе постепенно поднимают кверху, с тем чтобы погруженным в расплав оставался лишь его конец.
Таким образом, фактически катодом является сам металлический кальций (который изолируется от воздуха застывшей солевой коркой).Очистка его проводится обычно путем перегонки в вакууме или в атмосфере аргона.
Физические свойства:
Кальций и его аналоги представляют собой ковкие серебристо-белые металлы. Из них сам кальций довольно тверд, стронций и особенно барий значительно мягче. Некоторые константы щелочноземельных металлов сопоставлены ниже:
| Са | Sr | Ва | Ra | |
| Плотность, г/см3 | 1,5 | 2,6 | 3,5 | 5 |
| Температура плавления, °С | 850 | 770 | 710 | 690 |
| Температура кипения, °С | 1490 | 1357 | 1634 | 1536 |
Летучие соединения щелочноземельных металлов окрашивают пламя в характерные цвета: Са — в оранжево-красный (кирпичный), Sr и Ra — в карминово-красный, Ва — в желтовато-зеленый. Этим пользуются при химических анализах для открытия рассматриваемых элементов.
Химические свойства:
На воздухе кальций и его аналоги покрываются пленкой, наряду с нормальными окислами (ЭО) частично содержащей также перекиси (Э02) и нитриды (Э3N2).
В ряду напряжений щелочноземельные металлы располагаются левее магния и поэтому легко вытесняют водород не только из разбавленных кислот, но и из воды. При переходе от Са к Ra энергичность взаимодействия увеличивается.
В своих соединениях рассматриваемые элементы двухвалентны. С металлоидами щелочноземельные металлы соединяются весьма энергично и с значительным выделением тепла.
- · Обычно при взаимодействии ЩЗМ(щелочноземельные) металлов с кислородом, указывают образование оксида:
- 2Э +O2→2ЭO
- Важно знать тривиальные названия нескольких соединений:
- белильная, хлорная (хлорка) – CaCl2 ∙ Ca(ClO)2
- гашёная (пушонка) – Ca(OH)2
- извёстка – смесь Ca(OH)2, песка и воды
- известковое молоко – суспензия Ca(OH)2 в известковой воде
- натронная – смесь твёрдых NaOH и Ca(OH)2 или CaO
- негашёная (кипелка) – СаО
- · Взаимодействие с водой, на примере кальция и его оксида:
- Ca+2H2O→Ca(OH)2+H2↑
- CaO+H2O→Ca(OH)2+16 ккал(«гашение»извести)
- При взаимодействии с кислотами окислы и гидроокиси щелочноземельных металлов легко образуют соответствующие соли, как правило, бесцветные.
- Это интересно:
Если при гашении извести заменить воду раствором NaOH, то получается так называемая натронная известь. Практически при ее выработке к концентрированному раствору едкого натра добавляют измельченную СаО (в весовом соотношении 2:1 к NaOH).
После перемешивания образующейся массы ее выпаривают досуха в железных сосудах, слабо прокаливают и затем измельчают.
Натронная известь представляет собой тесную смесь Са(ОН)2 с NaOH и широко применяется в лабораториях для поглощения углекислого газа.
- Наряду с нормальными окислами для элементов подгруппы кальция известны белые перекиси типа Э02. Практическое значение из них имеет перекись бария (Ва02), применяемая, в частности, как исходный продукт для получения перекиси водорода:
- BaO2 + H2 SO4=BaSO4 + H2O2
- Технически Ва02 получают нагреванием ВаО в токе воздуха до 500 °С. При этом происходит присоединение кислорода по реакции
- 2ВаО +O2= 2BaO2 + 34 ккал
Дальнейшее нагревание ведет, наоборот, к распаду Ва02 на окись бария и кислород. Поэтому сжигание металлического бария сопровождается образованием только его окиси.
- · Взаимодействие с водородом, с образованием гидридов:
- Э+H2→ЭH2
- Гидриды ЭН2 не растворяются (без разложения) ни в одном из обычных растворителей. С водой (даже ее следами) они энергично реагируют по схеме:
- ЭH2+ 2H2O = Э(OH)2 + 2H2↑
Реакция эта может служить удобным методом получения водорода, так как для своего проведения требует кроме СаН2 (1 кг которого дает приблизительно 1 м3 Н2) только воду.
Она сопровождается настолько значительным выделением тепла, что смоченный небольшим количеством воды СаН2 самовоспламеняется на воздухе. Еще энергичнее протекает взаимодействие гидридов ЭН2 с разбавленными кислотами.
Напротив, со спиртами они реагируют спокойнее, чем с водой:
- CaH2+2HCl→СаСl2+2H2
- CaH2+2ROH→2RH+Ca(OH)2
- 3CaH2+N2 → Ca3N2+ЗH2
- CaH2+O2→CaO+H2O
Гидрид кальция используется в качестве эффективного осушителя жидкостей и газов. Он успешно применяется также для количественного определения содержания воды в органических жидкостях, кристаллогидратах и т. д.
- · Напрямую могу взаимодействовать с неметаллами:
- Ca+S→CaS
- Ca+Cl2→CaCl2
· Взаимодействие с азотом. Э3N2 белые тугоплавкие тела. Очень медленно образуются уже при обычных условиях:
- 3Э+N2→Э3N2
- Водой разлагаются по схеме:
- Э3N2+6H2O→3Ca(OH)2+2NH3
- 4Э3N2 →N2+3Э4N2 )(для Ba и Sr субнитриды)
- Э4N2+8H2O→4Э(OH)2+2NH3+H2
- Ba3N2+2N2 →3BaN2 (пернитрид бария)
- При взаимодействии с разбавленными кислотами эти пернитриды наряду с двумя молекулами аммиака отщепляют и молекулу свободного азота:
- Э4N2+8HCl→4ЭСl2+2NH3+H2
- Э3N2+ЗСО = 3ЭO+N2+ЗС
- Иначе идет реакция в случае бария:
- Ba3N2+2СО = 2ВаО + Ba(CN)2
- Это интересно:
- Э+NH3(жидкий)→(Э(NH2 )2+H2+ЭNH+H2 )
- 4Э(NH2 )2→ ЭN2+2H2
- Интересно, что Э(NH3 )6 — аммиакаты образуются при взаимодействии элементов с газообразным аммиаком, и способны разлагаться по схеме:
- Э(NH3 )6→Э(NH2 )2+4NH3+H2
- Дальнейшее нагревание:
- Э(NH2 )2→ЭNH+NH3
- 3ЭNH→NH3+Э3N2
- Но взаимодействие металла с аммиаком при высокой температуре протекает по схеме:
- 6Э+2NH3→ЭH2+Э3N2
- Нитриды способны присоединять галогениды:
- Э3N2+ЭHal2→2Э2NHal
- · Оксиды ЩЗМ и гидроокиси проявляют основные свойства, за исключением бериллия:
- CaO+2HCl→СаСl2+H2O
- Ca(OH)2+2HCl→СаСl2+2H2O
- Be+2NaOH+2H2O→Na2[Be(OH)4 ]+H2↑
- BeO+2HCl→BeСl2+H2O
- BeO+2NaOH→Na2BeO2+H2O
· Качественные реакции на катионы ЩЗМ.В большинстве изданий указывают только качественные реакции на Ca2+ и Ba2+.Рассмотрим их сразу в ионной форме:
- Ca2++CO32-→CaCO3↓ (белый осадок)
- Ca2++SO42-→CaSO4↓ (белый хлопьевидный осадок)
- CaCl2 + (NH4 )2C2O4 →2NH4Cl + CaC2O4↓
- Ca2++C2O42-→ CaC2O4↓(белый осадок)
- Ca2+-окрашивание пламени в кирпичный цвет
- Ba2++CO32-→BaCO3↓ (белый осадок)
- Ba2++SO42-→BaSO4↓(белый осадок)
- Ba2++CrO42-→BaCrO4↓(желтый осадок, аналогично для стронция)
- Ba2++Cr2O72-+H2O→2BaCrO4+2H+(желтый осадок, аналогично для стронция)
- Ba2+- окрашивание пламени в зелёный цвет.
- Применение:
Промышленное применение находят почти исключительно соединения рассматриваемых элементов, характерные свойства которых и определяют области их использования. Исключение представляют соли радия, практическое значение которых связано с их общим свойством — радиоактивностью. Практическое использование (главным образом в металлургии) находит почти исключительно кальций.
Нитрат кальция широко применяется в качестве азотсодержащего минерального удобрения. Нитраты стронция и бария служат в пиротехнике для изготовления составов, сгорающих красным (Sr) или зеленым (Ва) пламенем.Применение отдельных природных разновидностей СаС03 различно.
Известняк непосредственно используется при строительных работах, а также служит исходным сырьем для получения важнейших строительных материалов — извести и цемента. Мел потребляется в качестве минеральной краски, как основа составов для полировки и т. д. Мрамор является прекрасным материалом для скульптурных работ, изготовления электрических распределительных щитов и т.д.
Практическое применение находит главным образом природный СаF2, который широко используется в керамической промышленности, служит исходным материалом для получении HF.
Безводный СаСl2 ввиду его гигроскопичности часто используется в качестве осушающего средства. Весьма разнообразны медицинские применения растворов хлористого кальция (внутрь и внутривенно). Хлористый барий употребляется дли борьбы с вредителями сельского хозяйства и как важный реактив (на ион SO42-) в химических лабораториях.
Это интересно:
Если 1 вес. ч. насыщенного раствора Са(СН3СОО)2 быстро влить в сосуд, содержащий 17 вес. ч. этилового спирта, то вся жидкость тотчас же затвердевает. Получаемый подобным путем «сухой спирт» после поджигания медленно сгорает не коптящим пламенем. Такое топливо особенно удобно для туристов.
Жёсткость воды.
Содержание в природной воде солей кальция и магния часто оценивают, говоря о той или иной ее «жесткости». При этом различают жесткость карбонатную («временную») и некарбонатную («постоянную»).
Первая обусловлена присутствием Са(НС03)2, реже Mg(HC03)2.
Временной она названа потому, что может быть устранена простым кипячением воды: бикарбонаты при этом разрушаются, и нерастворимые продукты их распада (карбонаты Са и Mg) оседают на стенках сосуда в виде накипи:
Ca(HCO3 )2→CaCO3↓+CO2↑+H2O
Mg(HCO3 )2→MgCO3↓+CO2↑+H2O
Постоянная жесткость воды обусловлена присутствием в ней солей кальция и магния, не дающих осадка при кипячении. Наиболее обычны сульфаты и хлориды. Из них особое значение имеет малорастворимый CaS04, который оседает в виде очень плотной накипи.
При работе парового котла на жесткой воде его нагреваемая поверхность покрывается накипью. Так как последняя плохо проводит тепло, прежде всего становится неэкономичной сама работа котла: уже слой накипи толщиной 1 мм повышает расход топлива приблизительно на 5%.
С другой стороны, изолированные от воды слоем накипи стенки котла могут нагреться до весьма высоких температур. При этом железо постепенно окисляется и стенки теряют прочность, что может повести к взрыву котла.
Так как паросиловое хозяйство существует во многих промышленных предприятиях, вопрос о жесткости воды весьма практически важен.
Так как очистка воды от растворенных солей при помощи перегонки слишком дорога, в местностях с жесткой водой для ее «умягчения» пользуются химическими методами. Карбонатную жесткость обычно устраняют, прибавляя к воде Са(ОН)2 в количестве, строго отвечающем найденному по анализу содержанию бикарбонатов. При этом по реакции
- Ca(HCO3 )2+ Са(ОН)2 = 2CaCO3↓ + 2H2O
- весь бикарбонат переходит в нормальный карбонат и осаждается. От некарбонатной жесткости чаще всего освобождаются добавлением к воде соды, которая вызывает образование осадка по реакции:
- СaSO4+ Na2CO3 = CaCO3↓ + Na2SO4
Воде дают затем отстояться и лишь после этого пользуются ею для питания котлов или в производстве. Для умягчения небольших количеств жесткой воды (в прачечных и т. п.) обычно добавляют к ней немного соды и дают отстояться. При этом кальций и магний полностью осаждаются в виде карбонатов, а остающиеся в растворе соли натрия не мешают.
Из изложенного следует, что содой можно пользоваться для устранения и карбонатной, и некарбонатной жесткости. Тем не менее втехнике все же стараются при возможности применять именно Са(ОН)2, что обусловлено гораздо большей дешевизной этого продукта сравнительно с содой
И карбонатная, и некарбонатная жесткость воды оценивается суммарным числом содержащихся в одном литре миллиграмм-эквивалентов Са и Mg (мг-экв/л). Сумма временной и постоянной жесткости определяет общую жесткость воды. Последняя характеризуется по данному признаку следующими наименованиями: мягкая (12 мг-экв/л).
Жесткость отдельных естественных вод колеблется в весьма широких пределах. Для открытых водоемов она часто зависит от времени года и даже погоды. Наиболее «мягкой» природной водой является атмосферная (дождь, снег), почти не содержащая растворенных солей.
Интересно имеющееся указание на то, что сердечные заболевания более распространены в местностях с мягкой водой.
- Для полного умягчения воды вместо соды часто применяют Na3PO4, осаждающий кальций и магний в виде их труднорастворимых фосфатов:
- 2Na3PO4+3Ca(HCO3)2→Ca3 (PO4 )2↓+6NaHCO3
- 2Na3 PO4+3Mg(HCO3 )2→Mg3 (PO4 )2↓+6NaHCO3
- Для расчета жёсткости воды есть специальная формула:

- , где 20,04 и 12,16 эквивалентные массы кальция и магния соответственно.
- Автор статьи: Каштанов Артём Денисович
- Редактор: Харламова Галина Николаевна
Источник: http://www.teslalab.ru/articles/chemistry/49/
Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс
Щелочноземельными металлами называют (4) химических элемента (I)(I)(A) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Электронное строение атомовНа внешнем энергетическом уровне атомы металлов (IIA) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления (+2).
Этим объясняется сходство их свойств.
Для металлов (I)(I)(A) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
- Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
- В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществВ твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
- Тем не менее, металлы (I)(I)(A) группы имеют разные значения температуры плавления, плотности и других физических свойств.
- Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
- Они являются сильными восстановителями.
- Щелочноземельные металлы активно реагируют с:
- водой, образуя соответствующие гидроксиды и выделяя водород:
- кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
- Ba+2HCl=BaCl2+H2↑;
- с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
- Bа+Cl2=BаCl2,
- Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
- При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
- Суммарное уравнение реакции электролиза расплава хлорида кальция:
- CaCl2=Ca+Cl2↑.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-metallov-163805/shchelochnozemelnye-metally-i-ikh-soedineniia-186776/re-10c4f14f-06ce-4e94-80a2-0dd41578852b
Соединения щелочноземельных металлов и их свойства — Абросимова Елена Владимировна учитель химии и биологии
Оксиды щелочноземельных металлов
1) Окисление металлов (кроме Ba, который образует пероксид)
2) Термическое разложение нитратов или карбонатов
2Mg(NO3)2t˚C→ 2MgO + 4NO2 + O2
Химические свойства оксидов щелочноземельных металлов
Типичные основные оксиды. Реагируют с водой (кроме BeO и MgO), кислотными оксидами и кислотами
BeO + 2HNO3 → Be(NO3)2 + H2O
Гидроксиды щелочноземельных металлов R(OH)2
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2H2O →Ba(OH)2 + H2
CaO (негашеная известь) + H2O → Ca(OH)2(гашеная известь) Видео-опыт
Химические свойства гидроксидов
Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
Be(OH)2 – амфотерный гидроксид (т.е. проявляет свойства и кислоты и основания, в зависимости от условий реакции)
Mg(OH)2 – слабое основание
остальные гидроксиды — сильные основания (щелочи).
1. Взаимодействие с кислотными оксидами:
Ca(OH)2 + СO2 → CaСO3↓ + H2O ! Качественная реакция на углекислый газ
Ba(OH)2 + SO2 → BaSO3↓ + H2O
2. Взаимодействие с кислотами:
Ba(OH)2 + 2HNO3→ Ba(NO3)2 + 2H2O
3. Реакции обмена с солями, если образуется осадок:
Ba(OH)2 + K2SO4 →BaSO4↓+ 2KOH
Тренажёр №4 » Характеристика реакции гидроксида кальция с соляной кислотой»
№1. Используя дополнительные источники и учебник, заполните таблицу «Соединения кальция»
| Название вещества | Химическая формула | Физические свойства | Практическое значение |
| Гашёная известь | |||
| Негашёная известь | |||
| Известковое молоко | |||
| Известковая вода | |||
| Гипс природный | |||
| Жжёный гипс |
№2. Составьте уравнения реакций для осуществления следующих превращений:
Ca → CaO → Ca(OH)2 → CaCO3 → CaO → CaCl2 → Ca3(PO4)2
Уравнение последней реакции запишите не только в молекулярном, но и в ионном виде.
Источник: https://www.sites.google.com/site/abrosimovachemy/materialy-v-pomos-ucenikam/distancionnoe-obucenie/9-klass/berillij-magnij-i-selocnozemelnye-metally/soedinenia-selocnozemelnyh-metallov-i-ih-svojstva




