Формула серебра занимает внимание ученых, поскольку у этого металла широкий спектр применения. Серебро используют в таких отраслях:
- технической промышленности;
- ювелирном деле;
- медицине;
- электронике.
И все это благодаря свойствам драгметалла. Поэтому, чтобы понять, почему серебро настолько популярно, нужно знать его физические и химические свойства. Именно в них и кроется суть востребованности драгметалла.
Металл с химической точки зрения
Серебро находится в таблице Менделеева под номером 47 и называется Argentum, а в сокращенном виде — Ag. Элемент расположен в пятом периоде, а как известно, чем больше период, тем больше растут металлические свойства элемента. Группа у элемента одиннадцатая. Она указывает на наполненность электронами рядов атома. По принадлежности элемент является переходным металлом.
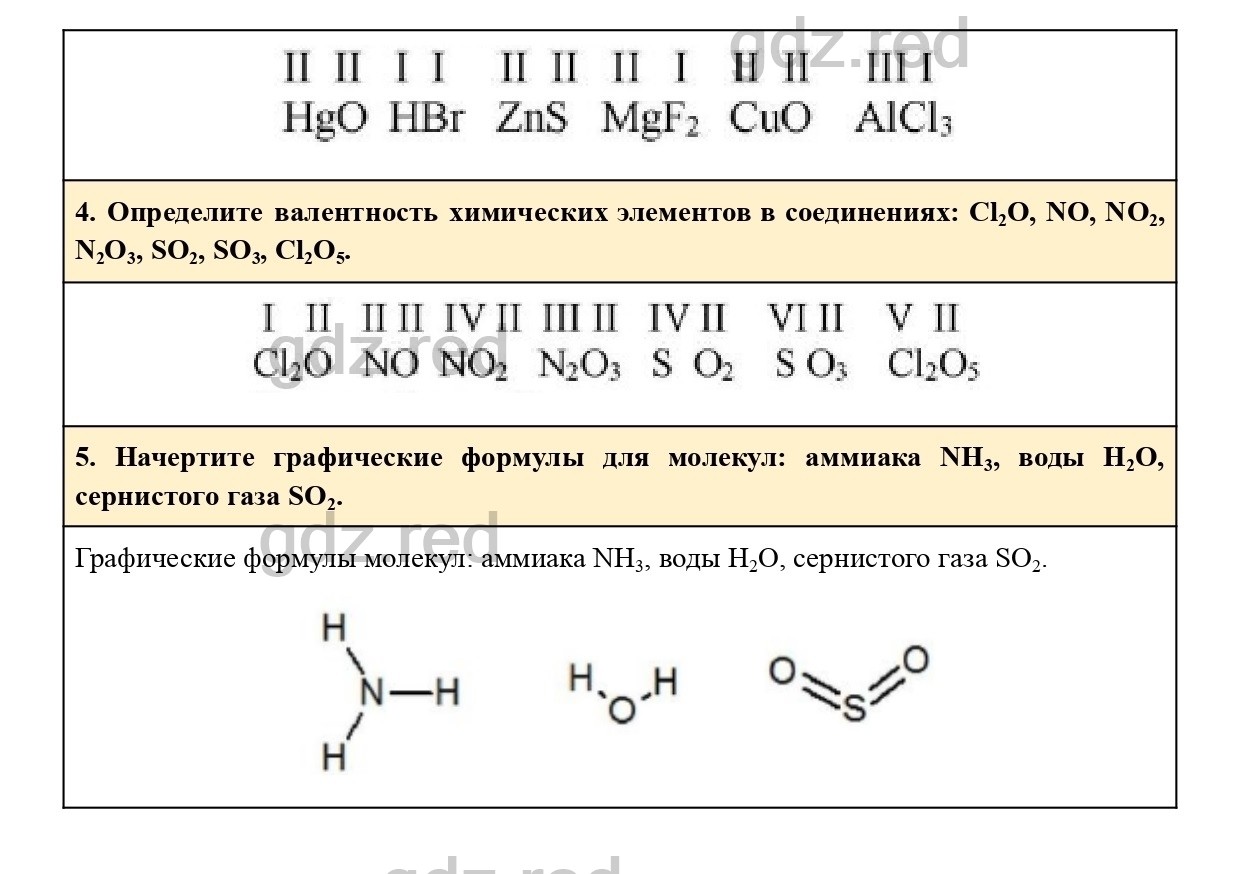
Таблица Менделеева
Первой находке серебра более шести тысяч лет. Раньше его было труднее находить, чем золото, поэтому стоимость серебра была выше. К тому же серебро считали мистическим элементом, поскольку его цвет отдаленно напоминал людям Луну. Поэтому серебро изначально называли «лунным металлом».
Больше всего серебра добывалось в Канаде. Там даже нашли самородок, который позже прозвали «серебряный тротуар», поскольку его размеры достигали 20 тонн.
На сегодняшний день серебро чаще всего находят как сопутствующий металл в составе руд. На специальных заводах происходит дальнейшая обработка сплавов и извлечение серебра из состава руды.
А потому переплавленный металл отправляется в продажу на биржу товаров.
Самое интересное то, что в месторождениях серебра никогда не найти золота и, наоборот, рядом с золотом никто не ищет серебро. Создается впечатление, что два драгметалла конкурируют между собой и «делят» территорию. Но ученые до конца не могут объяснить этого феномена.
С греческого argos переводится как «белоснежный». И действительно серебро в чистом виде приближается больше к белому оттенку, нежели к серому. В природе входит в сульфиды меди, цинка, свинца.
Но ценность серебра со временем немного снизилась из-за его особенностей вступать в реакцию с некоторыми веществами в обычных условиях, в отличие от золота. Если на серебро будут действовать кислород, азот, водород, кремний, углерод, металл не прореагирует на них. Такие химические свойства серебра дали основание назвать его благородным металлом.

Сульфид серебра
Но есть реактивы, которые способны испортить вид серебра и вступить с ним в реакцию. Например, серебро взаимодействует с серой. Формула процесса такая: 2Ag + S = Ag2S. А с галогенами, веществами, которые находятся в восьмой группе таблицы Менделеева, серебро вступает в реакцию только при нагревании и образовывает галогениды серебра.
Химическое подтверждение процесса: 2Ag + Br2 = 2AgBr. Именно благодаря этому свойству элемента проверяется подлинность изделия из серебра даже с помощью подручного йода. Если изделие потемнеет, значит, оно подлинное.
Потемнение украшения из серебра также объясняется его химическими свойствами. Все дело в том, что металл чувствителен к сере, а в воздухе есть определенное количество сероводорода. Именно это вещество постоянно контактирует с изделием.
А если к реакции добавить влажность воздуха, которая возникает даже из-за действия человеческого пота, тогда понятно, что украшение потемнеет еще быстрее. Этот черный налет является аргентум сульфатом.
А формула, которая иллюстрирует реакцию, записывается так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Одно из интересных химических свойств серебра заключается в способности реагировать с кислородом в расплавленном виде. Дело в том, что серебро, разогретое до половины температуры плавления, поглощает кислород в пропорции один к пяти. То есть один сантиметр кубический драгметалла способен поглотить пять кубических сантиметров кислорода.
А доступ воздуха убирают специальными веществами. Поэтому работать в таких условиях опасно: если контакт металла с воздухом не прекращен, со временем произойдет взрыв и раскаленное серебро разбрызгается по сторонам.
При контакте с озоном, который является трехатомным кислородом, металл впитывает и его, образуя оксиды серебра: Ag2О, Ag2O2 и Ag2O3.
Серебро имеет способность противостоять многим кислотам. Оно не реагирует даже на царскую водку из-за образования хлорида серебра на поверхности. Реакция происходит только с концентрированной серной кислотой или с соляной при высоких температурах. Зато такой элемент, как ртуть, губителен для драгметалла, поскольку серебро в ней растворяется.
Физика серебра как металла
А вот с физическими свойствами у серебра все в порядке. Этот металл очень ценен в технике и электрике, поскольку он является проводником с низкой сопротивляемостью.
Поэтому из серебра часто изготавливают контакты в разных механизмах и схемах. Электрический ток, тепло серебро проводит, при этом выдерживая сильную нагрузку, в том числе и перепады напряжения.
К магниту металл невосприимчивый и является диамагнетиком.
В нормальных условиях это мягкий металл, который в чистом виде подвергается царапинам и другим повреждениям. Но именно это свойство и сделало серебро популярным среди ювелиров.
Металл ковкий, из одного грамма можно изготовить проволоку длиной почти в два километра. Но из-за мягкости в украшениях редко используется чистое серебро.
Чаще всего добавляют примеси для прочности и для того, чтобы изделие служило долго и не деформировалось.
Светоотражающие свойства металла также высоко ценятся учеными. Изделия отражают до 95 % лучей, поэтому используются в производстве ракет, атомных подводных лодок. Плотность серебра — 10,5 г/см3.
Это на 10,5 процента больше, чем у воды. Температура плавления драгметалла составляет 961 градус по Цельсию.
Это позволяет переплавлять его не только на заводах, но и дома с помощью специальных приспособлений.

Кристаллы серебра
В человеческом организме тоже содержится несколько молекул серебра. Биологии известны факты, подтверждающие антибактериальные способности драгметалла. Дело в том, что ионы серебра способны убивать микроорганизмы. И в старые времена коллоидные растворы из него использовали в качестве антисептика для обработки ран.
Более того, некоторые люди принимают серебряные растворы в профилактических целях и до сих пор. Если соблюдать дозировку, это не навредит организму. Но если принимать серебро бесконтрольно, могут возникнуть симптомы отравления.
Ювелирное дело также не отстает в количестве способов использования драгметалла. Сейчас изготавливают несколько вариаций серебряных изделий:
- Родированое серебро. Украшения покрыты слоем родия для того, чтоб упрочить материал и избежать окисления и образования сульфидной пленки.
- Черненое серебро. Внешний вид изделия напоминает антиквариат. Эффект достигается с помощью йодирования. Такое изделие не нужно чистить, поскольку есть риск повредить верхний слой.
- Стерлинговое серебро. Изделия 925 пробы, из которых раньше изготавливали монеты с одноименным названием. Сейчас применяется и к другим украшениям, сделанным из металла этой пробы.
- Белое золото. Серебро, смешанное с золотом и приобретающее блестящий беловатый оттенок. Изготавливается из разных пропорций двух драгметаллов.
Итак, серебро не выходит из моды несколько тысячелетий. Более того, металл по-прежнему является выгодным вложением инвестиций у бизнесменов. Ценность серебра определяется не только его внешним видом, но и рядом свойств, которые полезны для человека.
Источник: https://DedPodaril.com/serebro/info/formula-serebra.html
Валентность химических элементов
Для того чтобы научиться составлять химические формулы необходимо выяснить закономерности, согласно которым атомы химических элементов соединяются между собой в определенных соотношениях. Для этого сравним качественный и количественный состав соединений, формулы которых HCl, H2O, NH3, CH4 (рис. 12.1)
По качественному составу эти вещества схожи:в состав каждой из молекул входят атомы водорода. Тем не менее их количественный состав неодинаков. Атомы хлора, кислорода, азота, углерода соединены соответственно с одним, двумя, тремя и четырьмя атомами водорода
Эту закономерность подметил еще в начале XI в. Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наибольшее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э.
Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность» (от лат. valentia — «сила») предложил в 1868 г. немецкий химик К. Г.
Вихельхауз.
 |
| Рис. 12.1. 1. Хлороводород HCl. 2. Вода H2O. 3. Аммиак NH3. 4. Метан CH4 |
Валентность — общее свойство атомов. Она характеризует способность атомов химически (валентными силами) взаимодействовать друг с другом.
Валентность многих химических элементов определили на основе экспериментальных данных о количественном и качественном составе веществ.
За единицу валентности была принята валентностьатома водорода. Если атом химического элемента соединен с двумя одновалентными атомами, то его валентность равна двум.
Если он соединен с тремя одновалентными атомами, то он — трехвалентен и т. д.
Наивысшее значение валентности химических элементов — VIII.
Валентность обозначают римскими цифрами. Обозначим валентность в формулах рассмотренных соединений:
| I I HCl | I II H2O | III I NH3 | IV I CH4 |
Также ученые обнаружили, что немало элементов в разных соединениях проявляют разные значения валентности. То есть существуют химические элементы с постоянной и переменной валентностью.
Можно ли определить валентность по положению химического элемента в периодической системе? Максимальное значение валентности элемента совпадает с номером группы периодической системы, в которой он размещен.
Тем не менее бывают и исключения — азот, кислород, фтор, медь и некоторые другие элементы. Запомни: номер группы обозначен римской цифрой над соответствующим вертикальным столбиком периодической системы.
| Элемент | Валентность | Элемент | Валентность |
| Водород (Н) | I | Кальций (Са) | II |
| Натрий (Na) | I | Барий (Ва) | II |
| Калий (К) | I | Цинк (Zn) | II |
| Фтор (F) | I | Кислород(O) | II |
| Бериллий(Be) | II | Алюминий (Al) | III |
| Магний (Mg) | II | Бор (В) | III |
| Элемент | Валентность | Элемент | Валентность |
| Хлор (Cl) | I, III, V, VII | Железо (Fe) | II, III, VI |
| Бром (Br) | I, III, V, VII | Сера (S) | II, IV, VI |
| Йод (I) | I, III, V, VII | Марганец (Mg) | II, IV, VII |
| Ртуть (Hg) | I, II | Хром (Cr) | II, III, VI Материал с сайта http://worldofschool.ru |
| Медь (Cu) | I,II | Азот (N) | II, I, III, IV |
| Серебро (Ag) | I, II | Фосфор (P) | III, V |
| Золото (Au) | III, I | Мышьяк (As) | III, V |
| Олово (Sn) | II, IV | Углерод (C) | IV, II |
| Свинец (Pb) | II, IV | Кремний (Si) | IV, II |
На этой странице материал по темам:
Источник: http://WorldOfSchool.ru/himiya/svyaz/valentnost-himicheskih-elementov
Химические формулы веществ. Валентность химических элементов
7 кл. Химия. Урок №________ ________________
Тема: Химические формулы веществ. Валентность химических элементов.
Цель урока: Познакомить учащихся с понятием валентность; сформировать понятие валентность и умение определять валентность по химическим формулам и составлять химические формулы по валентности.
Развивать умение записывать химические формулы веществ, зная валентность элементов, входящих в состав данного вещества. Приобретение навыков самостоятельной работы.
Воспитывать познавательный интерес к предмету.
- Тип урока: комбинированный.
- Оборудование: таблицы и схемы
- Ход урока:
- 1. Организационный момент
2. Проверка домашнего задания. Устный опрос учащихся
3. Актуализация знаний.
Сегодня мы с вами повторим материал, который изучали на прошлом уроке «Химическая формула». Относительная молекулярная масса». Потренируемся в вычислении относительной молекулярной массы. А затем перейдем к изучению новой темы.
Итак, первый вопрос: что такое химическая формула? (предполагаемый ответ – химическая формула – это запись, выражающая качественный и количественный состав данного вещества).
А что такое, качественный и количественный состав вещества? (предполагаемый ответ – качественный состав – это какие элементы входят в состав данного вещества, а количественный – в каком соотношении).
Что такое, индекс и коэффициент в химической формуле? (предполагаемый ответ – индекс обозначает число атомов каждого химического элемента, входящего в состав молекулы, пишется справа внизу от символа элемента. Коэффициент – обозначает количество атомов или молекул, пишется перед символом элемента).
- Что означает следующая запись:
- 2Сl, 2Сl2, 3Сl2, 5НСl
- Предполагаемый ответ:
- 2Сl – два атома хлора;
- 2Сl2 – две молекулы хлора;
- 3Сl2 – три молекулы хлора;
- 5НСl – пять молекул хлороводорода.
- Следующий вопрос: Что такое относительная молекулярная масса, как она обозначается и как рассчитывается?
Предполагаемый ответ – относительная молекулярная масса – показывает во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода; обозначается Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в состав молекулы вещества, с учетом индексов.
- Давайте рассчитаем Мr молекулы следующего вещества:
- Мr(Al2(SO4)3) = Ar(Al)2 + Ar(S)3 + Ar(O)12 = 54 + 96 + 192 = 342
- Значит относительная молекулярная масса Al2(SO4)3 равна 342.
4. Мотивация учебной и познавательной деятельности учащихся. Итак, а теперь переходим к изучению новой темы. В конце урока мы напишем небольшую самостоятельную работу по новой теме, поэтому слушайте внимательно и переписывайте записи с доски. Запишите тему урока: «Валентность химических элементов».
5. Объяснение нового материала по теме «Валентность химических элементов»
Только что мы с вами вспомнили, что такое химическая формула. Каждое вещество имеет свою химическую формулу, которая выражает его качественный и количественный состав, т.е. какие элементы и в каком количестве входят в состав одной молекулы данного вещества.
А как же узнают состав каждого вещества. С помощью сложных экспериментов. Однако, зная валентность можно составить формулу любого вещества. Итак, запишем, что же такое валентность:
- Валентность – это способность атомов удерживать при себе определенное число атомов других элементов.
- Валентность атома водорода принята за единицу.
- I I I I
- НСl H2O NH3 CH4
- Cледовательно, атом водорода не может присоединять больше одного атома другого элемента, но другие элементы могут присоединять один (НСl), два (H2O), три (NH3), четыре (CH4) и более атомов водорода (показать шаростержневые модели этих молекул).
- Валентность обозначается римской цифрой, которая ставится над знаком химического элемента в формуле вещества.
А кислород? Атом кислорода всегда двухвалентен.
II II II
H2O SO3 CO2
Атомы одних химических элементов имеют постоянную валентность, а других переменную (т.е. в разных соединениях один и тот же элемент может проявлять разную валентность):
VI IV II
SO3 SO2 H2S
В учебнике на странице 25 в таблице приведены валентности химических элементов в соединениях. Жирным шрифтом обозначены те элементы, которые имеют постоянную валентность (Na, К, Н, О и др.).
Зная формулы веществ, состоящих из двух элементов, и валентность одного из них, можно определить валентность другого элемента. Например, СuO – оксид меди (II). Мы знаем, что валентность кислорода равна двум. Если на один атом кислорода приходится один атом меди, значит, валентность меди тоже равна двум.
Запишем правила определения валентности по формулам их соединений.
Правила определения валентности элементов в соединениях:
1. Записать химическую формулу вещества и указать валентность известного элемента.
- Например, оксид углерода (IV) имеет формулу – СО2, валентность кислорода постоянна и равна двум, записываем над символом кислорода II
- II
- СО2
2. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента.
Для этого умножаем валентность известного элемента на индекс при этом элементе:
2 × II = 4 – это и есть НОК
3. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности.
- Индекс при атоме углерода равен 1, значит:
- 4 : 1 = IV – это и есть валентность атома углерода
- IV II
- СО2
- Разберем еще один пример:
- II
- Fe2O3
1. Валентность кислорода постоянна и равна II.
- 2. НОК: 3 × II = 6
- 3. 6 : 2 = III – это и есть валентность атома железа
- III II
- Fe2O3
- Определим валентность химических элементов в следующих соединениях:
- СаО ZnCl2
- N2O3 Li2S
- NH3 Mg3P2
- Валентность атомов кислорода вы уже знаете, а валентность других элементов, имеющих постоянную валентность, находим по таблице.
Вы уже умеете определять валентность химических элементов в соединениях, формулы которых известны. А теперь рассмотрим как, зная валентность составить химические формулы.
Для составления химической формулы, нужно знать валентность элементов в данном соединении. Валентности некоторых элементов представлены в таблице учебника.
Правила составления химических формул по валентности:
1. Записать химические знаки элементов, входящих в состав соединения, и указать их валентности.
Например, составим формулу оксида алюминия – соединения алюминия с кислородом. Запишем знаки химических элементов:
Аl..O..
Валентность кислорода равна двум, валентность алюминия постоянна, находим значение валентности по таблице учебника, она равна трем. Записываем валентности:
III II
Аl..O..
2. Определить НОК чисел, обозначающих валентность обоих элементов.
НОК – наименьшее из целых положительных чисел, делящееся без остатка на каждое из данных целых чисел.
НОК II и III – 6
3. Разделить НОК на валентность каждого элемента, полученные числа обозначают индексы соответствующих элементов.
6 : II = 3, т.е. индекс при атоме кислорода равен 2
6 : III = 2, т.е. индекс при атоме алюминия равен 3.
4. Записать полученные индексы справа внизу у знаков химических элементов.
- III II
- Аl2O3
- Разберем еще один пример: соединение серы с водородом, при чем валентность серы указана, так как сера имеет переменную валентность.
- II
Н..S..
1.Записываем валентность атома водорода:
I II
Н..S..
2. Находим НОК, оно равно двум
3. Находим индексы элементов:
2 : II = 1, т.е. индекс при атоме серы равен 1
2 : I = 2, т.е. индекс при атоме водорода равен 2
- 4. Записываем формулу с учетом индексов:
- I II
- Н2S
- В названии веществ, имеющих переменную валентность, в скобках пишут валентность данного элемента в этом соединении:
- СuO – оксид меди (II)
- Cu2O – оксид меди (I)
- Расставим индексы в формулах следующих соединений:
- II III
К..S.. Мg..N..
IV I
Мg..Si.. С..Сl..
II I I
Fe..Сl.. Са..F..
6. Закрепление материала, повторение ключевых моментов.
Итак, сегодня на уроке мы узнали, что такое валентность, как определить валентность элементов, формула которого известна, и наоборот, зная валентность составить химическую формулу. Сейчас мы проверим, как вы усвоили данную тему, для этого напишем самостоятельную работу.
- I вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- СО, ZnS, SiН4
- 2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl..I..
V I
в) Р..Cl..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) железа (II)
- б) азота (IV)
- 4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
- а) бария
- б) железа (III)
- II вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- HBr, Ca3P2, MgCl2
- 2. Расставьте индексы в химических формулах следующих соединений:
- VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu..S..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) калия
- б) кремния(IV)
- 4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
- а) алюминия
- б) кальция
- III вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- NO, Na2S, СaCl2
- 2. Расставьте индексы в химических формулах следующих соединений:
- I II
а) Ag..S..
II
б) Аl..S..
IV
в) Si..H..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) хлора (VII)
- б) бария
- 4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
- а) железа (III)
- б) меди (II)
- IV вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- NaI, SiCl4, MgS
- 2. Расставьте индексы в химических формулах следующих соединений:
- I
а) N..O..
I
б) Ba..Cl..
IV
в) Si..O..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) cеры(VI)
- б) углерода(II)
- 4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
- а) cеребра (I)
- б) алюминия
7. Подведение итогов урока. Оценивание.
- 8. Домашнее задание выучить конспект, выполнить задание
- I вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- СО, ZnS, SiН4
- 2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl..I..
V I
в) Р..Cl..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) железа (II)
- б) азота (IV)
- 4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
- а) бария
- б) железа (III)
- II вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- HBr, Ca3P2, MgCl2
- 2. Расставьте индексы в химических формулах следующих соединений:
- VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu..S..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) калия
- б) кремния(IV)
- 4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
- а) алюминия
- б) кальция
- III вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- NO, Na2S, СaCl2
- 2. Расставьте индексы в химических формулах следующих соединений:
- I II
а) Ag..S..
II
б) Аl..S..
IV
в) Si..H..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) хлора (VII)
- б) бария
- 4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
- а) железа (III)
- б) меди (II)
- IV вариант
- 1. Определите валентность химических элементов в следующих соединениях:
- NaI, SiCl4, MgS
- 2. Расставьте индексы в химических формулах следующих соединений:
- I
а) N..O..
I
б) Ba..Cl..
IV
в) Si..O..
- 3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
- а) cеры(VI)
- б) углерода(II)
- 4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
- а) cеребра (I)
- б) алюминия
Источник: https://infourok.ru/himicheskie-formuli-veschestv-valentnost-himicheskih-elementov-1588251.html
какая постоянная валентность у серебра-Ag? Химия 8 класс
Natalyalapaj / 06 янв. 2014 г., 7:26:53
- является: а) воздух; б) медь, в) зерно, г) гранит
- 2. Смесь железа и серы можно различить: а) намагничиванием, б) выпариванием, в) дистилляцией, г) хромотографией
- 3. Химической реакцией является: а) горение дров, б) плавление льда, в) оседание песка в воде, г) перемешивание порошка
- 4. Из перечисленных ниже веществ сложным веществом не является: а) кислород, б) вода, в) сульфид железа, г) поваренная соль
- 5. Относительная атомная масса кальция показывает, что этот атом тяжелее 1/12 массы атома углерода: а) в 12 раз, б) в 40 раз, в) в 10 раз, г) в 20 раз
- 6. В формуле NaCl индексы, стоящие при символах натрия и хлора, равны: а) 0 и 0, б) 1 и 1, в) 2 и 1, г) 1 и 2
- 7. Оксид это сложное вещество, на втором месте в котором стоит: а) хлор, б) кислород, в) сера, г) водород
- 8) В уравненияи реакции P + O₂ = P₂O₅, нужно поставить следующие коэффициенты: а) 4, 5, 2, б) 2, 1, 2, в) 3, 4, 2, г) 5, 4, 2.
9. Если железный гвоздь погрузить в раствор хлорида Cu(2), то гвоздь покрывается красным налетом меди. Это пример какой реакции: а) реакция обмена, б) реакции замещения, в) реакция соединения, г) реакция разложения
10. Имеются 69 г натрия. Сколько молей это состовляет: а) 3, б) 1, в) 4, г) 10.
11. Количества вещества измеряется: а) в граммах, б) в молях, в) в граммах на моль, г) в литрах.
12. Содержимое кислорода в воздухе (по объему) состовляет: а) 20,9%, б) 50%, в) 78%, г) 0,03%
13. По какой реакции нельзя получит кислород: а) H₂P + Na =, б) Cu + H₂SO₄ =, в) HCl + Mg =.
14. Для взаимодействия Cuo с водородом необходимо: а) охлождение, б) перемешивание, в) нагревание, г) действие с кислотой.
15. Какое из перечисленных веществ не ялвяется кислотой: а) HClO₄, б) H₂SO₃, в) HNO₃, г) NH₄NO₃?
16. Какой элемент, из перечисленных ниже, стоит в ряу активности левее водорода: а) Cu, б) K, в) Ag, г) Hg?
17. Из приведенного ниже переченя веществ укажите фосфат: а) Na₃PO₄, б) BaSO₄, в) P₂O₅, г) PH₃
18. В 70г воды растворили 30г соли. Какова концентрация получившегося раствора: а) 30%, б) 60%, в) 70%, г) 50%?
19. Какой из оксидов не является основным: a) CuO, б) P₂O₅, в) K₂O, г) MgO?
20. В трех пробирках находятся вещества: вода, KOH, HCl. Какаую окраску будет иметь фенолфталеин в этих пробирках: а) бесцветную, малиновую, бесцветную; б) малиновую, бесцветную, малиновую, в) малиновую во всех пробирках, г) бесцветную во всех пробирках?
21. Реакция нейтрализации — это: а) KOH + H₂SO₄ =, б) K₂O + NaCl =, в) Mg + HCl =, г) Na + H₂O =. ?
22. С помощью какой реакции нельзя получить оксид: а) CaO + So₃ =. б) C + O₂, в) MgCO₃ =, г) Na + O₂ =. ?
23. Двухосновные кислоты — это: a) H₃PO₄, H₃AsO₃, б) H₂SO₃, в) H₂CO₃, г) HCl, HNO₃, г) H₂SO₄, HBr?
24. Из привиденного ниже перченя выберите: 1) хлориды, 2) карбонаты, 3) нитраты. а) CuCl₂, б) Na₂SO₄, K₂CO₃, г) KNO₃, д) CaSO₄, е) BaCO₃, ж) NaCl, з) Li₂CO₃, к) NaNO₃.
25. Периодический закон был сфармирован Д.И. Менделеевым 1 марта … года: а) 1869, б) 1769, в) 1800, г) 1790.
26. Общее число электронов в атоме серы: а) 32, б) 16, в) 20, г) 90?
27. Какому элементу соответствует электронная формула 1s²2s²2p²: а) фосфору, б) натрию, в) углероду, г) азоту.
28. Форму шара имеет орбиталь: а) s, б) p, в) d, г) f.
29. При нормальных условиях 2 моль любого газа занимают объем: а) 22, 4л, б) 100л, в) 44,8л, г) 11,2л.
30. Хлор может вытеснять из солей: а) бром и йод, б) бром и фтор, в) фтор и йод, г) фтор?
31. Качественная реакция на солянную кислоту и ее соли: а) HCl + K₂So₄ =, б) HCl + Mg =, в) HCl + CuO =, г) HCl + AgNO₃ =. ?
32. Массовая доля кислорода в оксиде углерода (IV) равна приблизительно: а) 73%, ю) 30%, в) 50%, г) 20%. ?
33. Масса фосфора, необходимо для получения 0,1 моль оксида фосфора (V), равна: а) 31г, б) 3,1г, в) 6,2г, г) 0,2г
34. Общая схема превращений ЭО = ЭО = Э(OH)₂ соответствует генетическому ряду: а) цинк = оксид цинка (II) = гидроксид цинка (II) б) натрий = оксид натрия = гидроксид натрия в) аллюминий = оксид аллюминия = гидроксид аллюминия г) сера = оксид серы (IV) = гидроксид серы (IV). ?
35. Формула вещества, обзночающего «X» в схеме превращений C = CO₂ + H₂O = X: а) CO, б) CH₄, в) H₂CO₃, г) C. ?
Источник: https://matematika.neznaka.ru/answer/2144831_kakaa-postoannaa-valentnost-u-serebra-ag-himia-8-klass/




