
Металлы, это группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. В данной статье все свойства металлов будут представлены в виде отдельных таблиц.
Свойства металлов делятся на физические, химические, механические и технологические.
Физические свойства металлов
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании.
Удельный вес металла — это отношение веса однородного тела из металла к объему металла, т.е. это плотность в кг/м3 или г/см3.
Плавкость металла — это способность металла расплавляться при определенной температуре, называемой температурой плавления.
Электропроводность металлов — это способность металлов проводить электрический ток, это свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля.
Под электропроводностью подразумевается способность проводить прежде всего постоянный ток (под воздействием постоянного поля), в отличие от способности диэлектриков откликаться на переменное электрическое поле колебаниями связанных зарядов (переменной поляризацией), создающими переменный ток.
Магнитные свойства металлов характеризуются: остаточной индукцией, коэрцетивной силой и магнитной проницаемостью.
Теплопроводность металлов — это их способность передавать тепло от более нагретых частиц к менее нагретым. Теплопроводность металла определяется количеством теплоты, которое проходит по металлическому стержню сечением в 1см2, длиной 1см в течение 1сек. при разности температур в 1°С.
Теплоемкость металлов — это количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной).
Расширяемость металлов при нагревании.Все металлы при нагревании расширяются, а при охлаждении сжимаются. Степень увеличения или уменьшения первоначального размера металла при изменении температуры на один градус характеризуется коэффициентом линейного расширения.
Химические свойства металлов
К химическим — окисляемость, растворимость и коррозионная стойкость.
Окисление металлов — это реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). Если рассмотреть окисляемость шире, то это реакции, в которых атомы теряют электроны и образуются различные соединения, например, хлориды, сульфиды. В природе металлы находятся в основном в окисленном состоянии, в виде руд, поэтому их производство основано на процессах восстановления различных соединений.
Растворимость металлов — это их способность образовывать с другими веществами однородные системы — растворы, в которых металл находится в виде отдельных атомов, ионов, молекул или частиц. Металлы растворяются в растворителях, в качестве которых выступают сильные кислоты и едкие щелочи. В промышленности наиболее часто используются: серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкий калий.
Коррозионная стойкость металлов — это их способность сопротивляться коррозии.
Механические свойства металлов
- К механическим — прочность, твердость, упругость, вязкость, пластичность.
- Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь.
- Твердостью металлов называется способность тела противостоять проникновению в него другого, более твердого тела.
- Упругость металлов — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию).
Вязкость металлов — это способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам.
Вязкость — свойство обратное хрупкости.
Пластичность металлов — это свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность—свойство обратное упругости.
Технологические свойства металлов
- К технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
- Прокаливаемость металлов – это их способность получать закаленный слой определенной глубины.
- Жидкотекучесть металлов — это свойство металла в жидком состоянии заполнять литейную форму и воспроизводить ее очертания в отливке.
- Ковкость металлов —это технологическое свойство, характеризующее их способность к обработке деформированием, например, ковкой, вальцеванием, штамповкой без разрушения.
- Свариваемость металлов — это их свойство образовывать в процессе сварки неразъемное соединение, отвечающее требованиям, обусловленным конструкцией и эксплуатацией производимого изделия.
Обрабатываемость металлов резанием — это их способность изменять геометрическую форму, размеры, качество поверхности за счет механического срезания материала заготовки режущим инструментом. Обрабатываемость металлов зависит от их механических свойств, в первую очередь прочности и твердости.
Современными методами испытания металлов являются механические испытания, химический анализ, спектральный анализ, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах, а также определить качество готовых изделий.
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»



- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»

- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 107,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»,
- см. раздел «Способы соединения деталей»;
- 480 Н/мм2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
Таблица «Свойства кузовных тонколистовых металлов»

Таблица «Свойства цветных металлов»

- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
Таблица «Свойства легких сплавов»
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»

- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Таблица «Свойства металлокерамических материалов (РМ)1 для конструкционных деталей»

- В соответствии со стандартом DIN 30 910,1990 г. издания;
Магнитные материалы
Таблица «Свойства магнитомягких материалов»
- Данные относятся только к магнитным кольцам.
Магнитомягкие металлы
Таблица «Свойства магнитной листовой и полосовой стали»
Материалы для преобразователей и электрических реакторов
Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
Материалы для реле постоянного тока
Таблица «Свойства материалов для реле постоянного тока»
Металлокерамические материалы для магнитомягких компонентов
Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
Магнитомягкие ферриты
Таблица «Свойства магнитомягких ферритов»
- Нормируемые величины;
- Потеря материалом магнитных свойств в зависимости от частоты при низкой плотности магнитного потока (В < 0,1 мТл);
- Потери магнитных свойств при высокой плотности магнитного потока; замеряются предпочтительно при f = 25 кГц, В = 200 мТл, Θ = 100°С;
- Магнитная проницаемость при строго синусоидальном магнитном поле; замеряется при f
Источник: http://press.ocenin.ru/svojstva-metallov/
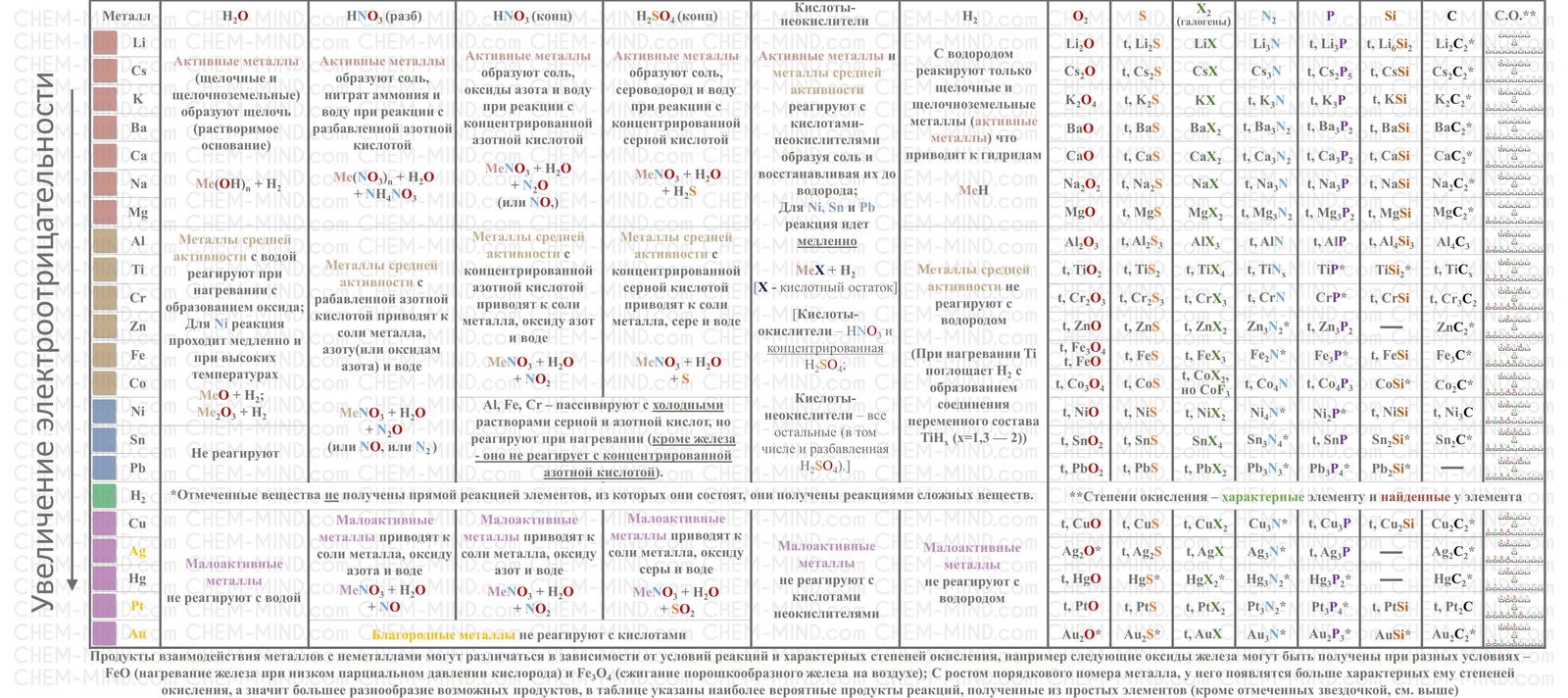
Металлы — Химия
 Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
- Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
- Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
- В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
- Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³).
Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.
6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь.
Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов.
Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
- Химические свойства металлов
- На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
- Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
![]() оксид лития
оксид лития ![]() пероксид натрия
пероксид натрия ![]() надпероксид калия
надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
![]()
Со средними и малоактивными металлами реакция происходит при нагревании:
![]()
![]()
![]()
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
![]()
При нагревании:
![]()
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- Взаимодействие кислот с металлами
- Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
- Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
При взаимодействии с активными металлами вариантов реакций ещё больше:
Источник: https://www.sites.google.com/site/helpchemistry78/metally
Свойства металлов: химические, физические, технологические
Не секрет, что все вещества в природе делятся на три состояния: твердые, жидкие и газообразные. А твердые вещества в свою очередь делятся на металлы и неметаллы, разделение это нашло свое отображение и в таблице химических элементов великого химика Д. И. Менделеева. Наша сегодняшняя статья о металлах, занимающих важное место, как в химии, так и во многих других сферах нашей жизни.
Химические свойства металлов
Все мы, так или иначе, но сталкиваемся с химией в нашей повседневной жизни. Например, во время приготовления еды, растворение поваренной соли в воде является простейшей химической реакцией. Вступают в разнообразные химические реакции и металлы, а их способность реагировать с другими веществами это и есть их химические свойства.
Среди основных химических свойств или качеств металлов можно выделить их окисляемость и коррозийную стойкость. Реагируя с кислородом, металлы образуют пленку, то есть проявляют окисляемость.
Аналогичным образом происходит и коррозия металлов – их медленное разрушение по причине химического или электрохимического взаимодействия. Способность металлов противостоять коррозии называется их коррозийной стойкостью.

Физические свойства металлов
Среди основных общих физических свойств металлов можно выделить:
- Плавление.
- Плотность.
- Теплопроводность.
- Тепловое расширение.
- Электропроводность.
Важным физическим параметром металла является его плотность или удельный вес. Что это такое? Плотность металла – это количество вещества, которое содержится в единице объема материала.
Чем меньше плотность, тем металл более легкий. Легкими металлами являются: алюминий, магний, титан, олово. К тяжелым относятся такие металлы как хром, марганец, железо, кобальт, олово, вольфрам и т. д.
(в целом их имеется более 40 видов).
Способность металла переходить из твердого состояния в жидкое, именуется плавлением. Разные металлы имеют разные температуры плавления.

Скорость, с которой в металле проводится тепло при нагревании, называется теплопроводностью металла. И по сравнению с другими материалами все металлы отличаются высокой теплопроводностью, говоря по-простому, они быстро нагреваются.
Помимо теплопроводности все металлы проводят электрический ток, правда, некоторые делают это лучше, а некоторые хуже (это зависит от строения кристаллической решетки того или иного металла).
Способность металла проводить электрический ток называется электропроводностью.
Металлы, обладающие отличной электропроводностью, это золото, алюминий и железо, именно поэтому их часто используют в электротехнической промышленности и приборостроении.
Механические свойства металлов
Основными механическими свойствами металлов является их твердость, упругость, прочность, вязкость и пластичность.
При соприкосновении двух металлов могут образоваться микро вмятины, но более твердый металл способен сильнее противостоять ударам. Такая сопротивляемость поверхности металла ударам извне и есть его твердость.
Чем же твердость металла отличается от его прочности. Прочность, это способность металла противостоять разрушению под действием каких-либо других внешних сил.
Под упругостью металла понимается его способность возвращать первоначальную форму и размер, после того как нагрузка, вызвавшая деформацию металла устранена.
Способность металла менять форму под внешним воздействием называется пластичностью.
Технологические свойства металлов
Технологические свойства металлов и сплавов важны в первую очередь при их производстве, так как от них зависит способность подвергаться различным видам обработки с целью создания разнообразных изделий.
Среди основных технологических свойств можно выделить:
- Ковкость.
- Текучесть.
- Свариваемость.
- Прокаливаемость.
- Обработку резанием.
Под ковкостью понимается способность металла менять форму в нагретом и холодном состояниях. Ковкость метала, была открыта еще в глубокой древности, так кузнецы, занимающиеся обработкой металлических изделий, превращением их в мечи или орала (в зависимости от потребности) на протяжении многих веков и исторических эпох были одной из самых уважаемых и востребованных профессий.

- Способность двух металлических сплавов при нагревании соединяться друг с другом называют свариваемостью.
- Текучесть металла тоже очень важна, она определяет способность расплавленного метала растекаться по заготовленной форме.
- Свойство металла закаливаться называется прокаливаемостью.
Интересные факты о металлах
- Самым твердым металлом на Земле является хром. Этот голубовато-белый метал был открыт в 1766 году под Екатеринбургом.
- И наоборот, самыми мягкими металлами являются алюминий, серебро и медь. Благодаря своей мягкости они нашли широкое применение в разных областях, например, в электроаппаратостроении.
- Золото – которое на протяжении веков было самим драгоценным металлом имеет и еще одно любопытное свойство – это самый пластичный металл на Земле, обладающий к тому же отличной тягучестью и ковкостью. Также золото не окисляется при нормальной температуре (для этого его нужно нагреть до 100С), обладает высокой теплопроводностью и влагоустойчивостью. Наверняка все эти физические характеристики делают настоящее золото таким ценным.
- Ртуть – уникальный металл, прежде всего тем, что он единственный из металлов, имеющий жидкую форму. Причем в природных условиях ртути в твердом виде не существует, так как ее температура плавления -38С, то есть в твердом состоянии она может существовать в местах, где просто таки очень холодно. А при комнатной температуре 18С ртуть начинает испаряться.
- Вольфрам интересен тем, что это самый тугоплавкий металл в мире, чтобы он начал плавиться нужна температура 3420С. Именно по этой причине в электрических лампочках нити накаливания, принимающие основной тепловой удар, изготовлены из вольфрама.
Металлы, видео
И в завершение образовательное видео по теме нашей статьи.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник: https://www.poznavayka.org/fizika/svoystva-metallov/
Общие физические и химические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.

Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
- 1) С кислородом:
2Mg + O2 → 2MgO - 2) С серой:
Hg + S → HgS - 3) С галогенами:
Ni + Cl2 –t°→ NiCl2 - 4) С азотом:
3Ca + N2 –t°→ Ca3N2 - 5) С фосфором:
3Ca + 2P –t°→ Ca3P2 - 6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH - Ca + H2 → CaH2
2. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl2 + H2
- 2Al+ 6HCl → 2AlCl3 + 3H2
- 6Na + 2H3PO4 → 2Na3PO4 + 3H2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!

- Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
- 4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
- 3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
- 2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
- 10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
- 4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H2O → 2NaOH + H2
- Ca+ 2H2O → Ca(OH)2 + H2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H2O –t°→ ZnO + H2
- 3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl2 → Hg+ CuCl2
- Fe+ CuSO4 → Cu+ FeSO4

В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Источник: http://www.yoursystemeducation.com/obshhie-fizicheskie-i-ximicheskie-svojstva-metallov/
Свойства металлов – химические, физические, механические
Когда-то пресловутая фраза «люди гибнут за сталь» была символом важности данного материала в жизни людей. Да и сегодня он не потерял своей актуальности.
Он активно используется в самых разных областях жизнедеятельности человека, начиная со строительства и производства высокотехнологичных изделий, заканчивая предметами роскоши и украшениями.
По этой причине свойства интенсивно исследовались и сейчас изучаются ведущими умами и крупнейшими корпорациями.
Что же это такое?
На сегодняшний день известно огромное количество различных металлов. Каждый из них обладает определенными характеристиками, отличающим его от других химических элементов или материалов. Однако существуют определенные признаки, которые однозначно говорят, что мы имеем дело с металлическим компонентом:
- Высокая теплопроводность и низкое электрическое сопротивление. Другие составы не обладают таким сочетанием. К примеру, графит проводит электричество, но не тепло.
- Присутствие блеска в области излома.
- Подверженность ковке.
- Кристаллы в структуре.
Какие виды встречаются?
Свойства металлов во многом зависят от того, к какому виду тот или иной ингредиент относится. В этом ракурсе стоит выделить черные и цветные компоненты.

Чермет
Данная группа считается самой распространенной и востребованной в объемном ракурсе. Свое название они получили благодаря своему цвету – темному. При этом отличительной особенностью черных руд считается низкая стоимость.
В свою очередь, классифицируется на:
- железные – сюда стоит отнести железосодержащие материалы и основы, а также никелевые и кобальтовые сплавы;
- тугоплавкие основания для сплавов (имеют температуру плавления равную или превышающую 1600 градусов Цельсия, что является достаточно высоким показателем);
- низкопрочностные редкоземельные элементы, такие как церий, неодим и другие (активно используются в производстве микроэлектроники).

Цветмет
Принято считать, что эта группа элементов отличается меньшими прочностными характеристиками, температурой плавления, устойчивостью к механическим нагрузкам, но более солидной стоимостью. Понятно, что по всем этим позициям встречаются исключения.
Цветные ранжируют на следующие категории:
- Легкие – литий, натрий и так далее. Они характеризуются небольшой плотностью – до 5 тонн на метр кубический. Это всего в 5 раз больше воды.
- Тяжелые – свинец, серебро, золото. Их плотность в разы выше легких.
- Благородные – те же золото и серебро, а также платина, плутоний.
Также поделить «цветные» разновидности можно на тугоплавкие и легкоплавкие.
Сплавы – основная форма представления
В чистом виде подобного рода элементы в природе и жизнедеятельности человека не встречаются. Да и без примесей они не просто неустойчивы, но бесполезны. Даже золотые и серебряные мерные слитки в банках имеют определенный процент добавок, в том числе и для увеличения прочностных характеристик. Кстати, они в буквальном смысле меняются кардинальным образом от варианта метсплава.
Физические свойства металлов
В данном случае речь идет о различных визуальных аспектах, а также параметрах, связанных с физикой. Можно привести сравнительную таблицу:
| Показатели | Категории | Примеры |
| Электрическая проводность | проводник диэлектрик |
железо магний |
| Температура плавления | низкая высокая |
ртуть хром |
| Удельный вес | малый большой |
берилий осьмий |
| твердость | мягкий высокотвердый |
натрий вольфрам |
На практике знание физических свойств металла описывает сферу использования того или иного мономатериала. В частности, электропроводность определяет область применения в электронике, как вариант, германий – полупроводники, серебро – дорожки микросхем.
К физ. характеристикам также относят цветопередачу – зрительный параметр, который может изменяться под воздействием различных факторов, например, температуры или наличия-отсутствия защитного покрытия. Многие цвета, кстати, были названы в честь хим. элементов – золотой, серебристый, медный и так далее.
Химические свойства металлов
Таблица Менделеева на треть состоит из рассматриваемых в данной статье моноэлементов. С практической точки для обывателя, да и специалиста, эти аспекты определяют их взаимодействие с окружающими агрессивными средами, такими как реагенты из воздушной массы, влажность, перепады температурных показателей, как суточных, так и годовых.
В этом ракурсе металлопозиции утрировано разделяются на следующие группы:
- Активные. В качестве примеров можно привести литий, калий, барий, кальций, натрий.
- Среднеактивные – магний, алюминий, марганец, цинк, хром, железо, никель, серебро.
- Малоактивные. Речь идет о меди, золотых слитках, платине и иных инертных компонентах.
Соединение с простыми веществами
Самым популярным в мире соединением, которое формируется между двумя одинаковыми элементами – это, безусловно, оксид. Ярким примером, который считается весьма распространенным и не очень приятным с практической точки зрения, считается окись железа – ржавчина (каждый из нас сталкивался с коррозионными процессами):
2FE + O2 = 2FEO.
Важно знать, что благородные металлоэлементы, такие как серебро, золото и платина, оксиды в обычных условиях не образуют. Это и является одной из основных причин их высокой стоимости.
О взаимодействии с галогенами (фтором, хлором и другими позициями, которые присутствуют в окружающей среде) также не стоит забывать. Вариант: образование солей:
2Na + Cl2 = 2 NaCl.
Реакции со сложными соединениями
Здесь в первую очередь необходимо отметить взаимодействие щелочей с водой. Такие реакции всегда сопровождаются выделение водорода, что на практике чревато формированием взрывоопасной среды.
Среднеактивные также могут реагировать с H2O. Однако происходит это при достаточно высоких температурах, поэтому в обычных условиях повышения концентрации водорода не стоит.
Механические свойства металлов
Данные сведения не рассматриваются как расчетные величины. Они определяются в процессе экспериментальных изысканий, в частности, деформации заготовок на растяжение и сжатие с применением специализированного оборудования.
Основными называют:
- Прочность. Под этим аспектом принято понимать способность сохранять кристалическую целостность под воздействием мех. нагрузок различного типа, как статических, так и динамических, в том числе ударного формата. Чем прочнее монометалл, тем он долговечнее в тех конструкциях, где материал подвергается серьезным перегрузкам. Особенно это бывает актуально в тех областях, где от прочностных показателей зависит жизнь и здоровье человека, например, на транспорте.
- Пластичность – характеристика, отражающая потенциал того или иного моноэлемента либо сплава под усилиями от внешних сил изменять свою геометрию и объем. При этом, опять же, физического разрушения кристаллической решетки не должно быть.
- Твердость. Понятно, что подавляющее большинство металлических брусков руками не проверишь – для железа и алюминия ощущения будут одинаковыми. Для этого используются специальные приспособления – приборы Бриннеля или изобретение Роквелла. В первом случае в образец пытаются «впихнуть» сильнозакаленный шар, во втором – алмазную пирамиду. По размеру следа от давления и устанавливается плотность того или иного состава.
Здесь важно понимать, что прочность и твердость – это разные механические свойства металлов, порой, даже не взаимозначимые. Твердые образцы могут быть хрупкими.
- Ударная вязкость. Как следует из названия речь идет о возможности противостоять нагрузкам при целенаправленных ударах. Измеряется в джоулях на сантиметр кубический.
- Упругость. Под действием различного рода сил образец изменяет свою форму и объем. Способность восстановить свои начальные параметры и определяют упругость.
Также к механике относятся конструкторские особенности – надежность, живучесть, долговечность.
Технологические характеристики
При оценке целесообразности выбора того или иного металла для решения конкретных практических, производственных задач, необходимо учитывать:
- Ковкость. Под давлением производится обработка изделий. При этом полного разрушения не наблюдается, однако структура кристаллической решетки изменяется. В результате могут меняться механические, физические и даже химические факторы изделий.
- Свариваемость. Возможность формирования сварных соединений с применением стандартных технологий.
- Усадка – определяется соответствующим коэффициентом. При нагреве любой объект расширяется, после охлаждения – уменьшается. Так вот соотношение и определяет данное свойство. Кстати, далеко не всегда малое усадочное значение являет собой благо. К примеру, ртутные термометры работают именно за счет предельно большого коэффициента расширения.
- Податливость режущим инструментам. С технологической точки зрения производственную ценность имеет только тот компонент, который можно сравнительно просто обработать или изготовить этот самый технический инструментарий.
Рассматриваемые направления характеризуют поведение уже готовых производственных изделий, товаров в процессе эксплуатации.
Таким образом, металлы – весьма распространенный материал, который активно используется в самых разных областях жизнедеятельности. Это обусловлено широкой вариативностью физических, химических, механических параметров продукции.
Источник: https://ometallah.com/poleznoe/svojstva-metallov-himicheskie-fizicheskie-mehanicheskie.html




