
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
- 4HNO3 = 4NO2 + 2H2O + O2.
- Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями.
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния.
Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO3), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
Mr = 63, 01; d = 1, 503(25); tпл = -41, 6 oC; tкип +82,6 oC (разл.).


1. Типичные свойства кислот:
- 1) Взаимодействует с основными и амфотерными оксидами:
- 2HNO3 + CuO = Cu(NO3)2 + H2O
- 6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
- 2) С основаниями, амфотерными гидроксидами:
- HNO3 + NaOH = NaNO3 + H2O
- 2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
- 3) Вытесняет слабые кислоты из их солей:
- 2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2
- 2HNO3 + Na2SiO3 = H2SiO3 ↓+ 2NaNO3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода.
Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже.
Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.



4 HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 H2O- N+5 + 1e → N+4 2 окислитель, пр-с восстановления
- Cu0 – 2e → Cu+2 1 восстановитель, пр-с окисления
- 8 HN+5O3(разб.) + 3 Cu0 = 3 Cu+2(NO3)2 + 2 N+2O + 4 H2O
- N+5 + 3e → N+2 2 окислитель, пр-с восстановления
- Cu0 – 2e → Cu+2 3 восстановитель, пр-с окисления

- 2) Проявляет окислительные свойства при взаимодействии с неметаллами:
- S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O;
- B + 3HNO3 = H3BO3 + 3NO2;
- 3P + 5HNO3 + 2H2O = 5NO + 3H3PO4.
- 3) Азотная кислота окисляет сложные вещества:
- 6HI + 2HNO3 = 3I2 + 2NO + 4H2O;
- FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O.
- 4) Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую.
Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
- 5) Окислительные свойства «царской водки»:
- Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
- HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O;
- 4HNO3 + 18HCl + Pt = 3H2[PtCl6] + 4NO + 8H2O
4HNO3 = 4NO2 + 2H2O + O2 (комн., на свету).
HNO3 + H2O = NO3– + H3O+.
HNO3 (разб.) + NaOH = NaNO3 + H2O ,
HNO3 (разб.) + NH3 · H2O = NH4NO3 + H2O.
- 2HNO3 (2-3%-я) + 8H0(Zn, разб. H2SO4) = NH4NO3 + 3H2O,
- 2HNO3 (5%-я) + 8H0(Mg, разб. H2SO4) = N2O ↑ + 5H2O,
- HNO3 (30%-я) + 3H0(Zn, разб. H2SO4) = NO2↑ H2O,
HNO3 (60%-я) + 2H0(Zn, разб. H2SO4) = HNO2 + H2O. (кат Pd)
2HNO3 (конц.) +Ag = AgNO3 + NO2 ↑ + H2O.
- 8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
- 10HNO3 (разб.) + 4Mg = 4Mg(NO3)2 +N2O↑ + 5H2O (примесь H2)
- 12HNO3 (разб.) + 5Sn —t—5Sn(NO3)2 + N2 ↑ + 6H2O (примесь NO)
30HNO3 (оч. разб.) + 8Al = 8Al(NO3)3 + 3 NH4NO3 + 9H2O (примесь H2)
12HNO3 (оч. разб.) + 5Fe = 5Fe(NO3)2 + N2 ↑ + 6H2O (0-10 oC),
4HNO3 (разб.) + Fe = Fe(NO3)3 + NO↑ + 2H2O.
4HNO3 (конц., гор.) + Hg = Hg(NO3)2 + 2NO2 ↑ + 2H2O,
8HNO3(разб., хол) + 6Hg = 3Hg2(NO3)2 + 2NO ↑ + 4H2O.
6HNO3 (конц.) + S = H2SO4 + 6NO2 ↑ + 2H2O (кип.),
2HNO3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl2↑ + 4H2O (100-150 oC).
HNO3 (конц.) + 4HCl(конц.) + Au = H[AuCl4] + NO↑ + 2H2O.
4HNO3 (конц.) + 18HCl(конц.) + 3Pt = 3H2[PtCl6] + 4NO↑ + 8H2O
4HNO3 (конц.) + 18HF(конц.) + 3Si = 3H2[SiF6] + 4NO↑ + 8H2O.
4HNO3 (дымящ.) + P4O10 = 2N2O5 + 4HPO3 (в атмосфере O2+O3)
Источник: http://himege.ru/azotnaya-kislota-stroenie-i-ximicheskie-svojstva/
Оксиды азота. Азотная кислота
- Известны несколько оксидов азота.
- Несолеобразующие оксиды: N2O, NO
- Солеобразующие оксиды: N2O3, NO2, N2O4, N2O5
- Все оксиды азота, кроме N2O, ядовитые вещества.
- Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
- 2N2O = 2N2 + O2
- В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
- Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
- N2 + O2 = 2NO
- В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
- 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
- Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
- 4NH3 + 5O2 = 4NO + 6H2O
- Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):
- 2NO + O2 = 2NO2
 Оксид азота (IV)
Оксид азота (IV)
Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
- 2NO2 + H2O = HNO2 + HNO3
- При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
- 4NO2 + O2 + 2H2O ⇄ 4HNO3
- При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
- 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
- В избытке кислорода образуется только нитрат натрия:
- 4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
- Ниже 22 0С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0С превращается в бесцветные кристаллы.
- В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
- Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
- В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
- Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
 Оксид азота (III)
Оксид азота (III)
- N2O3 + H2O = 2HNO2
- Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
- N2O5 + H2O = 2HNO3
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
- Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
- 4HNO3 ⇄ 2H2O + 4NO2↑ + O2↑
- Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
 Азотная кислота
Азотная кислота
- Кислотно – основные свойства
- Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
- HNO3 ⇄ H+ + NO3—
- Как и все кислоты, она реагирует:
- а) с оксидами металлов:
- MgO + 2HNO3 = Mg(NO3)2 + H2O
- б) с основаниями:
- Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
- в) с солями более слабых кислот:
- K2CO3 + HNO3 = KNO3 + CO2↑ + H2O
- Окислительно – восстановительные свойства
Азотная кислота является одним из сильнейших окислителей. Ее окислительно-восстановительные свойства обусловлены присутствием в молекуле HNO3 атома азота в высшей степени окисления N+5 в составе кислотного остатка NO3—. Окислительные свойства кислотного остатка NO3— значительно сильнее, чем ионов водорода Н+, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины, находящимися в конце ряда напряжений. Так как окислителем в HNO3 являются ионы NO3—, а не ионы Н+, то при взаимодействии HNO3 с металлами практически никогда не выделяется водород. Нитрат-ионы NO3— при взаимодействии HNO3 с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл. На следующей схеме показано, какие продукты могут образоваться при восстановлении HNO3:

 Общая схема взаимодействия азотной кислоты с металлами
Общая схема взаимодействия азотной кислоты с металлами
- Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
- 10HNO3 + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
- Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
- 4HNO3 + Ni = Ni(NO3)2 + 2NO2↑ + 2H2O
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
- 5HNO3 + P = HPO3 + 5NO2↑ + 2H2O
- Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
- 3Al + 12HNO3 = Al(NO3)3 + Al2O3 + 9NO2↑ + 6H2O
- Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
- 10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
- При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
- 8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
- Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:
- 2HNO3 + S = H2SO4 + 2NO↑
 Взаимодействие азотной кислоты с медью
Взаимодействие азотной кислоты с медью
Получение
- В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
- Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
- В промышленности получение азотной кислоты идет в три стадии:
- Окисление аммиака до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
- Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
- Растворение оксида азота (IV) в воде и избытком кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
- Все соли азотной кислоты хорошо растворимы в воде.
- Соли азотной кислоты, как и она сама, являются сильными окислителями.
- При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:

- Примеры:
- 2NaNO3 = 2NaNO2 + O2↑
- 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
- 2AgNO3 = 2Ag + 2NO2↑ + O2↑
- *на изображении записи кристаллы нитрата меди (II)
Источник: https://al-himik.ru/oksidy-azota-azotnaja-kislota/
Азотная кислота: свойства, получение и применение :
Введение
 Вы увлекаетесь цветоводством и пришли в магазин, чтобы купить удобрения для своих цветов. Пересматривая различные названия и составы, вы заметили бутыль с надписью «Азотное удобрение». Читаем его состав: «Фосфор, кальций, то-се… Азотная кислота? А это еще что за зверь?!». Обычно с азотной кислотой знакомятся именно в такой обстановке. И многим тогда же захочется узнать о ней побольше. Сегодня я постараюсь удовлетворить ваше любопытство.
Вы увлекаетесь цветоводством и пришли в магазин, чтобы купить удобрения для своих цветов. Пересматривая различные названия и составы, вы заметили бутыль с надписью «Азотное удобрение». Читаем его состав: «Фосфор, кальций, то-се… Азотная кислота? А это еще что за зверь?!». Обычно с азотной кислотой знакомятся именно в такой обстановке. И многим тогда же захочется узнать о ней побольше. Сегодня я постараюсь удовлетворить ваше любопытство.
Определение
Азотная кислота (формула HNO3) является сильной одноосновной кислотой. В неокисленном состоянии она выглядит так, как на фото 1. В обычных условиях это жидкость, но ее можно перевести в твердое агрегатное состояние. И в нем она напоминает кристаллы, имеющие моноклинную или ромбическую решетку.
Химические свойства азотной кислоты
 Имеет способность хорошо смешиваться с водой, где происходит почти полная диссоциация этой кислоты на ионы. Концентрированная азотная кислота имеет бурый цвет (фото). Его обеспечивает разложение на диоксид азота, воду и кислород, происходящее из-за солнечного света, который падает на нее. Если ее нагреть, произойдет такое же разложение. С ней реагируют все металлы, за исключением тантала, золота и платиноидов (рутения, родия, палладия, иридия, осмия и платины). Однако ее соединение с соляной кислотой может даже растворять некоторые из них (это так называемая «царская водка»). Азотная кислота, имеющая любую концентрацию, может проявляться в качестве окислителя. Многие органические вещества при взаимодействии с ней могут самовоспламеняться. А некоторые металлы в этой кислоте будут пассивироваться. При действии на них (а также при реакции с оксидами, карбонатами и гидроксидами) азотная кислота образует свои соли, носящие название нитратов. Последние хорошо растворяются в воде. Но нитрат-ионы в ней не гидролизуются. Если нагреть соли данной кислоты, то произойдет их необратимое разложение.
Имеет способность хорошо смешиваться с водой, где происходит почти полная диссоциация этой кислоты на ионы. Концентрированная азотная кислота имеет бурый цвет (фото). Его обеспечивает разложение на диоксид азота, воду и кислород, происходящее из-за солнечного света, который падает на нее. Если ее нагреть, произойдет такое же разложение. С ней реагируют все металлы, за исключением тантала, золота и платиноидов (рутения, родия, палладия, иридия, осмия и платины). Однако ее соединение с соляной кислотой может даже растворять некоторые из них (это так называемая «царская водка»). Азотная кислота, имеющая любую концентрацию, может проявляться в качестве окислителя. Многие органические вещества при взаимодействии с ней могут самовоспламеняться. А некоторые металлы в этой кислоте будут пассивироваться. При действии на них (а также при реакции с оксидами, карбонатами и гидроксидами) азотная кислота образует свои соли, носящие название нитратов. Последние хорошо растворяются в воде. Но нитрат-ионы в ней не гидролизуются. Если нагреть соли данной кислоты, то произойдет их необратимое разложение.
Получение
Для получения азотной кислоты синтетический аммиак окисляют с помощью платино-родиевых катализаторов до появления смеси нитрозных газов, которые в дальнейшем поглощаются водой. Также она образуется, когда смешивают и нагревают калиевую селитру и железный купорос.

Применение
С помощью азотной кислоты производят минеральные удобрения, взрывчатые и некоторые отравляющие вещества. Ею травят печатные формы (офортные доски, магниевые клише и т.д.), а еще подкисляют тонирующие растворы для фото. Из азотной кислоты производят красители и лекарства, а также с ее помощью определяют наличие золота в золотых сплавах.

Физиологическое воздействие
Учитывая степень влияния азотной кислоты на организм, ее относят к 3-му классу опасности (умеренно опасная). Вдыхание ее паров приводит к раздражению дыхательных путей. При попадании на кожу азотная кислота оставляет множество долго заживающих язв.
Участки кожи, куда она попала, становятся характерного желтого цвета (фото). Говоря научным языком, происходит ксантопротеиновая реакция.
Диоксид азота, который получается при нагревании азотной кислоты или ее разложении на свету, очень токсичен и может вызвать отек легких.
Заключение
Азотная кислота приносит пользу человеку как в разбавленном, так и в чистом состоянии. Но чаще всего она встречается в составе веществ, многие из которых вам наверняка знакомы (например, нитроглицерин).
Источник: https://www.syl.ru/article/86707/azotnaya-kislota-svoystva-poluchenie-i-primenenie
Азотная кислота — урок. Химия, 8–9 класс
Азотная кислота HNO3 — бесцветная дымящая на воздухе жидкость с неприятным запахом. При хранении на свету она разлагается и может окрашиваться в жёлтый цвет за счёт образования бурого оксида азота((IV)):
4HNO3=2H2O+4NO2↑+O2↑.

- Азотная кислота смешивается с водой в любых соотношениях и в водном растворе полностью распадается на ионы:
- HNO3→H++NO3−.
- Азотная кислота реагирует с основными и амфотерными оксидами и гидроксидами с образованием нитратов:
- CuO+2HNO3=Cu(NO3)2+H2O,
- Al(OH)3+3HNO3=Al(NO3)3+3H2O.
- Азотная кислота вступает в реакции обмена с солями других кислот, если образуется газ или осадок:
- CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑.
- В отличие от других кислот азотная кислота реагирует с большинством металлов, кроме благородных.
Обрати внимание!
В реакциях азотной кислоты с металлами никогда не образуется водород.
Окислителем в этих реакциях выступает атом азота кислотного остатка, поэтому продуктами реакции являются соединения азота в разной степени окисления. Состав соединений зависит от активности металла и концентрации азотной кислоты. Так, при взаимодействии концентрированной азотной кислоты с медью образуется бурый оксид азота((IV)):
4HN+5O3+Cu0=Cu+2(NO3)2+2N+4O2+2H2O.

- Медь с концентрированной азотной кислотой
- При взаимодействии разбавленной азотной кислоты с медью продукт реакции — бесцветный оксид азота((II)):
- 8HN+5O3+3Cu0=3Cu+2(NO3)2+2N+2O+4H2O.
Обрати внимание!
Концентрированная азотная кислота пассивирует железо и алюминий.
На их поверхности под действием концентрированной кислоты образуется прочная плёнка, которая защищает металл от дальнейшей реакции. Поэтому концентрированную азотную кислоту можно транспортировать в стальных или алюминиевых цистернах.
Азотная кислота способна окислять и другие неорганические и органические вещества. Органические вещества могут воспламеняться при соприкосновении с азотной кислотой, и работа с ней требует аккуратности и осторожности.
Азотная кислота используется в промышленности для получения:
- минеральных удобрений,
- лекарств,
- взрывчатых веществ,
- пластмасс,
- красителей,
- лаков.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/azot-i-ego-soedineniia-161796/re-a96cc21b-4869-48e8-ac34-3ef34508d004
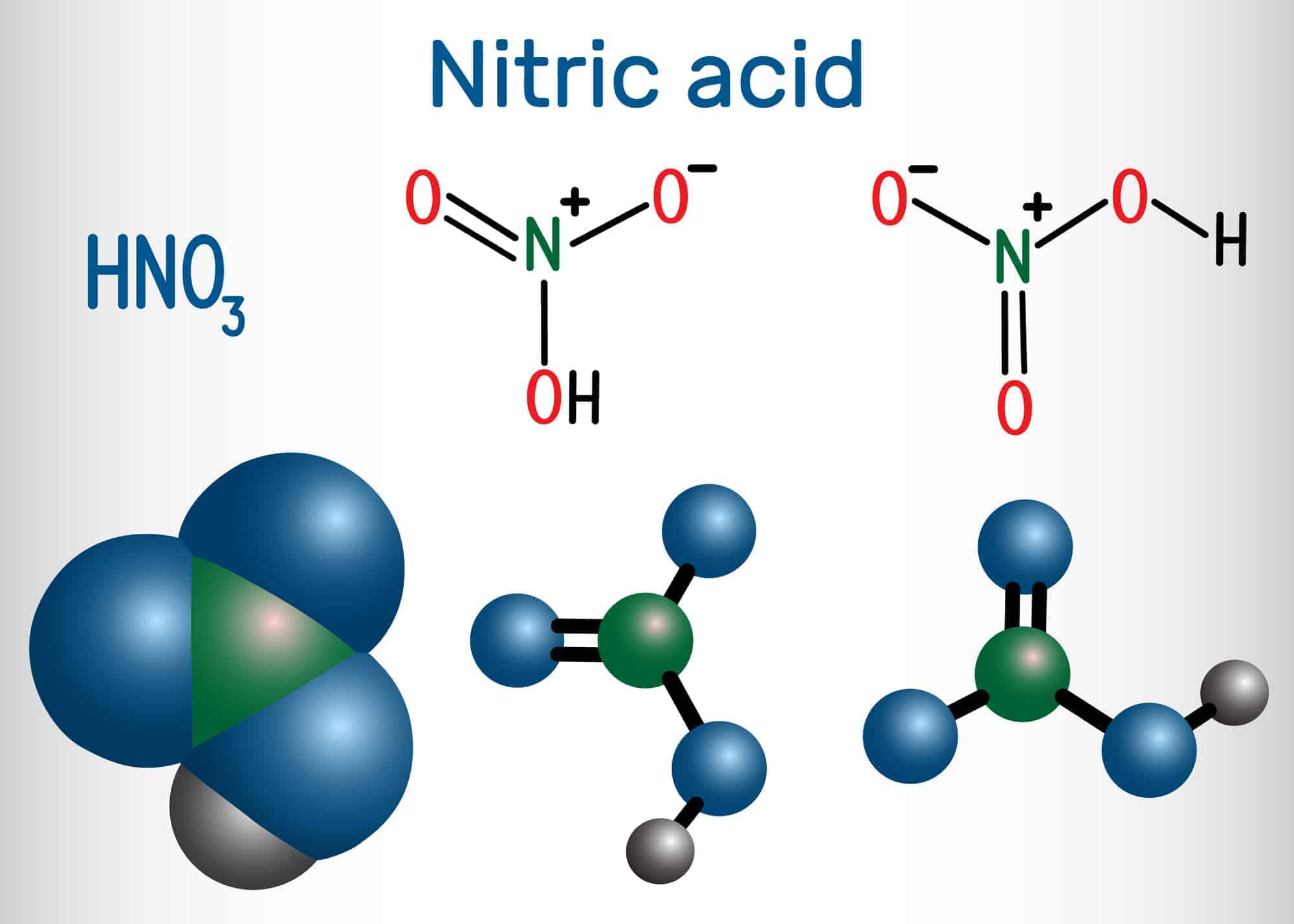
Формула Азотной кислоты структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: HNO3
Химический состав Азотной кислоты
| O | Кислород | 15.999 | 3 | 76,2% |
| H | Водород | 1.008 | 1 | 1,6% |
| N | Азот | 14.007 | 1 | 22,2% |
Молекулярная масса: 63,012
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O).
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении) с частичным разложением.
Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой.
С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения. ри нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила.
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия).
Большинство нитратов получают искусственно.
Азотная кислота по степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы.
При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета).
ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3.
Источник: http://formula-info.ru/khimicheskie-formuly/a/formula-azotnoj-kisloty-strukturnaya-khimicheskaya
Азотная кислота
Азотная кислота относится к основным соединениям азота. Химическая формула – HNO3. Так какими же физическими и химическими свойствами обладает это вещество?

Чистая азотная кислота не имеет цвета, обладает резким запахом, а на воздухе имеет особенность “дымиться”. Молярная масса составляет 63 г/моль. При температуре -42 градуса переходит в твердое агрегатное состояние и превращается в белоснежную массу. Безводная азотная кислота закипает при 86 градусах. В процессе смешивания с водой образует растворы отличные друг от друга по концентрации.
Данное вещество является одноосновной, то есть всегда имеет одну карбоксильную группу. Среди кислот, которые относятся к мощным окислителями, азотная кислота является одной из сильнейших. Она вступает в реакцию со многими металлами и неметаллами, органическими соединениями за счет восстановления азота
Нитраты – соли азотной кислоты. Чаще всего их используют в качестве удобрений в сельском хозяйстве
Электронную и структурную формулу азотной кислоты изображают следующим образом:
Рис. 1. Электронная формула азотной кислоты.
Концентрированная азотная кислота подвержена воздействию света и под его действием способна разлагаться на оксиды азота. Оксиды, в свою очередь, взаимодействуя с кислотой, растворяются в ней и придают жидкости желтоватый оттенок:
Хранить вещество следует в прохладном и темном месте. При повышении ее температуры и концентрации процесс распада происходит значительно быстрее. Азот в молекуле азотной кислоты всегда имеет валентность IV, степень окисления +5, координационное число 3.
Так как азотная кислота является очень сильной кислотой, в растворах она полностью разлагается на ионы. Она реагирует с основными оксидами, с основаниями, с солями более слабых и более летучих кислот.
Рис. 2. Азотная кислота.
Эта одноосновная кислота – сильнейший окислитель. Азотная кислота действует на многие металлы. В зависимости от концентрации, активности металла и условий проведения реакции может восстанавливаться с одновременным образованием соли азотной кислоты (нитрата) до соединений.
Когда азотная кислота взаимодействует с малоактивными металлами образуется NO2:
Cu+4HNO3 (конц.)=Сu(NO3)2 +2NO2+2H2O
Разбавленная азотная кислота в такой ситуации восстанавливается до NO:
3Cu+8HNO3(разб.)=3Сu(NO3)2 +2NO+4H2O
Если в реакцию с разбавленной азотной кислотой вступают более активные металлы, то выделяется NO2:
4Mg+10HNO3 (разб.)=4Mg(NO3)2+N2O+5H2O
Очень разбавленная азотная кислота при взаимодействии с активными металлами восстанавливается до солей аммония:
4Zn+10HNO3 (очень разб.)=4Zn(NO3)2+NH4NO3+3H2O
В концентрированной азотной кислоте устойчивы Au, Pt, Rh, Ir, Ta, Ti. Металлы Al, Fe, Cr она «пассивирует» в результате образования на поверхности металлов оксидных пленок.
Смесь, образованная из одного объема концентрированной азотной и трех объемов концентрированной хлороводородной (соляной) кислоты называется «царской водкой».
Рис. 3. Царская водка.
Неметаллы окисляются азотной кислотой до соответствующих кислот, а азотная кислота в зависимости от концентрации восстанавливается до NO или NO2:
С+4HNO3 (конц.)=CO2+4NO2+2H2O
S+6HNO3 (конц.)=H2SO4+6NO2+2H2O
Азотная кислота способна окислять некоторые катионы и анионы, а также неорганические ковалентные соединения, например, сероводород.
3H2S+8HNO3 (разб.)= 3H2SO4 +8NO+4H2O
Азотная кислота взаимодействует со многими органическими веществами, при этом один или несколько атомов водорода в молекуле органического вещества заменяются нитрогруппами – NO2. Этот процесс называется нитрованием.
Азотная кислота – жидкость, которая не имеет цвета, но обладает резким запахом. Особенностью этой кислоты является то, что она может смешиваться с водой в любых соотношениях. Азотная кислота также обладает рядом свойств. Она может вступать в реакцию, например, с металлами, неметаллами, оксидами, основаниями и др.
Средняя оценка: 3.9. Всего получено оценок: 247.
Источник: https://obrazovaka.ru/himiya/azotnaya-kislota-formula.html
Кислоты — классификация, свойства, получение и применение
Кислоты (неорганические, минеральные) — это сложные соединения состоящие из катиона водорода (H+) и аниона кислотного остатка(SO32-, SO42-, NO3— и т.д).
Кислотам дали такое название не просто так. Большинство из них имеют кислый вкус. С некоторыми из них знаком каждый из вас. Это, например, уксусная кислота, которая есть в каждом доме, аскорбиновая кислота (она же витамин C), лимонная кислота и т.д. Но не стоит все кислоты пробовать на вкус. Кислоты являются очень едкими веществами.
Даже всем нам привычная и известная аскорбиновая кислота в большой концентрации будет вредна нашему организму. А от более сильных кислот — серной, соляной и даже уксусной — можно получить очень сильные ожоги, вплоть до летального исхода.
Поэтому при работе с кислотами нужно быть осторожными, а также соблюдать технику безопасности!!!
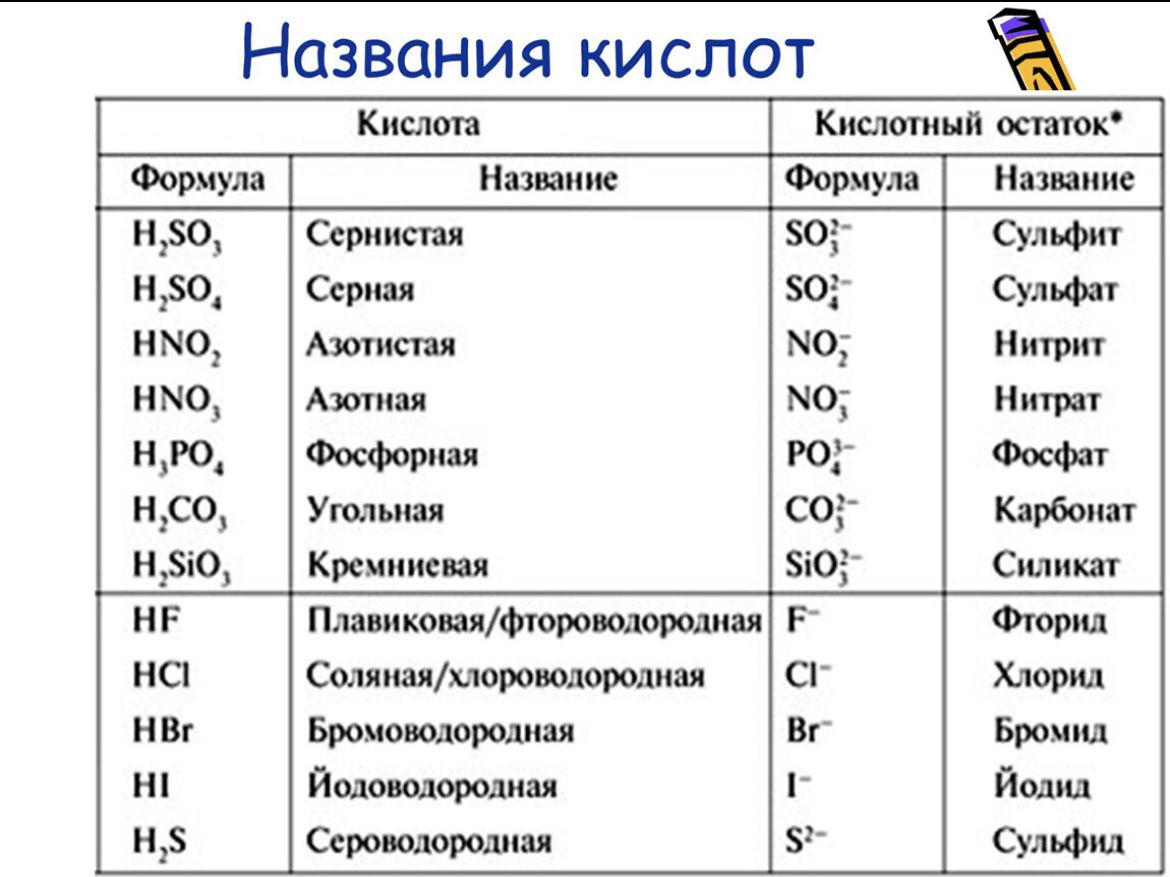
Таблица названий некоторых кислот и их солей
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | CH3COOH | Ацетат |
Классификация кислот
| Кислородсодержащие (H2SO4) | Бескислородные (HCl) |
| Одноосновные (HCl) | Двухосновные (H2SO4) | Трёхосновные (H3PO4) |
Понятие «одноосновная кислота» произошло по причине того, что для нейтрализации одной молекулы одноосновной кислоты нам понадобится одна молекула основания. для двухосновной — соответственно две молекулы и т. д.
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
| Сильные (H2SO4) | Слабые (CH3COOH) |
| Летучие (H2S) | Нелетучие (H2SO4) |
| Устойчивые (H2SO4) | Неустойчивые (H2CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
- Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
H2SO4 + 2Na → Na2SO4 + H2↑
Металлы, находящиеся в ряду активности после водорода, не вступают в реакцию с кислотой (кроме концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
- Взаимодействуют с оксидами основных и амфотерных металлов с образованием солей и воды:
H2SO4 + MgO → MgSO4 + H2O
- С основаниями, с образованием солей и воды (так называемая реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + H2O
- Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2↑
- Сильные кислоты могут вытеснять из солей более слабые кислоты:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Получение кислот
- Взаимодействие кислотного оксида с водой:
H2O + SO3 →H2SO4
- Взаимодействие водорода и неметалла:
H2 + Cl2 → 2HCl
- Вытеснение слабой кислоты из солей, более сильной кислотой:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.

Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).
Источник: https://in-chemistry.ru/kisloty-klassifikatsiya-svojstva-poluchenie-primenenie




