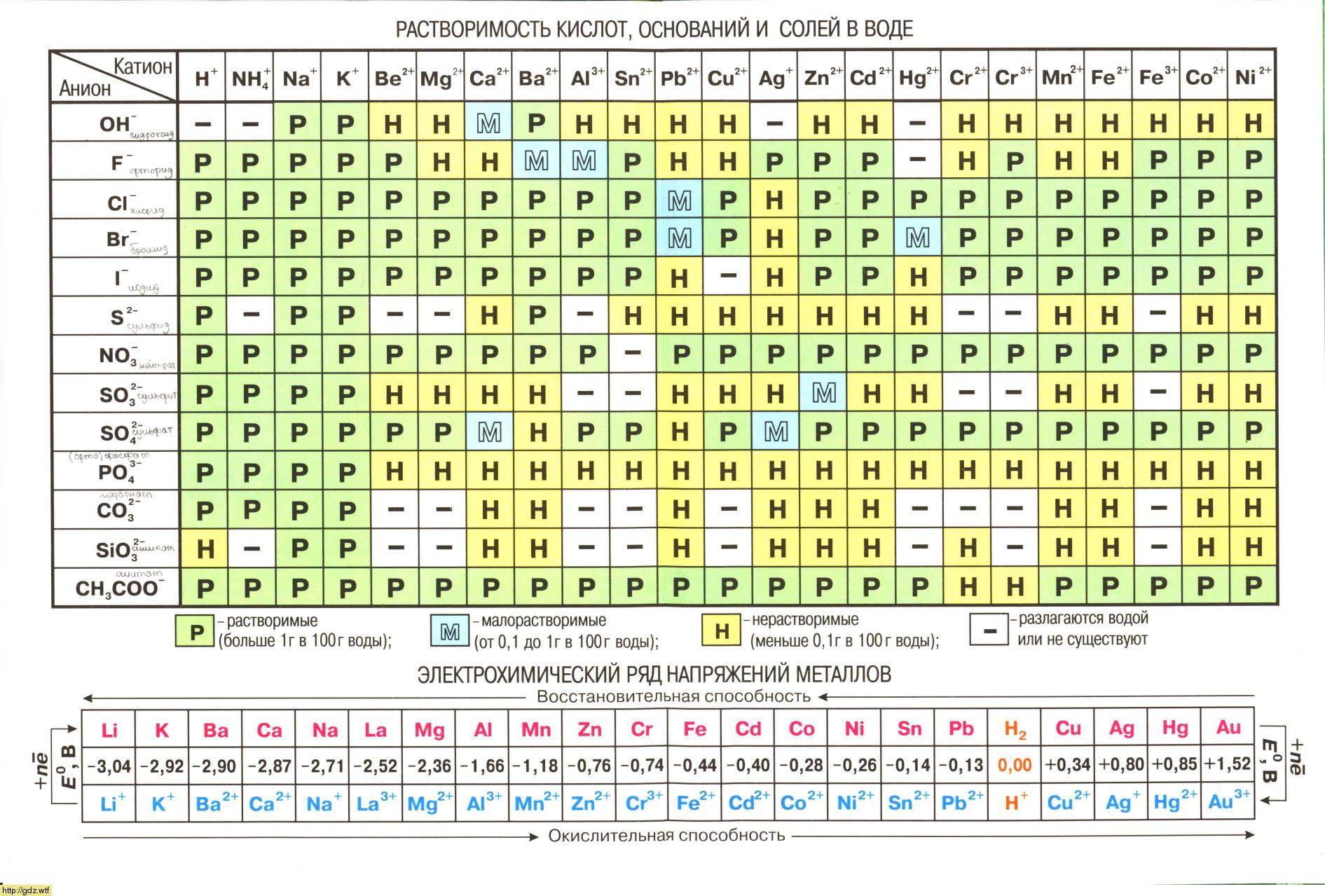
Нашатырный спирт известен как эффективное средство от кашля и насморка. Ватка, смоченная в резко пахнущей жидкости, выведет из состояния кратковременной потери сознания. Аммиачная вода насытит почву азотом и отмоет до блеска оконные стекла.
Химический продукт не обошла вниманием и пищевая индустрия. В списке разрешенных добавок вещество зарегистрировано под номером E 527.
Название продукта
Основное название добавки — гидроксид аммония. Международный вариант — Ammonium Hydroxide.
Синонимы:
- Е 527 (Е–527), европейский код;
- гидрат аммиака;
- гидрат окиси аммония;
- аммиачная вода;
- аммиак водный;
- едкий аммиак;
- едкий аммоний;
- нашатырный спирт;
- hydroxid de ammonium, французский;
- Ammoniumhydroxid, немецкий.
Тип вещества
 Пищевая добавка E 527 включена в группу стабилизаторов-эмульгаторов. Основная технологическая функция — регулятор кислотности.
Пищевая добавка E 527 включена в группу стабилизаторов-эмульгаторов. Основная технологическая функция — регулятор кислотности.
Способ получения вещества основан на реакции газообразного аммиака с водой. Дистилляция с водяным паром и последующая конденсация дают в итоге чистый продукт, известный в различных отраслях производства как гидроксид аммония или аммиачная вода.
Продукт выпускают двух марок:
- А, для различных отраслей, включая пищевую;
- Б, для сельскохозяйственных нужд в качестве азотного удобрения.
Свойства
| Показатель | Стандартные значения |
| Цвет | бесцветный, допускается желтоватый оттенок |
| Состав | гидрат аммиака, химическая формула NH4OH |
| Внешний вид | прозрачная жидкость |
| Запах | резкий характерный |
| Растворимость | хорошо растворим в воде |
| Содержание основного вещества | не менее 27% |
| Вкус | специфический |
| Плотность | 0,91 (раствор 25 %) г/см3 |
| Другие | термически неустойчив, при кипячении распадается с выделением аммиака; трудногорючий |
Упаковка
Предприятия-изготовители крупные партии гидроксида аммония разливают в цистерны или специализированные аммиаковозы.
В качестве потребительской тары используют:
- пластиковые канистры;
- стеклянные бутыли;
- бутылки пластиковые.
Применение
Гидроксид аммония в качестве пищевой добавки применяют крайне ограниченно. 
Иногда включают в состав карамели для регулирования уровня pH.
Аммиачную воду, разбавленную до концентрации 10%, используют в медицинских целях под названием «нашатырный спирт» (не путать с нашатырем — хлоридом аммония):
- с помощью препарата человека выводят из обморочного состояния;
- добавку E 527 используют для обработки ссадин, следов от укусов насекомых: вещество имеет выраженные антисептические свойства, обладает способностью устранять зуд;
- на ее основе изготавливают уникальную аммиачно-камфарную суспензию, нашедшую применение в народной медицине для устранения болей различного характера (зубная, головная, суставная).
Нашатырный спирт — популярное средство для лечения затяжного кашля. Рецепт прост: надо добавить 2–3 капли (не больше!) препарата на полстакана горячего молока, хорошо перемешать. 
- краски для волос, препараты для химической завивки, выпрямления. Вещество запускает реакцию распада перекиси водорода, способствует раскрытию волоса;
- шампуни;
- тушь для ресниц, подводка для глаз;
- средства для пилинга;
- отбеливающие маски.
Гидроксид аммония применяют в сельском хозяйстве. На его основе получают соли аммония — ценное азотное удобрение.
Добавка E 527 допущена к применению в России, Беларуси, Украине, странах Евросоюза, США, Канаде. Не имеет разрешения в Австралии.
Допустимая норма не установлена.
Польза и вред
Гидрат аммиака по степени вреда для человека относится к 4 классу (малоопасное вещество). Сама по себе добавка Е 527 нейтральна: не оказывает ни положительного, ни отрицательного влияния.
Прием внутрь больших доз нашатырного спирта вызывает расстройство работы ЖКТ, негативно влияет на печень и почки.
Опасен газообразный аммиак, выделяющийся при определенных условиях из водного раствора (например, при нагревании, длительной работе с высокой концентрацией продукта). 
- слезотечение,
- удушливый кашель;
- ожог слизистых (особенно опасно для глаз);
- головокружение;
- рвоту.
Концентрированные аммиачные пары взрывоопасны, горючи.
Основные производители

- ОАО «Акрон» (город Великий Новгород);
- химическая компания «Щекиноазот» (Тульская область);
- ОАО «Тольяттиазот».
Ведущие зарубежные производители:
- Knuchel Farben AG (Германия);
- Cutrin (Финляндия);
- Lubon Industry Co., Ltd.(Китай).
Гидроксид аммония нельзя назвать полезным для здоровья веществом, но в составе продуктов питания его процент незначителен.
Время от времени в прессе разворачивается компания против закусочных быстрого питания.
Скандалы разгораются на фоне слухов, что в Макдональдсе и подобных заведениях мясо обрабатывают аммиачной водой для дезинфекции, получения ровного розового цвета и придания продукту товарного вида.
Владельцы ссылаются на разрешающий статус добавки E 527. Под напором общественного мнения небезопасная жидкость была исключена из технологического процесса, ее заменили кислотами (яблочной, муравьиной).
Источник: https://vkusologia.ru/dobavki/stabilizatory-emulgatory/e527.html
Гидроксид аммония

Получение гидроксида аммония
Гидроксид аммония представляет собой водный раствор аммиака. Раствор прозрачный, с резким и едким запахом. Промышленным способом и в больших количествах получение гидроксида аммония возможно растворением в воде продуктов сжигания каменного угля.
Применение гидроксида аммония
Как пищевая добавка гидроксид аммония имеет обозначение Е527 и разрешен на территории России и Украины. Его добавляют в конфеты из карамели, какао-продукты и некоторые виды шоколада.
В этих продуктахгидроксид аммония поддерживает необходимое по рецептуре значение кислотности, играя роль буфера.
Дело в том, что какао-бобы содержат до 2% кислот в своем составе, которые при добавлении гидроксида аммония в состав продукта нейтрализуются.
Кроме пищевой промышленности, растворы гидроксида аммония широко используются в медицине, в домашнем обиходе. 10% раствор этого вещества более известен как нашатырный спирт или аммиачная вода.
При вдыхании его происходит стимуляция дыхательного центра, что применяют при потере сознания, обмороках и когда необходимо вызвать рвоту.
Наружно благодаря своим антисептическим и охлаждающим свойствам гидроксид аммония подходит для обработки рук, царапин и ссадин, укусов насекомых.

Вред гидроксида аммония
Гидроксид аммония добавляется в пищевые продукты согласно технологическим инструкциям и рекомендациям, часто в комбинации с другими гидроксидами. Норма содержания этого вещества в шоколаде и какао не должна превышать 70 г/кг сухого вещества.
В ряде стран (Новая Зеландия, Австралия, некоторые европейские страны) гидроксид аммония запрещен в качестве пищевой добавки. Имеются сведения, по которым это вещество способно негативно отражаться на здоровье человека, вызывая токсические поражения печени и кишечника.
Вред гидроксида аммония заключается в том, что это довольно нестабильное вещество легко превращается в аммиак и воду. Аммиак раздражающе действует на слизистую оболочку пищеварительного тракта. Четких норм суточного потребления гидроксида аммония не разработано.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник: https://www.neboleem.net/gidroksid-ammonija.php
Гидроксид аммония (Е527)
 Гидроксид аммония (Е527) – это пищевая добавка. Является слабым образованием, которое получено посредством соединения аммиака с водой. Данная пищевая добавка относится к группе эмульгаторов, и благодаря своим химическим свойствам чаще всего используется в качестве регулятора кислотности.
Гидроксид аммония (Е527) – это пищевая добавка. Является слабым образованием, которое получено посредством соединения аммиака с водой. Данная пищевая добавка относится к группе эмульгаторов, и благодаря своим химическим свойствам чаще всего используется в качестве регулятора кислотности.
Получение добавки
Гидроксид аммония – это соединение чистой воды и аммиака. Раствор прозрачный, обладающий едким и достаточно резким запахом.
Если рассматривать промышленное производство добавки, то для этого используют продукты сжигания каменного угля и растворяют их в воде.
Процесс производства проходит в несколько этапов: первый этап – дистилляция, второй этап – дефлегмация и завершающий этап – конденсация аммиачной воды.
Характеристика
Формула аммиачной воды – NH4OH. Пищевую добавку Е527 активно используют в производстве пищевого направления в виде эмульгатора. Производители часто используют иные названия добавки – гидроксид аммония или ammonium hydroxide. Раствор полностью бесцветен, но с резким, характерным ацетону, запахом. Добавка великолепно растворяется в воде.
Для производства обычно используется синтетического происхождения сырье, в частности аммиачная вода, которая, получается, посредством соединения коксового газа и воды. Основная цель применения данной добавки в пищевой промышленности – это регулирование кислотности. Е527 опасна для организма человека, следовательно, разрешена не во всех мировых странах.
На сегодняшний день ее применение разрешено в странах ЕС, России и Украине.
Е527 обладает щелочными свойствами, следовательно, его чистая, неразбавленная форма способна вызывать серьезные химические ожоги. Добавка аллергенная и сильно раздражает не только слизистые, но и кожные покровы.
Именно по этой причине в косметике Е527 можно встретить максимум в 6% концентрации. Чаще всего из косметических средств аммиачную воду можно встретить в красках для волос, но ее концентрация не должна превышать 3%.
Желательно чтобы в составе красок для волос вообще не было данной синтетической добавки.
Применение гидроксида аммония
В пищевой промышленности аммиачную воду добавляют в некоторые разновидности шоколада, в разные какао-продукты, в карамельные конфеты. В период производства данной продукции добавка играет роль буфера. Стоит отметить, что в какао-бобах содержится 2% кислот, которые в контакте с Е527 полностью нейтрализуются.
Кроме промышленности пищевого направления, аммониевая вода используется в домашнем обиходе и в медицине. 10% раствор многим известен как нашатырный спирт. При его резком вдыхании наблюдается стимулирование работы дыхательного центра.
Нашатырный спирт активно используют в период выведения после наркоза, при потере сознания, в период, когда срочно нужно вызвать рвотный рефлекс. Также стоит отметить, что раствор Е527 используют и наружно, так как он обладает великолепными охлаждающими и антисептическими свойствами.
Им часто обрабатывают укусы насекомых, мелкие царапины и руки для обеззараживания.
 Нередко встречается информация о том, что данная пищевая добавка используется в целях дезинфекции разнообразных видов мяса (его вымачивают в растворе Ammonium Hydroxide). В результате происходит полное обеззараживание продукта (это положительный момент), а также наблюдается насыщение продукта аммиачным водным раствором, который может негативно отразиться на функциональности всего организма.
Нередко встречается информация о том, что данная пищевая добавка используется в целях дезинфекции разнообразных видов мяса (его вымачивают в растворе Ammonium Hydroxide). В результате происходит полное обеззараживание продукта (это положительный момент), а также наблюдается насыщение продукта аммиачным водным раствором, который может негативно отразиться на функциональности всего организма.
Также стоит отметить, что гидроксид аммония присутствует в составе некоторых удобрений, красок для волос, моющих средств и даже соды.
Гидроксид аммония встречается в красках для волос, а также используется для химического выпрямления или завивки волос.
Основная задача Е527 для ухода за волосами – это вызвать набухание и раскрытие каждого волоска, и запустить реакцию распада перекиси водорода.
Периодически аммиачную воду в 6% концентрации можно встретить в качестве корректора РН в препаратах по уходу за кожей и в средствах для укладки волос.
Так как добавка несет опасность для организма, стоит обращать внимание на количество ее в продукте. Максимальная норма Е527 – это 50 грамм аммиачной воды на 1 килограмм продукции.
Кроме всего перечисленного, гидроксид аммония встречается в: сельскохозяйственных продуктах (не пестицидных), строительных материалах, очистке и меблировке, электрических и электронных изделиях, взрывчатых материалах, тканевых, текстильных и кожаных изделиях, чернилах, тонерах и красителях, услугах прачечной, посудомоечной машины, продуктах для ухода за газонами и садами, бумажных изделиях, продуктах личной гигиены, продуктах для обработки воды.
Вред аммониевой воды
Гидроксид аммония должен добавляться в продукцию по определенным рекомендациям и техническим инструкциям, очень часто наблюдается комбинация с иными гидроксидными добавками. По установленным нормативам в какао и шоколаде норма Е527 не должна превышать 70 грамм на 1 килограмм. В иных случаях данная норма составляет 50 грамм добавки на 1 килограмм продукта.
В некоторых странах, таких как Австралия и Новая Зеландия, аммониевая вода запрещена для использования в виде пищевой добавки, так как есть сведения о негативном отражении добавки на организме человека. Чаще всего от гидроксида аммония страдает кишечник и печень.
Вред Е527 заключается в его нестабильности и легком разделении на воду и аммиак. Чистый аммиак – это активный раздражитель, который негативно влияет на состояние слизистых пищеварительного тракта.
Желательно при выборе продуктов внимательно изучать их состав, и, по возможности, избегать данную пищевую добавку, так как у каждого организм индивидуальный, а потому невозможно точно рассчитать безопасную норму Е527.
Когда вспоминают вредные свойства Ammonium Hydroxide, на первое место выходят: способность вызывания химических ожогов, невероятная токсичность, нестабильность (распад на воду и концентрированный аммиак в чистом виде), способность раздражать дыхательные пути, слизистые и кожу.
Эффекты от воздействия Е527 могут включать в себя чрезмерное раздражение глаз и слизистых оболочек, контактные ожоги кожи и глаз, опасный для жизни легочный отек.
При действии и ситуациях, когда возможно чрезмерное воздействие добавки, рекомендуется надевать защитный автономный дыхательный аппарат и защитную одежду (включая полную защиту лица).
Если контакт произошел, немедленно промойте пораженную кожу или глаза проточной водой в течение как минимум 15 минут, и удалите загрязненную одежду и обувь на месте. Е527 легко воспламеняется. Пожары, содержащие гидроксид аммония, можно гасить сухим химикатом, CO2, туманом или стандартной пеной.
Хранение
Гидроксид аммония следует хранить в прохладных, хорошо проветриваемых помещениях, в прочных стеклянных, пластиковых или резиновых бутылках вдали от тяжелых металлов, кислот и горючих материалов (например, дерева, бумаги, масла).
Для небольших разливов гидроксида аммония сначала выделите область разлива, затем возьмите с собой песок или другой негорючий абсорбент и поместите в контейнер для последующего удаления.
Перед тем, как внедрить удаление отходов отработанного гидроксида аммония, проконсультируйтесь с органами регулирования окружающей среды.
Источник: https://FoodandHealth.ru/dobavki/gidroksid-ammoniya-e527/
Структура гидроксида аммония, свойства, номенклатура, применение / химия
гидроксид аммония представляет собой соединение NH молекулярной формулы4ОН или Н5НЕ производится растворением газообразного аммиака (NH3в воде. По этой причине он получает названия аммиачной воды или жидкого аммиака.
Это бесцветная жидкость с очень интенсивным и острым запахом, которая не изолирует. Эти характеристики имеют прямую связь с концентрацией NH3 растворяется в воде; концентрация, которая на самом деле, будучи газом, может покрывать его огромное количество, растворенное в небольшом объеме воды.
Значительно небольшая часть этих водных растворов состоит из катионов NH.4+ и ОН-анионы-. С другой стороны, в очень разбавленных растворах или в замороженных твердых веществах при очень низких температурах аммиак можно найти в форме гидратов, таких как: NH3∙ H2О, 2НХ3∙ H2O и NH3H 2H2О.
Любопытно, что облака Юпитера образованы разбавленными растворами гидроксида аммония. Однако космическому зонду Galileo не удалось обнаружить воду в облаках планеты, что можно было бы ожидать из знания того, что известно образование гидроксида аммония; то есть они кристаллы NH4ОН абсолютно безводный.
Ион аммония (NH4+) вырабатывается в просвете почечных канальцев путем соединения аммиака и водорода, секретируемых клетками почечных канальцев. Аналогичным образом, аммоний вырабатывается в клетках почечных канальцев в процессе превращения глютамина в глутамат и, в свою очередь, при превращении глутамата в α-кетоглутарат..
Аммиак производится промышленным способом по методу Хабера-Боша, в котором газы азота и водорода вступают в реакцию; с использованием иона трехвалентного железа, оксида алюминия и оксида калия в качестве катализаторов. Реакцию проводят при высоких давлениях (150-300 атмосфер) и высоких температурах (400-500 ºC) с выходом 10-20%..
В реакции образуется аммиак, который при окислении производит нитриты и нитраты. Они необходимы при получении азотной кислоты и удобрений, таких как аммиачная селитра.
индекс
- 1 Химическая структура
- 2 Физические и химические свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Внешний вид
- 2.4 Концентрация
- 2.5 Запах
- 2.6 Вкус
- 2.7 Пороговое значение
- 2.8 Точка кипения
- 2.9 Растворимость
- 2.10 Растворимость в воде
- 2.11 Плотность
- 2.12 Плотность пара
- 2.13 Давление пара
- 2.14 Коррозионное действие
- 2,15 рН
- 2.16 Константа диссоциации
- 3 Номенклатура
- 4 Растворимость
- 5 рисков
- 5.1 Реакционная способность
- 6 использует
- 6.1 В еду
- 6.2 Терапия
- 6.3 Промышленное и разное
- 6.4 В сельском хозяйстве
- 7 ссылок
Химическая структура
Как указано в его определении, гидроксид аммония состоит из водного раствора газообразного аммиака. Следовательно, внутри жидкости нет определенной структуры, кроме структуры случайного расположения ионов NH.4+ и ОН- сольватированные молекулами воды.
- Ионы аммония и гидроксила являются продуктами равновесного гидролиза аммиака, поэтому для этих растворов характерен резкий запах:
- Нью-Гемпшир3(г) + Н2O (l) Нью-Гемпшир4+(ac) + OH-(Aq)
- Согласно химическому уравнению, высокое снижение концентрации воды приведет к смещению равновесия с образованием большего количества аммиака; то есть при нагревании гидроксида аммония пары аммиака будут выделяться.
- По этой причине ионы NH4+ и ОН- им не удается сформировать кристалл в земных условиях, что приводит к тому, что твердое основание NH4ОН не существует.
- Это твердое вещество должно состоять только из ионов, взаимодействующих электростатически (как показано на рисунке).
Аммиачный лед
Однако при температурах значительно ниже 0ºC и в окружении огромных давлений, таких как те, что преобладают в ядрах ледяных лун, аммиак и вода замерзают. При этом они кристаллизуются в твердой смеси с различными стехиометрическими пропорциями, являясь самым простым NH3∙ H2O: моногидрат аммиака.
- NH3∙ H2O и NH3H 2H2Или это аммиачный лед, потому что твердое тело состоит из кристаллического расположения молекул воды и аммиака, соединенных водородными связями.
- Учитывая изменение T и P, согласно вычислительным исследованиям, которые моделируют все физические переменные и их влияние на этот лед, происходит переход фазы NH3∙ нН2Или в фазу NH4Огайо.
- Поэтому только в этих экстремальных условиях NH4ОН может существовать как продукт протонирования во льду между NH3 и Н2O:
- Нью-Гемпшир3(s) + H2O (s) Нью-Гемпшир4ОН
Обратите внимание, что на этот раз, в отличие от гидролиза аммиака, участвующие виды находятся в твердой фазе. Аммиачный лед, который становится соленым без выделения аммиака.
Физико-химические свойства
Молекулярная формула
Нью-Гемпшир4ОН или Н5НЕТ
Молекулярный вес
35 046 г / моль
внешний вид
Это бесцветная жидкость.
концентрация
Примерно до 30% (для ионов NH4+ и ОН-).
запах
Очень сильный и острый.
аромат
акр.
Пороговое значение
34 промилле для неспецифического обнаружения.
Точка кипения
38 ºC (25%).
растворимость
Существует только в водном растворе.
Растворимость в воде
Смешивается в неограниченных пропорциях.
плотность
0,90 г / см3 при 25 ºC.
Плотность пара
Относительно воздуха, взятого за единицу измерения: 0,6. То есть он менее плотный, чем воздух. Однако, по логике, указанное значение относится к аммиаку как газу, а не к его водным растворам или NH4Огайо.
Давление пара
2,160 мм рт.ст. при 25 ºC.
Коррозионное действие
Способен растворять цинк и медь.
pH
11,6 (раствор 1 N); 11,1 (раствор 0,1 N) и 10,6 (0,01 н. раствор).
Константа диссоциации
- pKb = 4767; Кб = 1,71 х 10-5 при 20 ºC
- pKb = 4,751; Кб = 1774 х 10-5 при 25 º C.
- Повышение температуры почти незаметно увеличивает основность гидроксида аммония.
номенклатура
Каковы все общие и официальные имена, которые получает NH?4ОН? Согласно тому, что установлено IUPAC, его название — гидроксид аммония, потому что он содержит гидроксильный анион..
- Аммоний по нагрузке +1 является одновалентным, поэтому при использовании номенклатурного запаса он называется: гидроксид аммония (I).
- Хотя использование термина гидроксид аммония технически некорректно, поскольку соединение не может быть выделено (по крайней мере, не на Земле, как подробно объясняется в первом разделе).
- Кроме того, гидроксид аммония получает названия аммиачной воды и жидкого аммиака.
растворимость
NH4ОН, поскольку в земных условиях соли нет, невозможно оценить, насколько она растворима в разных растворителях..
Однако можно было бы ожидать, что он будет чрезвычайно растворим в воде, так как при его растворении выделяется огромное количество NH.3. Теоретически, это был бы удивительный способ хранения и транспортировки аммиака..
Можно ожидать, что в других растворителях, способных принимать водородные связи, таких как спирты и амины, он также будет очень растворим в них. Здесь катион NH4+ является донором водородных мостиков, а ОН- это работает как.
Примерами этих взаимодействий с метанолом могут быть: H3N+-H — OHCH3 и HO- — HOCH3 (OHCH3 указывает на то, что кислород получает водородную связь, а не на то, что метильная группа связана с Н).
риски
-При попадании в глаза вызывает раздражение, которое может привести к повреждению глаз.
-Это вызывает коррозию. Поэтому при попадании на кожу может вызывать раздражение, а при высоких концентрациях реагента вызывает ожоги кожи. Повторный контакт гидроксида аммония с кожей может вызвать ее сухость, зуд и покраснение (дерматит).
-Вдыхание аэрозоля с гидроксидом аммония может вызвать острое раздражение дыхательных путей, которое характеризуется удушьем, кашлем или одышкой. Длительное или повторное воздействие вещества может привести к рецидивирующим бронхиальным инфекциям. Кроме того, вдыхание гидроксида аммония может вызвать раздражение легких.
-Воздействие высоких концентраций гидроксида аммония может быть неотложной медицинской помощью, так как может произойти накопление жидкости в легких (отек легких).
-Концентрация 25 частей на миллион была принята за предел воздействия в течение 8-часовой рабочей смены в среде, где работник подвергается вредному действию гидроксида аммония..
реактивность
-Кроме того, из потенциального вреда для здоровья от воздействия гидроксида аммония, есть другие меры предосторожности, которые необходимо учитывать при работе с веществом.
-Гидроксид аммония может вступать в реакцию со многими металлами, такими как: серебро, медь, свинец и цинк. Он также реагирует с солями этих металлов с образованием взрывоопасных соединений и выделяет газообразный водород; который, в свою очередь, является легковоспламеняющимся и взрывоопасным.
-Он может бурно реагировать с сильными кислотами, например: соляной кислотой, серной кислотой и азотной кислотой. Кроме того, он реагирует таким же образом с диметилсульфатом и галогенами.
-Реагирует с сильными основаниями, такими как гидроксид натрия и гидроксид калия, с образованием газообразного аммиака. Это можно проверить, если наблюдается равновесие в растворе, при котором добавление ионов ОН- сдвигает баланс к образованию NH3.
-Медные и алюминиевые металлы, а также другие оцинкованные металлы не должны использоваться при работе с гидроксидом аммония из-за его коррозионного воздействия на них..
приложений
В еду
-Он используется в качестве добавки во многих пищевых продуктах, в которых он действует как разрыхлитель, регулятор pH и отделочный агент поверхности пищи..
-Список продуктов, в которых используется гидроксид аммония, обширен и включает выпечку, сыры, шоколад, конфеты и пудинги.
-Гидроокись аммония классифицируется FDA как безопасное вещество для обработки пищевых продуктов при условии соблюдения установленных стандартов..
-В мясных продуктах он используется в качестве антимикробного агента, способного уничтожать бактерии, такие как кишечная палочка, и снижать его до неопределяемого уровня. Бактерия обнаружена в кишечнике крупного рогатого скота, адаптируясь к кислой среде. Гидроксид аммония, регулируя рН, препятствует росту бактерий.
терапевтический
-Гидроксид аммония имеет несколько терапевтических применений, в том числе:
-10% раствор используется как стимулятор дыхательного рефлекса
-Внешне он используется на коже для лечения укусов и укусов насекомых. Он действует на пищеварительную систему как антацидное и ветрогонное средство, то есть помогает устранять газы..
Кроме того, он используется в качестве местного средства для лечения острых и хронических мышечно-скелетных болей. Как следствие рубцового действия гидроксида аммония наблюдается местное усиление кровотока, покраснение и раздражение.
Промышленное и разное
- -Он действует в сокращении NOx (высокореактивных газов, таких как оксид азота (NO) и диоксид азота (NO)2)) для дымовых выбросов и сокращения выбросов NOx в дымовых трубах.
- -Используется в качестве пластифицирующего агента; Добавка красок и для обработки поверхностей.
- -Это увеличивает пористость волос, позволяя пигментам пятен иметь большее проникновение, что обеспечивает лучший результат.
-Гидроксид аммония используется в качестве антимикробного агента при очистке сточных вод. Кроме того, он вмешивается в синтез хлорамина.
Это вещество выполняет функцию, аналогичную хлору, при очистке воды в плавательном бассейне, имея преимущество в том, что она менее токсична..
-Используется в качестве ингибитора коррозии в процессе переработки нефти..
-Он используется в качестве чистящего средства в различных промышленных и коммерческих продуктах, используемых на нескольких поверхностях, в том числе: нержавеющая сталь, фарфор, стекло и духовка..
-Кроме того, он используется в производстве моющих средств, мыла, фармацевтических препаратов и чернил.
В сельском хозяйстве
Гидроксид аммония, хотя и не применяется непосредственно в качестве удобрения, выполняет эту функцию. Аммиак производится из атмосферного азота по методу Хабера-Боша и транспортируется в холодильнике ниже точки кипения (-33 ° С) к местам его использования.
Аммиак под давлением впрыскивается в виде пара в почву, где он немедленно вступает в реакцию с эдафической водой и переходит в форму аммония (NH4+), который сохраняется в местах катионного обмена почвы. Кроме того, производится гидроксид аммония. Эти соединения являются источником азота.
Вместе с фосфором и калием азот составляет триаду основных питательных веществ растений, необходимых для его роста..
ссылки
- Ganong, W.F. (2002). Медицинская физиология. 19-е издание. Редакция Современное руководство.
- A. D. Fortes, J. P. Brodholt, I. G. Wood и L. Vocadlo. (2001). Первоначальное моделирование моногидрата аммиака (NH3∙ H2О) и гидроксид аммония (NH4ОН). Американский институт физики. J. Chem. Phys., Vol. 115, No. 15, 15.
- Хельменстин, Анна Мари, доктор философии (6 февраля 2017 г.) Факты о гидроксиде аммония. Получено с: мысли
- Группа Почтека. (2015). Гидроксид аммония. pochteca.com.mx
- Нью-Джерси Здоровье (Н.Д.). Информационный бюллетень по опасным веществам: гидроксид аммония. [PDF]. Получено от: nj.gov
- Учитель химии. (2018). Гидроксид аммония. Получено от: chemlearner.com
- PubChem. (2018). Гидроксид аммония. Получено из: pubchem.ncbi.nlm.nih.gov
Источник: https://ru.thpanorama.com/articles/qumica/hidrxido-de-amonio-estructura-propiedades-nomenclatura-usos.html
Аммиак и гидроксид аммония 2020

Аммиак против гидроксида аммония
Аммиак и гидроксид аммония широко используются в удобрениях, потребностях в питании для наземных организмов, фармацевтических препаратов и даже в коммерческих продуктах для чистки. Иногда эти химические элементы могут иметь тенденцию становиться опасными, но у них есть массовые продажи по всему миру.
Каким-то образом эти химические соединения по-прежнему выгодны с точки зрения использования для наших повседневных нужд. Однако эти два химических соединения имеют так много различий, которые необходимо решать. Элементы, участвующие в каждом соединении, различны. Даже использование каждого химического вещества различно. Их формулировки также различны.
Вам лучше знать разницу между этими двумя, определяя и дифференцируя их.
Сначала это аммиак. Это бесцветный газ, который пахнет острым. Это комбинация элементов азота и водорода, а их формула — NH3. Он помогает наземным организмам, поставляя им их потребности в еде и удобрениях.
Когда речь идет о фармацевтических препаратах, аммиак также является важным фактором в качестве строительного блока. Даже при том, что он может иметь тенденцию быть опасным при использовании в больших количествах. Около 146,5 млн.
Тонн было использовано во всем мире в коммерческих чистящих продуктах в течение 2006 года. Безводный аммиак — это термин, используемый для использования в коммерческих целях аммиака. Этот термин указывает, что этот тип аммиака не содержит воды в формуле. Это одно из отличий аммиака и гидроксида аммония.
Гидроксид аммония — это домашний аммиак в воде. Одно из основных отличий заключается в том, что аммиак не содержит воды, в то время как гидроксид аммония имеет воду.
Гидроксид аммония имеет воду, поэтому другие условия для этого — аммиак с водой, аммиачный раствор и т. Д. Это означает, что гидроксид аммония представляет собой раствор аммиака с содержанием воды. Он содержит лишь небольшое количество аммиака, а его формула — NH3 (водн.).
Гидроксид аммония используется для различных видов чистящих средств. Например, он используется в качестве ингредиента для очистителей окон. Его можно использовать в качестве ингредиента для чистящих средств, или его можно использовать как средство для чистки.
Если он используется как средство для чистки, он называется «аммиак». Идет желтый цвет с ароматом лимона, или он может быть зеленого цвета с ароматом сосны. Гидроксид аммония также широко используется в мясной промышленности.
Существуют компании, которые улучшают свой говяжий процесс с определенным рН, который превращается в гидроксид аммония, когда продукт готов.
Это некоторые из различий в отношении аммиака и гидроксида аммония. Это также определение и формула для каждого. С их помощью вы можете получить более глубокое знание двух составных элементов.
РЕЗЮМЕ
1.
Их формула отличается, аммиак представляет собой NH3, тогда как гидроксид аммония составляет NH3 (водн.). 2.
Гидроксид аммония имеет воду, а аммиак — нет. 3.
Аммиак используется для наземных организмов; в то время как гидроксид аммония широко используется в качестве моющего средства (аммиак также используется для чистящих средств). 4.
Гидроксид аммония представляет собой в основном аммиак с водой.
Источник: https://ru.esdifferent.com/difference-between-ammonia-and-ammonium-hydroxide
Гидроксид аммония
Случайный факт:
Работоспособность людей, выполняющих какие-нибудь физические упражнения в течение дня, повышается на 15%.
— Обновить
| Название: | Гидроксид аммония |
| Тип: | Пищевая добавка |
| Категория: | Эмульгаторы |
| Описание группы: | Эмульгаторы — добавки с индексом (E-500 — E-599) создают однородную смесь из несмешиваемых в природе веществ, таких как вода и масло, вода и жир. |
- Разрешающие применение — 4
- Упоминаний о добавке— 6
- Россия — разрешена
- Украина — разрешена
- Беларусь — разрешена
- Евросоюз — разрешена
- США — разрешена
- Канада — разрешена
Гидроксид аммония (пищевая добавка E-527) – пищевая добавка группы эмульгаторов. Применяется в основном как регулятор кислотности. Разрешена для применения.
Для применения внутрь считается опасным, вызывает расстройство желудка и отрицательно влияет на печень.
Применение
Разбавленные растворы гидроксида аммония используются в медицине и домашнем хозяйстве (нашатырный спирт — 10%-й раствор). Его часто используют при обмороках для стимуляции дыхательных процессов, для вызова рвоты. Так же широко применяют наружно, например, при обработке укусов насекомых – в виде примочек, при невралгии и миозитах – для растирания, для обработки рук.
Другие использования гидроксида аммония:
- при производстве азотных удобрений (из солей аммония);
- в производстве соды, красителей.
Гидроксид аммония представляет собой слабое основание, соединение с резким запахом, образованное раствором аммиака с водой (аммиачная вода). В промышленности 25%-й раствор аммиака производится путем насыщения воды синтетическим газообразным аммиаком или аммиаком, получаемым при коксовании каменных углей в коксовых печах.
Химическая формула: NH4OH.
| Регулятор кислотности: | Вещества, устанавливающие и поддерживающие в пищевом продукте определенное значение pH. Добавление кислот снижает pH продукта, добавка щелочей увеличивает его, а добавка буферных веществ поддерживает pH на определенном уровне. |
Возможные названия пищевой добавки:
- Ammonium Hydroxide
- Гидроксид аммония
- E-527, Е-527, Е527, E527
/modules.php?name=ingridients&action=set_comment&ingr_id=308
Источник: https://prodobavki.com/dobavki/E527.html




