

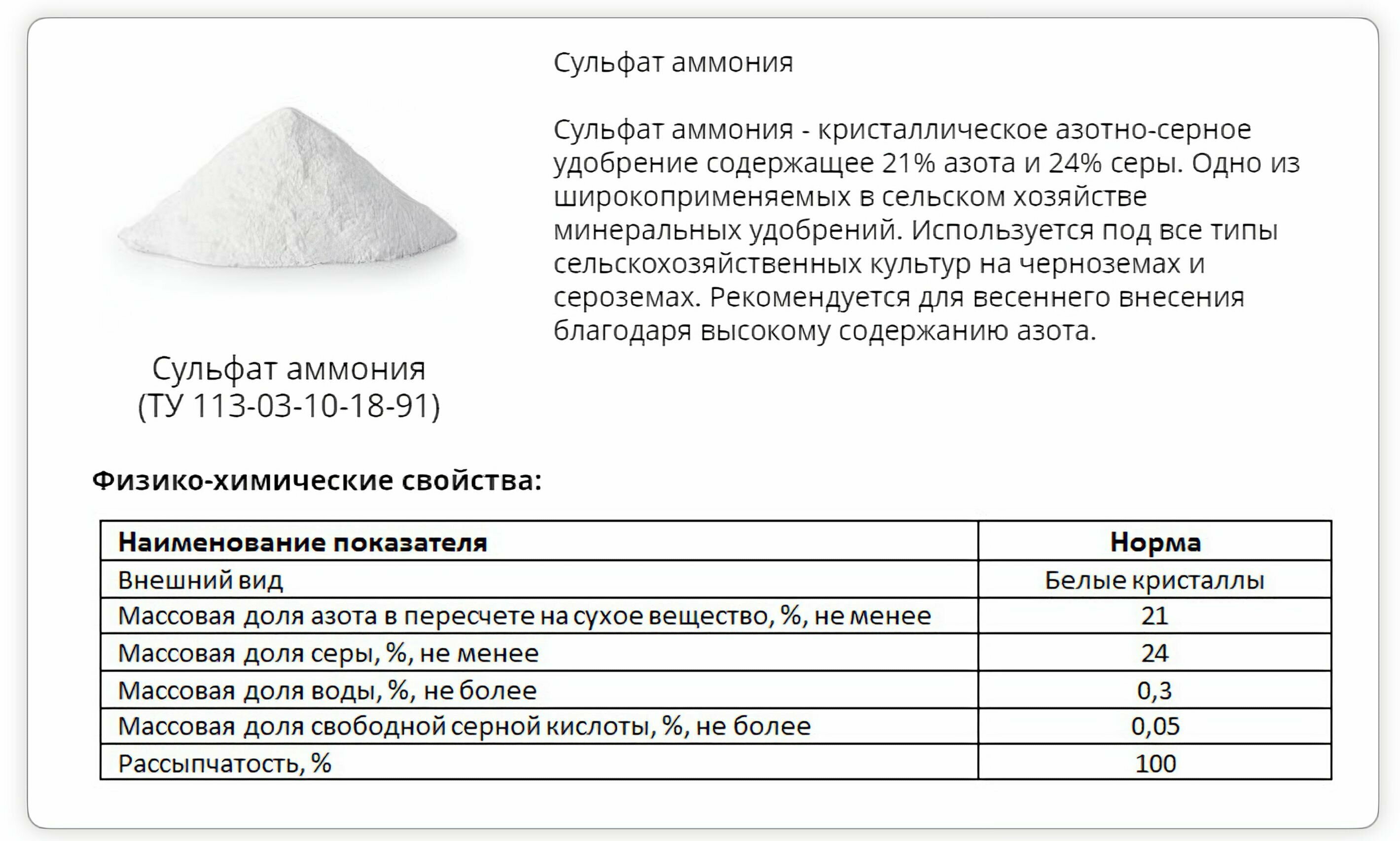
Основные понятия о соединении
О том, что представляет собой рассматриваемая химическая связь, можно понять уже по одной только структурной формуле хлорида аммония — NH4CL, притом что это вещество реально получить не только посредством искусственного синтезирования, но и в природной среде, в которой он представляется в виде минерального нашатыря. При нормальном температурном режиме являет собой белые кристаллы без запаха и присутствия соли.
Физические свойства NH4CL
Объем одной кубической сингонии хлористого аммония, под которой подразумевается элементарная ячейка кристалла, определяется по актуальной для простейшего геометрического куба формуле, где a возводится в третью степень.
Чтобы вычислить эту величину рассматриваемого соединения, достаточно просто знать, чему равно a, которое является константой, соответствуя 0,38758 нанометра при z=1.
Что касается остальных физических свойств и параметров, то среди ключевых из них стоит выделить:

- Показатель относительной плотности взаимодействия азота, водорода и хлора, дающего хлорид аммония, равен 1,526 кг на метр кубический.
- Молярная масса хлорида аммония соответствует 53,5 грамма на моль.
- Сохранение структуры кубической кристаллизации наблюдается при любых температурах до отметки в плюс 184,3 градуса Цельсия. При дальнейшем нагревании имеет свойство быстро улетучиваться. К примеру, уже после достижения столбика термометра 337, 6 градуса вещество моментально возгоняется, переходя из твердого состояния в летучий газ даже без промежуточного преобразования в жидкий раствор. При этом связь не остается в исходном виде, так как высокие температуры приводят к разложению хлорида аммония на такие вещества, имеющие высокий класс опасности, как чистый аммиак и соляная кислота.
- При замерзании образует ионную кристаллическую решетку. Что касается температурного режима, при котором происходят подобные изменения, то обычно все зависит от концентрации раствора и, к примеру, 10-процентная жидкость кристаллизуется уже при минус 6,95 градусах Цельсия.
Среди прочих особенностей NH4CL стоит выделить его высокую степень растворимости как в холодной, так и в горячей воде.
К примеру, при нулевой температуре жидкости в ее 100 граммах растворяется 29,4 грамма вещества, тогда как в кипятке расходится уже 77,3 грамма.
Стоит отметить, что, помимо обычной воды, соединение легко растворяется в жидком аммиаке, а также в безводных растворителях, но только при условии использования связи в порошкообразном виде, а не в концентрированном водном растворе.
В этом случае в 100 граммах этанола удастся растворить до 0,6 грамма кристаллов, а в метаноле до 3,3 грамма. Если же использовать водные растворы, то в процессе гидролиза, подразумевающего собой сольволиз водой, в них будет неизменно наблюдаться слабокислая реакция.
Что касается температуры кипения таких растворов, то она превышает стандартные 100 градусов, достигая на столбике термометра отметки в 116 градусов Цельсия.
Химические особенности связи
Вещество имеет множество химических особенностей, среди которых — вступление в реакцию со щелочными соединениями. К примеру, с тем же нитритом натрия хлористый аммоний начинает реагировать при достижении 100-градусной температуры, образуя не только воду и азот, но и новое соединение хлорида и натрия. Среди прочих свойств связи стоит необходимо обозначить:
- Если пропустить через соединение разряд электрического тока, то произойдет его разложение с дальнейшим преобразованием в хлористый азот (NCL3).
- Гидролиз хлорида аммония происходит только по катиону при устойчивом поддержании кислой среды. В этом случае актуальным будет следующее уравнение: NH4Cl + H2O ↔ NH4OH +HCl.
- Для получения чистого аммиака специалисты прибегают к нагреванию соединения вместе со щелочами. В качестве наглядного примера можно привести такое щелочное соединение, как гидроксид натрия, которое в случае взаимодействия с NH4CL распадается на воду, хлорид натрия и аммиак.

Помимо прочего, связь имеет свойство вступать в реакцию с азотнокислым серебром (NH4CL+AgNO3 → AgCl ↓ +NH4NO3) и нитритом натрия (NH4CL+NaNO2 → NaCl+N2 ↑ +2H20).
В первом случае в качестве реакции можно наблюдать выпадение хлористого серебра в виде характерного белого осадка, который моментально темнеет при воздействии естественных источников света, тогда как для второго актуальным остается разложение на натрия хлорид, воду и азот.
Получение и практическое применение
Удивительно, но хлористый аммиак научились добывать еще древние греки и египтяне, соскребавшие ценное вещество со стен застывших вулканических пород. Естественно, сегодня технологии таковы, что использовать подобные природные образования для того, чтобы получать нашатырь, не приходится.
Синтезирование вещества

В настоящее время хлорид аммония добывают в промышленных масштабах для разных нужд, используя для этого такой универсальный метод, как нагревание и упаривание маточного раствора, для получения которого приходится добиваться других химических реакций. Речь идет о выработке сырьевых остатков, образующихся в процессе разложения соединения гидрокарбоната натрия, а попросту пищевой соды, для чего необходимо пропустить диоксид углерода (углекислый газ) через раствор натрия хлорида и аммиака.
Если же на повестке дня стоит вопрос синтезирования соединения в лабораторных условиях, то тогда можно ограничиться более простыми решениями, которые чаще всего сводятся к соединению хлорводорода с аммиаком, предварительно пропускаемых через раствор натрия хлорида. Кроме того, вполне реально вывести связь посредством прямого контакта таких элементов, как аммиак и хлор.
Стоит отметить, что в современной химической промышленности активно используются всевозможные производные соединения, будь то диметиламмоний, метиламмоний, этиламмоний и прочие вариации.
Объясняется такой спрос довольно просто, ведь они получили широкое применение в фармакологии, легкой и пищевой промышленности, виноделии и других производственных сегментах, продолжая находить для себя новые сферы использования.
Использование хлорида аммония
В Древнем Египте хлористый аммоний использовался в качестве ароматных курений для божества по имени Аммоний, откуда, собственно, и пошло наименование самого вещества.
Чуть позже его применение освоили и на Востоке, так как название «нашатырь» имеет арабское происхождение. Научно-технический прогресс расширил сферы применения соединения, продолжая открывать для него новые горизонты.
Так, в настоящее время NH4CL активно используется в следующих сферах с соблюдением всех соответствующих ГОСТов:

- В качестве универсального азотного удобрения с процентным содержанием основного элемента, составляющего четверть от общей доли. Минеральная добавка идеально подходит для щелочных почвенных пород, слабо реагирующих на перенасыщение хлором, при посадке таких популярных культур, как рис, сахарная свекла, кукуруза и пр.
- В пищевой промышленности используется в качестве стабилизатора E510 и как усилитель вкуса, входящий в состав лакричных сладостей в Финляндии и некоторых странах Скандинавии.
- В металлургической промышленности применяется в качестве флюса, используемого для пайки и очищения поверхности от образующейся оксидной пленки с железа, меди и других металлов и сплавов. Кроме того, вещество может быть задействовано для обеспечения электролитного компонента в отдельных гальванических элементах, эксплуатируемых как химический источник электрического тока.
Соединение имеет довольно широкую область применения и во многих других сферах. К примеру, сегодня его активно используют для изготовления красителей в легкой промышленности, печати на ситце и других тканях, в лужении, для проведения лабораторных исследований, для дымообразования, проявления фотографических пленок, так как связь прекрасно фиксирует изображение, и пр.
Роль в медицине

Нельзя не отметить и фармакологические свойства вещества, которое обладает довольно мощным отхаркивающим и диуретическим эффектом. В виде медикаментозного препарата хлористый аммоний быстро абсорбируется стенками кишечника, проникая в общий кровяной ток, и метаболизируется в печени до состояния мочевины, после чего наступает период полураспада и вывод из организма. При этом может наблюдаться подкисление урины и учащенное мочеиспускание без изменений выделяемого объема в меньшую сторону. Во время каждого такого мочеиспускания происходит обильное выведение калийных ионов.
Действие препаратов неизменно сопровождается антисептическим эффектом и умеренным раздражением для некоторых органов и систем. Применение медикаментов на основе NH4CL способствует разжижению и выходу мокроты из верхних и нижних дыхательных путей.
Что касается выраженности диуретического эффекта, то не последнюю роль в этом вопросе играет состояние почек пациента и характер текущего заболевания.
Если же говорить о назначении лекарственного средства, то оно становится актуальным в следующих случаях:
- Постменструальный синдром.
- Болезнь Меньера.
- Интоксикация медикаментозными препаратами в условиях комплексной терапии (в частности, речь идет о передозировке лекарствами фенциклидиновой группы).
- Алкалоз метаболического и гипохлоремического типов.
- Отечность, спровоцированная патологиями сердечно-сосудистой системы.
- Комплексное лечение мочегонными препаратами.
- Комплексная терапия воспалительных заболеваний легких и других органов дыхательной системы.

Препараты на основе хлористого аммония запрещены к приему в случаях ярко выраженных отклонений в работе печени и почек, при обильном выделении соляной кислоты в урине на фоне устойчивого развития дефицита натрия, а также во время беременности и лактации.
Кроме того, возможны патологические проявления, которые могут выражаться в виде расстройств диспептического характера, повышенного потоотделения, общей слабости, изменения цвета кожных покровов на более бледные, мышечного тремора, брадикардии, чреватой переходом в коматозное состояние, и общей интоксикации организма.
Источник: https://nauka.club/khimiya/khlorid-ammoniya.html
Химические свойства хлористого аммония — формула, получение и применение
Содержание
Рассказать ВКонтакте Поделиться в Одноклассниках Поделиться в Facebook
Аммония хлорид начали использовать еще с древности. В античной Греции вещество применялось для храмовых обрядов и лечения людей. Непонятное название химического соединения скрывает знакомый всем препарат, ведь что такое нашатырь, знает каждый: без него не обходится ни одна домашняя аптечка.
Что такое хлорид аммония
Первенство в получении вещества принадлежит древним египтянам и грекам. Название происходит от египетского слова «Аммоний».
Так называли божество, в храме которого вдыхали испарения «нушадира» – раствора, сделанного из порошка с пещерных стен. С годами слово стало звучать как «нашатырь». Ammonium chloride, или хлорид аммония – это соль аммония.
Выглядит как сухой кристаллический порошок без запаха, слегка солоноватый, белого цвета.
Хлорид аммония – формула
Структурная формула хлорида аммония – NH4Cl, по строению вещество представляет собой химическое соединение аммония с хлором.
Лабораторный метод получения реагента выглядит как процесс упаривания маточного раствора хлорной извести. Второй способ – реакция взаимодействия между хлором и аммиаком.
Народные умельцы придумали, как получить вещество из солевых батареек путем очищения и выпаривания.
Хлористый аммоний – свойства
Вскоре после открытия порошка ученые выделили свойства хлорида аммония:
- гигроскопичность, или способность собирать воду;
- растворение в воде, жидком аммиаке, метиловом и этиловом спирте с небольшим осадком;
- способность реагировать на щелочи;
- летучесть при возгорании: образуется белый плотный дым и пары аммиака;
- полное разложение под действием электрического разряда и температуре больше 338 градусов Цельсия.
Для получения нашатырного спирта сухой реактив смешивается с водой. В отличие от исходного соединения у него другая формула и свойства. Водный раствор обладает резким запахом.
Чрезмерное вдыхание приводит к передозировке и летальному исходу. Врачи советуют хранить нашатырь отдельно от других лекарств. Пользоваться веществом нужно с особой осторожностью, ограничивая вдыхание несколькими секундами.
Признаки передозировки хлористым аммонием и его производными:
- тошнота;
- учащенное дыхание;
- потеря аппетита;
- рвота.
Аммоний хлористый – применение
Полезные свойства аммиака способствовали тому, что он нашел широкое распространение во многих отраслях. Применение хлорида аммония нередко в таких сферах, как:
- металлургия – травление металлов;
- деревообработка – защита древесины от вредителей;
- медицина – производство лекарств;
- пищепром – приправа;
- химическая промышленность – реагент для опытов;
- радиотехника – удаление оксидной пленки в процессе пайке;
- машиностроение – устранение загрязнений с поверхности;
- пиротехника – дымообразователь;
- гальваника – электролиты;
- сельскохозяйственные работы – азотное удобрение;
- фотодело – фиксаж для снимков.

В медицине и фармакологии аммиак и его растворы используются чаще. Раствор хлорида аммония применяется в фармацевтике:
- При обмороке нашатырь оказывает возбуждающее действие на человека, приводит в сознание.
- При отеках ценится действие диуретиков или мочегонных веществ, выводящих лишнюю жидкость.
- При пневмонии, хроническом бронхите и бронхиальной астме помогает от сильного кашля.
На втором месте находится пищевая промышленность.
Добавка с маркировкой Е510 указана в перечне многих продуктов, использующихся в изготовлении: хлебобулочных, макаронных, кондитерских изделий, фруктовых вин.
В Финляндии и других европейских странах принято добавлять вещество для усиления вкуса. Популярные лакричные конфеты Salmiakki и Tyrkisk Peber тоже сделаны с применением хлористого аммония.
В последнее время ученые провели ряд опытов, которые подтвердили, что пищевая добавка Е510 после термообработки теряет свои полезные свойства и становится вредна для здоровья. Многие производители продуктов питания предпочли полностью отказаться от ее использования, заменив на более безвредные аналогичные компоненты. Однако в других сферах соль аммония остается незаменимой.
Хлористый аммоний в виноделии
Для изготовления вина на заводах и дома используют порошкообразный препарат. Хлористый аммоний в виноделии служит подкормкой для дрожжевой среды. Добавлять его нужно не чаще одного раза за месяц.
Для этого препарат покупают в аптеке, сначала растворяют в жидкости, а затем вносят по 0,3 г на каждый литр сусла.
Мастера-виноделы советуют использовать пипетку или шприц, чтобы случайно не переборщить с количеством раствора.

Хлористый аммоний в быту
Использовать хлористый аммоний в быту научились еще наши бабушки. Он хорошо справляется с сильными загрязнениями на одежде, посуде, бытовой технике, украшениях.
Овощи на грядках станут плодоносить лучше, если добавить к воде для полива несколько кристаллов соли аммония. Техническая форма вещества для этих целей продается в ветеринарной аптеке или магазине для садоводов.
Хранить его нужно в герметичной емкости подальше от детей, соединение имеет третий класс опасности.
Видео
 хлорид аммония с гидроксидом
хлорид аммония с гидроксидом
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Источник: https://sovets.net/12444-hlorid-ammoniya.html
Хлористый аммоний — применяется со времен древнего мира
- Хлористый аммоний (хлорид аммония, нашатырь) — неорганическое соединение,
 широко использующееся в самых разных областях. С химической точки зрения — соль аммония; формула NH4Cl.Хлорид аммония был известен уже в Древней Греции и Древнем Египте. Одно из его названий, «нашатырь» происходит от египетского «нушадир» — вещества, которое жрецы собирали на стенках пещер, чтобы вдыхать его пары перед церемонией и настраиваться на общение с божественными силами. «Аммоний» ведет историю названия от имени египетского бога Солнца Амона. В Древней Греции вещество добывали из сажи, которая образовывалась на стенках дымоходов в результате горения верблюжьего навоза, служившего грекам топливом (хлористый аммоний получается при разложении выделений животных и человека).Хлорид аммония встречается в природе в вулканических пещерах и около трещин в земной коре, в виде налета или корочек.
широко использующееся в самых разных областях. С химической точки зрения — соль аммония; формула NH4Cl.Хлорид аммония был известен уже в Древней Греции и Древнем Египте. Одно из его названий, «нашатырь» происходит от египетского «нушадир» — вещества, которое жрецы собирали на стенках пещер, чтобы вдыхать его пары перед церемонией и настраиваться на общение с божественными силами. «Аммоний» ведет историю названия от имени египетского бога Солнца Амона. В Древней Греции вещество добывали из сажи, которая образовывалась на стенках дымоходов в результате горения верблюжьего навоза, служившего грекам топливом (хлористый аммоний получается при разложении выделений животных и человека).Хлорид аммония встречается в природе в вулканических пещерах и около трещин в земной коре, в виде налета или корочек.
Свойства
NH4Cl — белый кристаллический порошок (реактив технической чистоты может быть желтоватым или розовым), слегка гигроскопичный, без запаха, солоноватый на вкус. Хорошо растворяется в воде и жидком аммиаке, с ростом температуры водорастворимость увеличивается. Вступает в реакцию со щелочами с образованием соли, воды и аммиака.
В гораздо меньшей степени реактив растворяется в этиловом и метиловом спиртах. Горит с выделением густого белого дыма. Полностью разлагается при температуре свыше 338 °С, а также под действием электрического тока. Горящий хлорид аммония выделяет аммиак, который раздражает органы дыхания.
Водный раствор реактива — это нашатырный спирт, жидкость с резким запахом, который возбуждающе действует на нервную систему.
Реактив используется как лекарство, но лечение нашатырным спиртом должно проводиться строго по рекомендации врача, так как передозировка может привести к остановке дыхания и коме (в качестве антидота вводят щелочные растворы, например, натрия гидрокарбонат). К тому же это лекарство имеет противопоказания.

Хлористый аммоний относится к веществам умеренно опасным (класс 3), работать с ним следует в средствах защиты: резиновых перчатках, защитных очках и респираторе, в помещении с приточно-вытяжной вентиляцией.
Нужно следить, чтобы реактив не попал на кожу и слизистые оболочки. Хранить хим. реактив нужно в герметично закрытых многослойных мешках, в крытых помещениях без доступа влаги.
Соединение опасно для окружающей среды.
Применение
— В цветной металлургии для травления металлов.— Как составная часть электролитов в гальванике.— Для удаления оксидной пленки при пайке и лужении стали, для производства сухих батарей в электротехнике.— В текстильной индустрии — для отверждения клеев и лаков.
— Для получения нашатырного спирта, которым приводят в чувство при потере сознания. Также хлорид аммония является компонентом сердечных противоотечных средств, средств против кашля. Его используют для усиления некоторых мочегонных лекарств.— В пищепроме это пищевая добавка E510, разрешенная в России и европейских странах.
Его применяют для улучшения свойств муки, как загуститель и эмульгатор, для изготовления плодовых и ягодных вин, лакричных конфет, как приправу к рыбе. В последнее время добавка Е 510 применяется все реже из-за подозрений в ее вреде.— При изготовлении сигнальных дымовых шашек, как дымообразователь.
— В сельском хозяйстве, при выращивании некоторых культур в качестве азотного удобрения на нейтральных и щелочных почвах.
 — Как составная часть быстрого фиксажа при проявке фотографий. — При изготовлении фитилей для свечей.— В быту в разведенном виде — для очистки различных поверхностей и украшений, при стирке.
— Как составная часть быстрого фиксажа при проявке фотографий. — При изготовлении фитилей для свечей.— В быту в разведенном виде — для очистки различных поверхностей и украшений, при стирке.
В магазине «ПраймКемикалсГрупп» вы можете купить аммоний хлористый BASF в порошке, а также ампулы с фиксаналом «Аммоний хлористый». На эти и другие реактивы у нас доступные цены, имеется доставка.
Источник: https://pcgroup.ru/blog/hloristyj-ammonij-primenyaetsya-so-vremen-drevnego-mira/
Хлорид аммония
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами с выделением аммиака:
NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3

Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
NH3 + H2O + CO2 + NaCl → NaHCO3 + NH4Cl
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
8NH3 + 3Cl2 → N2 + 6NH4Cl
Реакция взаимодействия аммиака и соляной кислоты:
NH3 + HCl → NH4Cl
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов
- как дымообразователь;
- в фотографии как компонент быстрого фиксажа, для получения тиосульфата аммония непосредственно в растворе.

Источник: https://chem.ru/hlorid-ammonija.html
Аммония хлорид: от чего помогает (раствор), показания, цены
Аммония хлорид – препарат (раствор), относится к группе диагностические радиофармацевтические средства. Важные особенности лекарственного средства из инструкции по применению:
- Продается только по рецепту врача
- При беременности: противопоказан
- При кормлении грудью: противопоказан
- В детском возрасте: противопоказан
Упаковка

Химическое название
Хлорид аммония
Химические свойства
Химическая формула Хлорида Аммония: NH4Cl. Соединение также называют хлористым аммонием, нашатырем, это аммонийная соль соляной кислоты.
Представляет собой белый мелкий кристаллический гигроскопический порошок, без специфического запаха, соленого привкуса. Порошок при нагревании улетучивается.
Средство хорошо растворяется в горячей и холодной воде, растворимо в этаноле. Молярная масса средства = 53,5 грамм на моль.
Вещество вступает в реакцию с щелочами. Реагирует с нитритом натрия при температуре выше 100 градусов с образованием азота, воды и хлорида натрия. Разложение Хлорида Аммония происходит при пропускании через него электрического тока, в результате образуется хлористый азот. Гидролиз химического соединения происходит по катиону, в кислой среде. Молекулярное уравнение: NH4Cl + H2O ↔ NH4OH +HCl.
Качественная реакция на Хлорид Аммония. При нагревании вещество с щелочью будет выделяться аммиак. Например, во время реакции с гидроксидом натрия выделится хлорид натрия, аммиак и вода.
В промышленных масштабах средство получают путем упаривания маточного раствора, который остается после отделения NaHCO3. В лаборатории вещество получают во время реакции аммиака с хлороводородом в присутствии хлорида натрия.
Применение вещества:
- средство используют в качестве азотного удобрения для щелочной и нейтральной почвы при выращивании свеклы, кукурузы, риса;
- в виде пищевой добавки E510;
- в качестве флюса во время пайки, чтобы удалить оксидную пленку с поверхности;
- для усиления действия диуретических средств при отеках;
- в качестве компонента электролиза в гальванических элементах;
- в лабораториях;
- в качество дымообразователя;
- при проявке фотографий.
Фармакологическое действие
Отхаркивающее, диуретическое.
Фармакодинамика и фармакокинетика
После приема внутрь Аммония Хлорид быстро и достаточно легко всасывается через стенки кишечника и проникает в систему воротной вены.
В тканях печени метаболизируется до мочевины, при этом образуются ионы водорода и Cl, которые создают кислую среду и нейтрализуются гидрокарбонатом натрия. Происходит подкисление мочи и форсируется диурез. Мочегонный эффект сопровождается интенсивным выведением ионов калия.
Во время метаболизма вещества в легочной ткани образуются активные метаболиты, обладающие противомикробным и умеренным раздражающим действием.
Средство стимулирует работу желез слизистой оболочки дыхательных путей и выведение жидкого бронхиального секрета, активизирует работу ресничного эпителия и увеличивает сократимость бронхов. Диуретический эффект напрямую зависит от работы почек и их способности нейтрализовать ионы аммония, она накопления в интерстициальной жидкости ионов хлора и водорода.
Лекарство эффективно при лечении ПМС, болезни Меньера, в рамках комплексной терапии интоксикации фенциклидином.
Показания к применению
Средство назначают:
- при метаболическом алкалозе;
- при гипохлоремическом алкалозе;
- в составе комплексного лечения диуретиками;
- от отеков сердечного происхождения;
- для облегчения отхождения мокроты при пневмонии, заболеваниях легких, бронхите и так далее.
Противопоказания
Аммония Хлорид противопоказан к приему:
- при выраженных нарушениях работы печени и почек;
- пациентам с метаболическим алкалозом, который сопровождается обильным выделением соляной кислоты и недостатком натрия;
- при беременности.
Побочные действия
Вещество способно раздражать слизистую оболочку желудка, вызывать рвоту и тошноту; при частом приеме могут развиться симптомы интоксикации аммиаком, сильное потоотделение, общая слабость и бледность, аритмия, подергивание мышцами, брадикардия, вплоть до комы.
Инструкция по применению (Способ и дозировка)
Аммония Хлорид назначают внутрь. В зависимости от показаний применяют различные дозировки и схемы терапии.
Передозировка
Лекарство может вызвать дезориентацию, тяжелый метаболический ацидоз, кому, головные боли и спутанность сознания. В качестве терапии вводят щелочные растворы, лактат или гидрокарбонат натрия.
Взаимодействие
- Вещество усиливает эффект от приема метформина и глибенкламида.
- Средство подкисляет мочу, вследствие чего повышается почечная секреция эфедрина, фенамина, фенфлурамина, хинидина.
- Лекарство усиливает противомикробный эффект от приема метенамина.
Особые указания
Вещество рекомендуется принимать после еды.
При беременности и лактации
Средство противопоказано к приему беременными женщинами.
Препараты, в которых содержится (Аналоги)
Торговое название средства: Хлорид Аммония.
Видео по теме
- Химия из батарейки — Хлорид аммония — Хлорид олова(II) реактив на ионы золота
- Получение хлорида аммония
- раствор хлорида аммония + амальгамы натрия = взаимодействие
- Облако из колбы, или «Хлорид аммония».
- Получение аммиака и сульфата аммония
Источник: https://SpravTab.ru/ammoniia-khlorid/
Аммония Хлорид
Хлорид аммония
Химические свойства
Химическая формула Хлорида Аммония: NH4Cl. Соединение также называют хлористым аммонием, нашатырем, это аммонийная соль соляной кислоты.
Представляет собой белый мелкий кристаллический гигроскопический порошок, без специфического запаха, соленого привкуса. Порошок при нагревании улетучивается.
Средство хорошо растворяется в горячей и холодной воде, растворимо в этаноле. Молярная масса средства = 53,5 грамм на моль.
Вещество вступает в реакцию с щелочами. Реагирует с нитритом натрия при температуре выше 100 градусов с образованием азота, воды и хлорида натрия.
Разложение Хлорида Аммония происходит при пропускании через него электрического тока, в результате образуется хлористый азот. Гидролиз химического соединения происходит по катиону, в кислой среде.
Молекулярное уравнение: NH4Cl + H2O ↔ NH4OH +HCl.
Качественная реакция на Хлорид Аммония. При нагревании вещество с щелочью будет выделяться аммиак. Например, во время реакции с гидроксидом натрия выделится хлорид натрия, аммиак и вода.
В промышленных масштабах средство получают путем упаривания маточного раствора, который остается после отделения NaHCO3. В лаборатории вещество получают во время реакции аммиака с хлороводородом в присутствии хлорида натрия.
Применение вещества:
- средство используют в качестве азотного удобрения для щелочной и нейтральной почвы при выращивании свеклы, кукурузы, риса;
- в виде пищевой добавки E510;
- в качестве флюса во время пайки, чтобы удалить оксидную пленку с поверхности;
- для усиления действия диуретических средств при отеках;
- в качестве компонента электролиза в гальванических элементах;
- в лабораториях;
- в качество дымообразователя;
- при проявке фотографий.
Фармакологическое действие
Отхаркивающее, диуретическое.
Фармакодинамика и фармакокинетика
После приема внутрь Аммония Хлорид быстро и достаточно легко всасывается через стенки кишечника и проникает в систему воротной вены.
В тканях печени метаболизируется до мочевины, при этом образуются ионы водорода и Cl, которые создают кислую среду и нейтрализуются гидрокарбонатом натрия. Происходит подкисление мочи и форсируется диурез.
Мочегонный эффект сопровождается интенсивным выведением ионов калия. Во время метаболизма вещества в легочной ткани образуются активные метаболиты, обладающие противомикробным и умеренным раздражающим действием.
Средство стимулирует работу желез слизистой оболочки дыхательных путей и выведение жидкого бронхиального секрета, активизирует работу ресничного эпителия и увеличивает сократимость бронхов. Диуретический эффект напрямую зависит от работы почек и их способности нейтрализовать ионы аммония, она накопления в интерстициальной жидкости ионов хлора и водорода.
Лекарство эффективно при лечении ПМС, болезни Меньера, в рамках комплексной терапии интоксикации фенциклидином.
Показания к применению
Средство назначают:
- при метаболическом алкалозе;
- при гипохлоремическом алкалозе;
- в составе комплексного лечения диуретиками;
- от отеков сердечного происхождения;
- для облегчения отхождения мокроты при пневмонии, заболеваниях легких, бронхите и так далее.
Противопоказания
Аммония Хлорид противопоказан к приему:
- при выраженных нарушениях работы печени и почек;
- пациентам с метаболическим алкалозом, который сопровождается обильным выделением соляной кислоты и недостатком натрия;
- при беременности.
Побочные действия
Вещество способно раздражать слизистую оболочку желудка, вызывать рвоту и тошноту; при частом приеме могут развиться симптомы интоксикации аммиаком, сильное потоотделение, общая слабость и бледность, аритмия, подергивание мышцами, брадикардия, вплоть до комы.
Инструкция по применению (Способ и дозировка)
Аммония Хлорид назначают внутрь. В зависимости от показаний применяют различные дозировки и схемы терапии.
Передозировка
Лекарство может вызвать дезориентацию, тяжелый метаболический ацидоз, кому, головные боли и спутанность сознания. В качестве терапии вводят щелочные растворы, лактат или гидрокарбонат натрия.
Взаимодействие
- Вещество усиливает эффект от приема метформина и глибенкламида.
- Средство подкисляет мочу, вследствие чего повышается почечная секреция эфедрина, фенамина, фенфлурамина, хинидина.
- Лекарство усиливает противомикробный эффект от приема метенамина.
Особые указания
Вещество рекомендуется принимать после еды.
При беременности и лактации
Средство противопоказано к приему беременными женщинами.
Препараты, в которых содержится (Аналоги)
Торговое название средства: Хлорид Аммония.
Отзывы
Отзывов о применении лекарства очень мало. Однако резко негативные отсутствуют. Да данный момент вещество назначают не часто. Его бывает сложно купить в аптечной сети.
Цена, где купить
Купить Аммония Хлорид для не медицинского применения можно оптом по цене приблизительно 30 рублей за кг.
Источник: https://medside.ru/ammoniya-hlorid
Хлорид аммония — это… Что такое Хлорид аммония?
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
|
Свойства
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NH4Cl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов
- как дымообразователь;
- используется для производства героина из опия;
- в фотографии как компонент быстрого фиксажа.
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — раствором аммиака в воде.
Источник: https://dic.academic.ru/dic.nsf/ruwiki/139760
Хлорид аммония — Ammonium chloride
Хлорид аммония представляет собой неорганическое соединение с формулой NH 4 Cl и белого кристаллического соли , который хорошо растворим в воде. Растворы аммония хлорида являются слегка кислыми. Нашатыря это имя природного, минералогического виде хлорида аммония.
Минерал обычно образуются при сжигании угля свалок от конденсации угольных полученных газов. Он также находится вокруг некоторых типов вулканических жерл. Он в основном используется в качестве удобрения и вкусового вещества в некоторых типах солодки .
Это продукт из реакции соляной кислоты и аммиака .
производство
Демонстрация синтеза хлорида аммония. Концентрированный аммиак и соляной кислоты растворы добавляют к двум газ для мытья бутылок, соответственно.
Использование резиновых насосов, воздуха (действующий в качестве газа-носителя) вводят в газовой промывки труб, вызывающих потоки аммиака и хлористого водорода в воздухе сталкиваться и реагировать давая твердый продукт, хлорид аммония.
Это является продуктом процесса Сольва , используемым для получения карбоната натрия :
СО 2 + 2 NH 3 + 2 NaCl + H 2 O → 2 NH 4 Cl + Na 2 CO 3
В дополнении к основному методу для изготовления хлорида аммония, что метод используются, чтобы минимизировать высвобождение аммиака в некоторых промышленных операциях.
Хлорид аммония получают путем объединения коммерчески аммиак (NH 3 ) или с хлористым водородом (газ) и соляной кислоты (водный раствор):
NH 3 + HCl → NH 4 Cl
Хлорид аммония происходит естественно в вулканических районах, образуя на вулканических пород вблизи вытяжных-рилизинг вентиляционных отверстий ( фумаролы ). Кристаллы депонировать непосредственно из газообразного состояния и имеют тенденцию быть кратковременным, так как они легко растворяются в воде.
Реакции
Хлорид аммония , как представляется , сублимировать при нагревании , но на самом деле распадается на аммиак и хлористый водород газа.
NH 4 Cl → NH 3 + HCl
Хлорид аммония реагирует с сильным основанием, как гидроксид натрия , чтобы выпустить газообразный аммиак:
NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Аналогичным образом, хлорид аммония, также вступает в реакцию с карбонатами щелочных металлов при повышенных температурах, что дает аммиака и хлорида щелочного металла:
2 NH 4 Cl + Na 2 CO 3 → 2 NaCl + CO 2 + H 2 O + 2 NH 3
5% -ный по массе раствор хлорида аммония в воде имеет рН в диапазоне от 4,6 до 6,0.
Некоторые из реакций хлорида аммония с другими химическими продуктами эндотермическими , как и его реакция с гидроксидом бария и его растворение в воде.
Приложения
кристалл (ы) хлорид аммония
Доминирующее применение хлорида аммония в качестве азота источник в удобрениях ( что соответствует 90% от мирового производства хлористого аммония) , таких как chloroammonium фосфат. Основные сельскохозяйственные культуры оплодотворенные таким образом являются рис и пшеница в Азии .
Хлорид аммония используется в пиротехнике в 18 веке , но был заменен более безопасными и менее гигроскопичными химическими веществами. Его цель состояла в том, чтобы обеспечить донор хлора для усиления зеленого и синего цвета из ионов меди в пламени.
Он имел вторичное использование , чтобы обеспечить белый дым, но ее готов двойной реакции разложения с хлората калия , продуцирующей крайне нестабильным хлорат аммония из его использование очень подозреваем.
Хлорид аммония используется в качестве флюса при подготовке металлов быть олова с покрытием, оцинкованные или припаян.
Он работает в качестве флюса путем очистки поверхности изделий путем взаимодействия с оксидами металлов на поверхности с образованием летучего хлорида металла.
Для этой цели он продается в блоках в магазинах оборудования для использования в очистке кончика паяльника, и он также может быть включен в качестве припоя потока.
Лекарственное средство
Хлорид аммония используют в качестве отхаркивающего средства в лекарства от кашля. Его отхаркивающее действие обусловлено раздражающим действием на слизистой оболочке бронхов, что вызывает образование избытка жидкости дыхательных путей, которые , предположительно , легче кашлять. Соли аммония являются раздражителем для слизистой оболочки желудка и могут вызвать тошноту и рвоту.
Хлорид аммония используется в качестве системного подкисляющего агента в лечении тяжелой метаболического алкалоза , в тесте загрузки пероральное кислоты для диагностики дистальных почечных канальцев ацидоз, чтобы поддерживать мочу при кислом рН при лечении некоторых мочевыводящих путей расстройств.
питание
Хлорид аммония, под названием нашатыря или Salmiak используется в качестве пищевой добавки под номером Е E510, работая в качестве дрожжей в хлебопечении питательных веществ и как подкислитель. Это кормовая добавка для крупного рогатого скота и ингредиент в питательных средах для дрожжей и многих микроорганизмов.
Хлорид аммония используется для специй темных сладостей под названием Salmiak (популярный в Скандинавии и других близлежащих странах), в выпечке , чтобы дать печенью очень хрустящую текстуру, и в щелоке Salmiakki Koskenkorva для ароматизации. В Иране, Таджикистане, Индии, Пакистана и арабских странах его называют «Noshader» и используется для улучшения четкости закусок , таких как самосы и jalebi .
В лаборатории
Аммония хлорид был использован исторически для получения низких температур в охлаждающих ваннах . Хлорид аммония растворы с аммиаком , используются в качестве буферных растворов , в том числе ACK (аммоний-хлорид калия) буфера для лизиса .
В палеонтологии , пары хлорида аммония осаждают на ископаемых , где вещество образует блестящий белый, легко удаляются и достаточно безвреден и инертный слой мелких кристаллов.
Это охватывает любую окраску ископаемое может иметь, и если зажег под углом высоко усиливает контраст в фотодокументации трехмерных образцов. Же метод применяется в археологии , чтобы исключить отражение на стекле и аналогичные образцы для фотографирования.
В органическом синтезе насыщенный NH 4 раствор Cl обычно используется для гашения реакционных смесей.
флотация
Гигантские кальмары и некоторые другие крупные кальмары видов поддерживать нейтральную плавучесть в морской воде через раствор хлорида аммония , который находится на протяжении всего их тел и менее плотный , чем в морской воде.
Это отличается от метода флотации , используемого большинство рыб, которая включает в себя заполненный газ плавательного пузыря.
Решение вкус несколько как Salmiakki и делает гигантский кальмар непривлекательный для общего потребления человека.
Другие приложения
Хлорид аммония используют в 5% водном растворе ~ для работы на нефтяных скважинах с глинистыми набухания проблем. Он также используется в качестве электролита в угольно-цинковых батарей . Другие области применения включают в шампунь для волос, в клее , которое связывает фанеру, и в чистящих средствах.
В шампуне волос, она используется в качестве загустителя в системах на основе аммониевых поверхностно -активных веществ , таких как лаурилсульфат аммония . Хлорид аммония используется в текстильной и кожевенной промышленности, в красильной, кожевенной, текстильной печати и хлопка кластеризация.
На рубеже 20 — го века, Хлорид аммония был использован в водном растворе в качестве электролита в клетках Leclanché . Эти клетки нашли коммерческое применение в качестве «местная батареи» в телефонных установках абонентов.
В деревообработке, раствор хлорида аммония и воды, при нанесении на незаконченную древесину, будет гореть , когда подвергается тепловой пушке , что приводит к брендинговой марке железа без использования клейма железа. Решение может быть нарисовано на древесину или наносится с общим резиновым штампом.
история
Самое раннее упоминание о хлорида аммония в 554 г. н.э. в Китае.
В то время, хлорид аммония из двух источников: (1) вентиляционные отверстия подземных угольных пожаров в Центральной Азии, в частности, в Тянь — Шане горе (которые простираются от Синьцзяной провинции на северо — запад Китая через Кыргызстан ), а также в Алайском ( или Алай) горы юго — западной Киргизии, и (2) в фумаролы вулкана Маунт Тафтан на юго — востоке Ирана .
(Действительно, слово хлорида аммония в нескольких азиатских языках происходит от иранского фраза anosh Adur (бессмертный огонь), ссылка на подземных пожаров.) Хлористый аммоний затем транспортируются вдоль Шелкового пути на восток в Китай и на запад к мусульманским землям и Европа.
Около 800 г. н.э. арабы Египта обнаружили хлорид аммония в саже, что в результате сжигания верблюжьих помет, и этот источник стал альтернативным источникам в Центральной Азии.
Рекомендации
Список используемой литературы
- Бишоф, Густав с Бенджамином Х. Павла и Дж Драммонд, транс. (1854). Элементы химической и физической геологии . 1 . Лондон, Англия: Кавендиш общество.CS1 садоводы: Несколько имена: список авторов ( ссылка )
- Needham, Джозеф; Ho Ping-юй; Лу Гуэи Джен; Sivin, Натан (1980). Наука и цивилизация в Китае . 5: Химия и химическая технология, Часть IV: Spagyrical открытия и изобретение: аппарат, теория и подарки. Кембридж, Англия: Cambridge University Press. ISBN 978-0521086905 .CS1 садоводы: Несколько имена: список авторов ( ссылка )
- Sutton, М.; Эрисман, Дж Вт; Dentener, F; Мёллер, D (2008). «Аммиак в окружающей среде: С древних времен до наших дней ». Загрязнение окружающей среды . 156 (3): 583-604. DOI : 10.1016 / j.envpol.2008.03.013 . PMID 18499318 .
внешняя ссылка
Источник: https://ru.qwe.wiki/wiki/Ammonium_chloride




