История открытия бериллия начинается с XVIII столетия, в конце которого французский химик Л. Воклен пытался установить, чем схож по химическому составу ценный минерал бериллия с изумрудом. Из последнего минерала он и выделил оксид элемента BeO. Получить металлический бериллий удалось лишь 30 лет спустя в 1828 году.
Пройдет еще семидесятилетие, прежде чем другой француз – Поль Лебо синтезирует чистые металлические кристаллы вещества посредством электролиза бериллия и двойного фторида калия. Ученый пошел далее, испытав кристаллический порошок на вкус, откуда и пошло изначальное название элемента – глюциний (glykуs – сладкий в переводе с греческого).
Кстати, во Франции наименование бериллий – Be часто сопровождается Glicinium – Gl до сих пор.
Физические свойства бериллия
В свободном состоянии элемент представляет легкий металл серебристо-серого цвета. На воздухе бериллий приобретает матовый оттенок вследствие, быстрого образования поверхностной оксидной пленки.
Строение атома бериллия включает четыре электрона, образующих конфигурацию 1s22s2. Параметры атомного и ионного радиусов Ве составляют 0.113, 0.034 нанометра, соответственно. Порядковый номер элемента в периодической таблице – 4.
Атомная масса бериллия – 9.0122.

Фото бериллий
Элемент характеризуется плотностью 1.816 грамм на сантиметр кубический, и рядом критических температур:
- фазового перехода от гексагональной к кубической решетке – 1277 0С.
Бериллий характеризуется наивысшей теплоемкостью, относительно других металлов, хорошей теплопроводностью и низким электрическим сопротивлением.
Химические свойства бериллия
Элемент 2-валентен. Его отличает высокая химическая активность. Устойчивости бериллия на воздухе способствует быстрое окисление: образование прочной поверхностной пленки ВеО, препятствует дальнейшим реакциям.
Дальнейшее быстрое окисление металла происходит при нагревании свыше 800 0С. Взаимодействие металла с водой происходит только после достижения температуры ее кипения. Бериллий растворим в большинстве кислот, исключение составляет только концентрированная азотная.
Также элемент растворяется в водных растворах щелочей, образуя соли бериллия.
Видео — Бериллий. Легкий и дорогой металл:
Взаимодействие Be с другими элементами происходит преимущественно при нагревании. Так, нитрид бериллия образуется при температуре свыше 650 0С в атмосфере азота. Взаимодействие Be с углеродом при 1200 0С и выше переводит металл в карбид бериллия. Более интересно происходит образование гидрида бериллия.
Действительно сам металл не взаимодействует с водородом при любых температурах. Поэтому получить гидрид бериллия можно только вследствие разложения органических соединений, содержащих Be. Еще одна особенность, которой характеризуется гидрид бериллия – он устойчив только при температурах менее 240 0С.
Получение бериллия
Металлический Be получают из одноименного минерала – берилл. Для этого, исходное сырье перерабатывается в гидроксид или сульфат бериллия. В обоих случаях процедура проходит в несколько стадий.
В частности, чтобы получить сульфат бериллия, исходный минерал спекается с известью. Полученное соединение впоследствии обрабатывается серной кислотой.
На заключительной стадии образовавшийся сульфат бериллия выщелачивают водой и осаждают аммиаком.
Видео — Дороже Золота. Первый российский бериллий:
Альтернативные способы получения чистой формы металла, предусматривают вскрытие берилла, с последующей обработкой состава двумя способами, чтобы получить:
- Фторид бериллия.
- Хлорид бериллия.
В первом случае, полученный фторид бериллия проходит процедуру восстановления магнием при температуре около 1000 0С. Во втором варианте, для выделения чистого металла производится электролиз хлорида бериллия в смеси с NaCl.
Завершающий этап – получение высокочистого металлического Be происходит различными способами:
- электронное рафинирование.
Полученный металл измельчают до порошкообразного состояния и прессуют в вакууме при температуре около 1150 0С.
Трубная продукция, прутки и прочие виды профилей металла изготавливаются по технологии горячего и теплого выдавливания, тогда как листовой бериллий производится посредством прокатки. Ковки или волочения.
Применение бериллия
Как и для прочих металлов, востребованность бериллия связана с его физико-химическими свойствами. В частности, присущая элементу низкая величина сечения захвата тепловых нейтронов, а также его малая масса, делает металл перспективным для использования в атомных реакторах. Из него изготавливаются замедлители и отражатели нейтронов для этих установок.
Высокие параметры прочности и модуля упругости при низкой плотности элемента вызвали интерес к бериллию со стороны таких отраслей, как авиационная и космическая техника, ракетостроение.
Единственное препятствие для широкого использования металла в качестве конструкционного материала связана с с хрупкостью Be при комнатной температуре.
Тем не менее, легированные бериллием тугоплавкие металлы, – остаются перспективными конструкционными материалами в авиации и ракетостроении.
Высокая проницаемость рентгеновским излучением (превышает аналогичный параметр алюминия в 17раз) тоже нашла применение металлу. Из него производятся окна рентгеновских трубок. Наконец, еще одно использование бериллия связано с применением это соединений в качестве твердого ракетного топлива.

Детали из бериллиевой бронзы
Альтернативно, элемент имеет высокий потенциал как легирующая добавка к сплавам металлов.
Бериллий даже в незначительных пропорциях способен существенно улучшать такие характеристики соединений, как твердость, прочность, устойчивость к коррозии. Одно из перспективных направлений легирования Be связано со сплавами меди.
Внедрение элемента на уровне 3 – 6%, создает бериллиевые бронзы – материал, интенсивно используемый в производстве пружин с улучшенными характеристиками:
- низкая механическая усталость;
- отсутствие искрения в результате ударов.
Используется бериллиевая бронза и как обшивка кораблей в космонавтике. Это обусловлено, тем, что данный сплав превосходит легированные стали по разрывной прочности. Дополнительный фактор в пользу бериллиевой бронзы – низкий уровень механической усталости в процессе эксплуатации.
Со временем открываются новые перспективы использования металла. Так, металлургическое применение бериллия связано с парой Be-Mg. Добавка 0,005% бериллия резко сокращает расход магния на испарение и окисление.
В медицине применяется хлорид бериллия, как вещество для диагностики туберкулеза.
Массовое потребление бериллии, как и рост цен на него, началось с середины прошлого века, что открыло другую важную деталь, связанную с переработкой этого металла.
Как элемент, Be присутствует в тканях большинства представителей флоры и фауны. Так, концентрация бериллия в почве составляет тысячные доли процента, для золы растений эта величина на порядок меньше.
Относительно животных, Be равномерно распределен у них по тканям, с суммарной концентрацией, которая исчисляется в пределах от десятитысячных до тысячных долей процента. При нормально функционировании организма, половина бериллия выделяется с мочой.
Оставшаяся часть элемента оседает в костях – 30%, печени и почках – по 8%.
Металлическая пыль бериллия — очень опасна для человека
Опасен ли бериллий?
Для человека вредны летучие соединения бериллия, его пыль. Как результат, переработка Be требует соблюдения определенных норм безопасности, в частности использование специальных мер защиты, чтобы избежать отравления бериллием.
Случай в истории СССР
В недалекие советские времена, а именно в 1990 году, в Казахской ССР на одном из металлургических предприятий (сейчас это АО УМЗ), которое работало с бериллием, произошел взрыв в бериллиевом цехе — вся опасная пыль и мелкая стружка поднялась в небо над городом Усть-Каменогорск. Превышение ПДК вредных веществ, как тогда зафиксировали, составило 14 000 раз.
Всего произошло около 5 взрывов, при этом в воздух поднялось 65 тонн мельчайшего бериллия. Как это все происходило и как боролись с катастрофой — читайте историю большого взрыва.
После взрыва люди боялись последствий, кто-то пророчил, что результат взрыва проявится через 15 лет — на нынешних детях, на беременных женщинах, какие именно тяжелые последствия ждут людей — никто толком не знал.
И вот, прошло уже больше 26 лет — катастрофических изменений в жизни населения города не произошло, не считаю тех людей, кто оказался непосредственно в эпицентре взрыва, городу повезло — пыль осела и не распространилась воздуху.

Так сегодня выглядит территория завода АО «УМЗ» в котором и сейчас существует бериллиевый цех
Источник: https://xlom.ru/spravochnik/berillij-svojstva-primeneniya-splavy-berilliya
ПОИСК
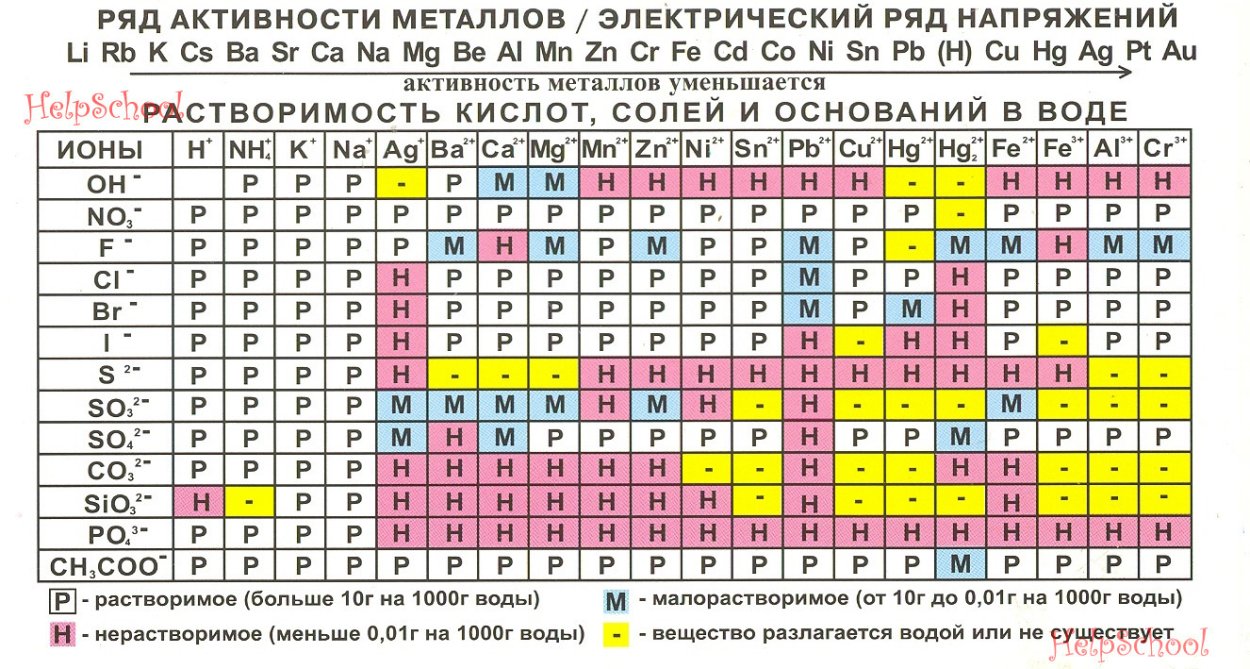
Что образуется при действии избытка щелочи на сульфат бериллия [c.255]
Сульфаты всех металлов, кроме бериллия, встречаются в природе. Растворимость их в воде падает от сульфата бериллия к сульфату бария [c.50]
Хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов уменьшается в ряду Ве—Ва. [c.296]
Четырехводный сульфат бериллия не растворяется в абсолютном спирте и ацетоне. [c.175]
Осаждение гидроокиси бериллия из раствора сульфата происходит через стадию образования основной соли.
Известны несколько основных сульфатов бериллия, которые при упаривании и последующем охлаждении раствора не кристаллизуются, а застывают в виде стекла.
По данным некоторых исследователей, основные сульфаты представляют собой твердые растворы сульфата бериллия в его гидроокиси [3, стр. 36]. [c.175]
Ни фторид, ни оксифторид бериллия не растворяются в абсолютном спирте и в его смеси с эфиром. ВеРз не растворяется в плавиковой кислоте. При растворении в серной кислоте идет обменная реакция — образуются плавиковая кислота и сульфат бериллия. При растворении в жидком аммиаке (—78,5°С) образуется соединение ВеРа-NHs, разлагающееся при повышении температуры. Это соединение — единственный, к тому же нестабильный аммиакат, так как (выше на это указывалось) фториды в отличие от других галогенидов не склонны давать комплексы с нейтральными лигандами. [c.180]
Вопрос о растворимости сульфатов бериллия и алюминия в присутствии сульфата аммония подробно освещен в разделе Химия бериллия . [c.198]
А подгруппа. Щелочноземельные металлы образуют плохорастворимые сульфаты. Бериллий амфотерен. Магний по свойствам близок к литию. [c.149]
Бериллий и его соединения окись бериллия, гидрат окиси бериллия, карбид бериллия, сульфат бериллия, хлорид бериллия, фторокись бериллия и аэрозоли остальных соединений бериллия. [c.167]
Можно получить р-форму также непосредственно взаимодействием растворов сульфата бериллия и едкого натра [37].
р-Фор-ма получается и при действии газообразного аммиака на растворы сульфата бериллия, нагретого до 95—98° С при pH 7,5 [14, стр. 22].
р-Форма кристаллизуется в ромбической сингонии а — 4,61 Ь = 7,02 с == 4,52 А с четырьмя формульными единицами в ячейке) [36]. [c.10]
Безводный сульфат бериллия — гигроскопичное вещество, которое получают обезвоживанием гидратированной соли при температуре около 400° С.
В аналитической химии сульфат бериллия как весовая форма не используется, так как он гигроскопичен и дегидратация его (при 400° С) протекает с трудом [62], а при более высокой температуре (около 600° С) он разлагается с выделением ЗОз [96—98]. [c.16]
Тетрагидрат сульфата бериллия хорошо растворим в воде [104, 105] [c.17]
Присутствие серной кислоты сильно понижает растворимость сульфата бериллия (табл. 4). [c.17]
| Таблица 4 Растворимость сульфата бериллия в серной кислоте при 25° С [104] |  |
Растворы сульфата бериллия имеют кислую реакцию. Константа гидролиза равна 1,4 10″ [43]. [c.18]
Степень гидролиза растворов сульфата бериллия при 25° С [106] [c.18]
Значения pH растворов сульфата бериллия (i20° ) [c.18]
Хорошие результаты получаются при титровании горячих нейтральных растворов сульфата бериллия раствором гидроокиси бария по фенолфталеину [173]. [c.60]
Безводный сульфат бериллия получают термическим обезвоживанием четырехводного гидрата. Процесс протекает через образование ряда промежуточных гидратов при 115, 200 и 250° [21]. Не разлагается при нагревании до 530—540°, но при 550° начинает разлагаться, выделяя SO3. Полное разложение наступает приблизительно при 1031°.
Метод термической диссоциации сульфата используется в промышленности для получения окиси бериллия. Интересно отметить, что скорость разложения сульфата бериллия значительно меньше, чем сульфата алюминия (при 750° давление пара SO3 над BeS04 365 мм рт. ст., над А12(504)з — 900 мм рт. ст.). Это можно использовать для частичного их разделения.
[c.174]
Сульфат бериллия образует двойные соли с сульфатом аммония и сульфатами щелочных элементов. Но эти соли (типа шенитов) в отличие от двойных сульфатов магния и алюминия хорошо растворяются в воде.
В присутствии сульфата бериллия растворимость алюмоам-монийных квасцов еще более уменьшается, что увеличивает эффект разделения элементов. Способ отделения алюминия от бериллия в виде алюмоаммонийных квасцов один из самых надежных.
[c.175]
Фосфат бериллия. Ортофосфат выделяется из растворов в виде тетрагидрата Вез(Р04)2-4Н20.
В виде микроскопически малых белых кристаллов может быть получен, если перекристаллизовать из 10%-ной уксусной кислоты осадок, полученный добавлением к раствору сульфата бериллия двухзамещенного ортофосфата натрия.
При 100° тетрагидрат теряет одну молекулу воды. Полное обезвоживание наступает при более высокой температуре. Средний фосфат бериллия [c.175]
Соли органических кислот. Оксалат бериллия [1, стр. 42]. В виде тригидрата ВеС204-ЗН20 получается при упаривании раствора основного карбоната с небольшим избытком щавелевой кислоты.
Эта соль интересна тем, что она единственная из оксалатов двухвалентных металлов обладает значительной растворимостью (при 25° 24,85% в расчете на безводный оксалат).
Кроме того, отмечена относительно низкая электропроводность, равная одной четвертой электропроводности эквивалентного раствора сульфата бериллия. Это объясняется тем, что бериллий в растворе частично находится в виде комплекса [Ве(С204)21 .
При нагревании тригидрат неустойчив и уже около 50 переходит в моногидрат, который выше 225° разлагается до окиси. Скорость разложения увеличивается с ростом температуры. Термическое разложение оксалата предложено использовать как одну из стадий получения окиси бериллия особой чистоты. [c.176]
В качестве примера практического применения сернокислотного метода переработки берилла на рис. 31 приведена технологическая схема производства гидроокиси бериллия, используемая фирмой Браш бериллиум . Активирование берилла перед сернокислотной обработкой производится по этой схеме термическим методом.
Концентрат, предварительно нагретый, плавят при 1700°С. Плавы выливают в закалочную ванну с водой. Классификация на грохоте стекловидных агломератов, полученных при закалке, позволяет отделить куски размером более 13 мм, в которых возможна рекристаллизация (что затруднит последующее взаимодействие с серной кислотой).
Эти куски направляются в начало процесса. Отсеянный спек подвергают термообработке при 900° во вращающейся печи. Затем его измельчают в шаровой мельнице, которая работает в замкнутом цикле с воздушным классификатором. Мокрое измельчение не применяется, чтобы при сульфатизации не разбавлять серную кислоту.
Измельченный спек через дозатор поступает в железный аппарат предварительного смешения. Туда же поступает серная кислота (93%) в количестве, несколько превышающем то, которое необходимо для образования сульфатов бериллия и алюминия. Избыток серной кислоты нужен в дальнейшем для получения сульфата аммония при взаимодействии с аммиаком.
Кислая пульпа впрыскивается тонкой непрерывной струей в стальной барабан, нагреваемый газом до 250—300°. Пульпа попадает на его раскаленные стенки. При этом почти мгновенно сульфатизируются ВеО и AI2O3. Полнота сульфатизации 93—95%. Такой метод значительно продуктивнее одновременной сульфатизации больших количеств окислов.
Отходящие газы пропускают через циклон, где оседают тонкие [c.199]
Напишите графическую формулу а) нитрита магния б) сульфата бериллия в) нитрата натрия г) сульфита кальция д) бромида алюминия е). перхлората. пития ж) селената алюминия з) бромида стронция и) ди-)сромата калия к) манганата натрия л) перманганата лития м) алюмината калия н) фосфата калия о) фторида кальция п) нитрата гидроксомагния р) гидроксо- [c.24]
Из сульфата бериллия. 0,7082 г Ве504-4Н20 растворяют в воде, к которой добавлено 4 мл концентрированной соляной кислоты и разбавляют водой до 1 л. 1 мл раствора соответствует 0,1 мг ВеО.
Для получения раствора, содержащего 0,1 мг мл Ве, растворяют 1,9655 г сульфата бериллия в 25—30 мл воды, прибавляют 1 мл концентрированной соляной кислоты и разбавляют водой до 1 л. [c.
244]
К анализируемому раствору сульфата бериллия прибавляют 5 капель раствора, содержащего 0,2 г метилоранжа и 0,28 г красителя ксиленцианол FF в 100 50%-ного спирта, а затем по каплям, при непрерывном перемешивании, 20%-ный раствор NaOH до перехода красной окраски в серую. Раствор переносят в делительную воронку, емкостью 500 мл (применяя для промывания минимальное количество дистиллированной воды), прибавляют Ъмл раствора 0,5 г 8-оксихинолина в 100. ил H lg и встряхивают 5 мин. дают разделиться фазам и сливают [c.196]
Бериллий получают электролизом расплава Be lg — Na l при 350 С. Вначале получают из бериллового концентрата сульфат бериллия путем спекания его с известью с последующим выщелачиванием сплава серной кислотой. Нейтрализацией сернокислого раствора осаждают гидроксид бериллия, который прокаливают до оксида. ВеО хлорируют в смеси с коксом [c.139]
При добавлении ортофосфата щелочного металла к раствору сульфата бериллия образуются основные фосфаты бериллия [78. Наиболее важен для аналитической химии двойной фосфат бериллия и аммония НН4ВеР04, который также мало растворим (ПР = 2,2-10-2 ) [81]. Аммоний-бериллий-фосфат образуется [c.14]
Имеются сведения о существовании моногидрата сульфата бериллия [104а], который может быть получен при термическом разложении тетрагидрата при 240—245° С. [c.17]
Бриттон [30] изучал гидролиз сульфата бериллия методом потенциометрического титрования по его данным, появление осадка основной соли происходит при pH 5,7 и заканчивается при pH 6,5. Для образования основного сульфата 9,55 ВеО-0,45 BeS04 расходуется 1,9 экв. щелочи. Кривая термометрического титрования также подтверждает его образова ние [107]. [c.18]
В растворе основного сульфата бериллия растворяется значительное количество окиси и гидроокиси бериллия [108, 109].
Растворимость окиси бериллия в растворах сульфата бериллия с повышением температуры возрастает до 180° С и до 230° С остается неизменной, что подтверждает устойчивость соединения 2 BeS04 Be0 j H20 [109].
Растворимость окиси алюминия в растворах сульфата бериллия в 10 раз меньше растворимости окиси бериллия. [c.18]
При гидролизе сульфата бериллия и других его солей образуются сначала ионы ВеОН+, полимеризующиеся с образованием многоядерных катионов [c.19]
Белявской и Колосовой методом ионного обмена и электрофореза на бумаге установлено, что в растворах хлорной кислоты ( 1 = 0,1) гидролиз иона бериллия начинается при рН 2, и полимеризация— при концентрации бериллия 10″ моль1л [111].
В присутствии серной кислоты обнаружено комплексообразование бериллия с сульфат-ионом в растворах с ионной силой 0,5 и pH 1 образуется BeS04 (/Сует = 5,28). В кислых растворах сульфата бериллия существует, вероятно, комплексный анион [c.
19]
Эванс [381] предложил предварительно осаждать гидроокись бериллия избытком аммиака и растворять ее после отделения и промывания в определенном количестве кислоты, взятой в избытке, который может быть определен иодометрически. Метод весьма трудоемок, так как требует отделения гидроокиси бериллия.
Сусеела [382] считает, что гидролиз сульфата бериллия смесью KJ — Оз протекает полностью в присутствии избытка тиосульфата, если реакцию проводить при 50—60° С в течение 4—5 час. При этой температуре разложения тиосульфата не наблюдалось. Метод использовали для определения 4—35 мг ВеО. [c.
60]
Предложен метод фотометрического титрования бериллия сульфосалицилатом натрия [385а]. Конечную точку определяют при титровании избытка сульфосалициловой кислоты раствором сульфата бериллия с использованием фотометрического титра-тора. В качестве индикатора применен арсеназо. Оптимальная величина pH 10,6. Интервал определяемых концентраций 0,05—15 мг. [c.61]
Источник: https://www.chem21.info/info/144479/
№4 Бериллий
Бериллий был открыт в 1798 году Л. Вокленом в виде берилловой земли (оксида ВеО), когда этот французский химик выяснял общие особенности химического состава драгоценных камней берилла и изумруда. Металлический бериллий был получен в 1828 г. Ф. Велером в Германии и независимо от него А.
Бюсси во Франции. Однако из-за примесей его не удавалось сплавить. Лишь в 1898 г. французский химик П. Лебо, подвергнув электролизу двойной фторид калия и бериллия, получил достаточно чистые металлические кристаллы бериллия.
Интересно, что из-за сладкого вкуса растворимых в воде соединений бериллия элемент вначале называли «глюциний» (от греческого glykys — сладкий). Из-за сходства свойств бериллия и алюминия считалось, что это трехвалентный металл с атомной массой 13,5. Эту ошибку исправил Д.И.
Менделеев, который, исходя из закономерности изменения свойств элементов в периоде, определил бериллию место во второй группе.
Нахождение в природе, получение:
Бериллий относится к редким элементам, его содержание в земной коре 2,6·10-4% по массе. В морской воде содержится до 6·10-7 мг/л бериллия.
Основные природные минералы, содержащие бериллий: берилл Be3Al2(SiO3)6, фенакит Be2SiO4, бертрандит Be4Si2O8·H2O и гельвин (Mn,Fe,Zn)4[BeSiO4]3S.
Окрашенные примесями катионов других металлов прозрачные разновидности берилла — драгоценные камни, например, зеленый изумруд, голубой аквамарин, гелиодер, воробьевит и другие. В настоящее время их научились синтезировать искусственно.
В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
- BeCl2+2K=Be+2KCl.
- BeF2+Mg=Be+MgF2
В настоящее время бериллий получают,восстанавливая его фторид магнием:
либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Физические свойства:
Металлический бериллий — твердый, хрупкий металл серого цвета. На воздухе бериллий, как и алюминий, покрыт оксидной пленкой, придающей ему матовый цвет.
Температура плавления 1278°C, температура кипения около 2470°C, плотность 1,816 кг/м3.
До температуры 1277°C устойчив a-Ве (гексагональная решетка типа магния (Mg), параметры а = 0,22855 нм, с = 0,35833 нм), при температурах, предшествующих плавлению металла (1277-1288°C) — b-Ве с кубической решеткой.
Химические свойства:
Наличие оксидной пленки предохраняет металл от дальнейшего разрушения и обусловливает его невысокую химическую активность при комнатной температуре. При нагревании бериллий сгорает на воздухе с образованием оксида BeO, реагирует с серой и азотом. С галогенами бериллий реагирует при обычной температуре или при слабом нагревании.
Все эти реакции сопровождаются выделением большого количества теплоты, так как прочность кристаллических решеток возникающих соединений (BeO, BeS, Be3N2, ВеCl2 и др.) довольно велика. Благодаря образованию на поверхности прочной пленки бериллий не реагирует с водой, хотя находится в ряду стандартных потенциалов значительно левее водорода.
Как и алюминий, бериллий реагирует с кислотами и растворами щелочей:
Be + 2HCl = BeCl2 + H2,
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2. Интересно, что бериллий хорошо растворяется в концентрированных растворах фторидов:
Be + 4NH4F + 2H2O = (NH4)2[BeF4] + 2NH3*H2O + H2↑
Причина — образование прочных фторидных комплексов.
Важнейшие соединения:
Оксид бериллия, BeO встречается в природе в виде редкого минерала бромеллита. Получают термическим разложением сульфата или гидроксида бериллия выше 800° С. Продукт высокой чистоты образуется при разложении основного ацетата [Be4O(OOCH3)6] выше 600°С.
Непрокаленный оксид бериллия гигроскопичен, адсорбирует до 34% воды, а прокаленный при 1500° С — лишь 0,18%.
Оксид бериллия, прокаленный не выше 500°С, легко взаимодействует с кислотами, труднее — с растворами щелочей, а прокаленный выше 727° С — лишь со фтороводородной кислотой, горячей концентрированной серной кислотой и расплавами щелочей.
Устойчив к воздействию расплавленных лития, натрия, калия, никеля и железа. Оксид бериллия обладает очень высокой теплопроводностью. Считается одним из лучших огнеупорных материалов, используется для изготовления тиглей и других изделий
Гидроксид бериллия, Be(OH)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: Be(OH)2 + 2КOH = К2[Be(OH)4],
Be(OH)2 + 2HCl = BeCl2 + 2H2O.
Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be4O(CH3COO)6.
Галогениды бериллия, бесцв. крист. вещества, расплываются на воздухе, поглощая влагу. Для получения безводного хлорида используется реакция 2BeO + CCl4 = 2BeCl2 + CO2Подобно хлориду алюминия BeCl2 является катализатором в реакции Фриделя – Крафтса. В растворах подвергается гидролизу…
Бериллаты, в концентрированных растворах и расплавах щелочей присутствуют бериллаты состава M2BeO2, M3BeO4, в разбавленных растворах гидроксобериллаты M2[Be(OH)4]. Легко гидролизуются до гидроксида бериллия.
…
Гидрид бериллия, BeH2 — полимерное вещество, его получают реакцией:
BeCl2 + 2LiH = BeH2 + 2LiCl
Карбид бериллия, Be2С — образуется при взаимодействии бериллия с углеродом. Подобно карбиду алюминия гидролизуется водой с образованием метана.
Применение:
Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твердость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий.
Бериллиевые бронзы (Cu и 3-6% Be) – материал для пружин c большой устойчивостью к механической усталости и совершенно не дающих искр при механических ударах. Бериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубок (через которые излучение выходит наружу).
В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов.
В смесях с некоторыми a-радиоактивными нуклидами бериллий используют в ампульных нейтронных источниках, так как при взаимодействии ядер бериллия-9 и a-частиц возникают нейтроны: 9Ве(a,n)12C.
Физиологическое действие: в живых организмах бериллий, по-видимому, не несет никакой биологической функции, однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Летучие и растворимые соединения бериллия, а также пыль, содержащая бериллий и его соединения, очень токсичны, канцерогенны (ПДК 0,001 мг/м3).
Рудакова Анна Валерьевна
ХФ ТюмГУ, 561 группа.
Источник: http://www.kontren.narod.ru/x_el/info04.htm
2.2.2. Химические свойства металлов IIA группы
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы.
Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием.
В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO.
Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
- Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
- 2Mg + O2 = 2MgO
- 2Ca + O2 = 2CaO
- 2Ba + O2 = 2BaO
- Ba + O2 = BaO2
- Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
- Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
- Мg + I2 = MgI2 – иодид магния
- Са + Br2 = СаBr2 – бромид кальция
- Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл.
Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена.
Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода.
Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO.
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
- Ве + Н2SO4(разб.) = BeSO4 + H2↑
- Mg + 2HBr = MgBr2 + H2↑
- Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
- С разбавленной азотной кислотой реагируют все металлы IIA группы.
При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
- 4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
- Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
- Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
- Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы может происходить до SO2, H2S и S в зависимости от активности металла, температуры проведения реакции и концентрации кислоты:
- Mg + H2SO4(конц.) = MgSO4 + SO2↑ + H2O
- 3Mg + 4H2SO4(конц.) = 3MgSO4 + S↓ + 4H2O
- 4Ca + 5H2SO4(конц.) = 4CaSO4 +H2S↑ + 4H2O
с щелочами
- Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении.
При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
- Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
- При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
- Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-metallov-iia-gruppy




