Если кислород является самым распространенным химическим элементом на Земле, то водород – самый распространенный элемент во всей Вселенной. Наше Солнце (и другие звезды) примерно на половину состоит из водорода, а что касается межзвездного газа, то он на 90% состоит из атомов водорода. Немалое место этот химический элемент занимает и на Земле, ведь вместе с кислородом он входит в состав воды, а само его название «водород» происходит от двух древнегреческих слов: «вода» и «рожаю». Помимо воды водород присутствует в большинстве органических веществ и клеток, без него, как и без кислорода, была бы немыслима сама Жизнь.
История открытия водорода
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом.
Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Водород в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода.
То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему.
Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы водорода
Водород это газ, молекула его состоит из двух атомов.

Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства водорода
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства водорода
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить водород?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Применение водорода
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Водород, видео
И в завершение образовательное видео по теме нашей статьи.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник: https://www.poznavayka.org/himiya/vodorod/
Перекись водорода — химическая формула
Перекись водорода (Н2О2) — химическое соединение из группы, включающей пероксиды. Впервые вещество было получено Луи Тенаром в 1818 году путем подкисления раствора перекиси бария азотной кислотой. Это сильный окислитель во многих химических реакциях, таких как окисление ракетного топлива (80%), мощное дезинфицирующее и отбеливающее средство.
Перекись водорода классифицируется как одна из активных форм кислорода. Химическая формула агента состоит из двух атомов водорода и двух атомов кислорода.
Благодаря этой структуре молекула под действием органических и неорганических веществ, тепла, света быстро разлагается с выделением атомарного кислорода.
Дезинфицирующее действие самой перекиси водорода довольно слабое, но при распаде, оно проявляется быстро и эффективно благодаря свободным атомам кислорода.

Химическая формула перекиси водорода, строение молекулы
Н-О-O-H-связи вокруг атомов кислорода в молекуле H2O2 расположены под углом (аналогично H-O-H-связям в воде), причем атомы H-O-O-H образуют двугранный угол (в твердой фазе около 90°).

Физические свойства пероксида
Чистый пероксид водорода сильно отличается от знакомого всем 3%раствора, который присутствует в каждой в домашней аптечке.
При комнатной температуре он является сиропообразной, бесцветной (концентрированная принимает бледно-голубой цвет), жидкостью с температурой замерзания -0,41 ° С и температурой кипения около 150 ° С. Вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды.
Хорошо растворяется в полярных (органических) растворителях и до любой концентрации — в воде. Имеет металлический привкус. Молярная масса 34,01 г/моль.
Химические свойства
Пероксид обладает сильными окислительными свойствами, возникающими в результате образования атомарного кислорода:
H2O2 → H2O + O
Чистая перекись водорода без стабилизаторов — очень нестабильна и подвергается экзотермическому разложению, часто взрывчатому. Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом.
- 2H2O2 → 2H2O + O2
- Подобное разложение катализируется многими веществами, например, серебром и платиной, оксидом марганца, соединениями йода:
- H2O2 + I → H2O + IO
- H2O2 + IO → H2O + I+ O2
- Эффективным ферментом, который расщепляет перекись водорода, является каталаза.
Благодаря тому, что пергидроль легко реагирует со многими металлами и разлагается при контакте со светом, его следует хранить в герметично закрытой таре, изготовленной из толстостенного полиэтилена или алюминия, не подвергаться воздействию дневного света и источников тепла. Его смесь с карбонатом гидрата натрия (Na2CO3 · 1,5H2O2) является относительно стабильной и безопасной в использовании.

Перекись водорода имеет слабые кислотные свойства. Слабее угольной кислоты. В водных растворах диссоциирует в соответствии с уравнением:
- Н2О2 = Н+ +ООН-
- В присутствии восстановителей пероксид водорода ведет себя как окислитель (O-I → O-II), например :
- 2 NH2OH + 6H2O2 → 2 HNO3 + 8H2O
- В присутствии окислителей пероксид показывает восстановительные свойства (O-I → O0), например, в реакции с перманганатом калия в кислых условиях :
- 2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
- или с солями серебра (I) в щелочной среде:
- 2AgNO3 + H2O2 + 2KOH → 2Ag + O2 + 2H2O + 2KNO3
Это агрессивное вещество для живых тканей. При контакте с кожей появляется белый цвет.
Получение — синтез пероксида водорода с использованием метода антрахинона.
В настоящее время hydrogen получают в промышленности методом антрахинона. путем окисления 2-этил-9,10-антрацендиола кислородным газом, прошедшим через раствор этого соединения в смеси подходящих растворителей. Перекись отделяют экстракцией воды и оставляют в растворе.
Этиллантрахинон регенерируют восстановлением газообразным водородом до 2-этил-9,10-антрацендиола, катализируемого палладием на подходящем носителе или соединениях никеля. В методах промышленного производства цикл обеих реакций (окисление и восстановление) осуществляется поочередно.
Разведенный водный раствор перекиси, полученный в этом процессе, концентрируют осторожным выпариванием воды при пониженном давлении, получая таким образом раствор с максимальной концентрацией 70%. Большая концентрация приводит к взрыву. Более концентрированные растворы и полностью чистый пероксид, может быть получен путем быстрого замораживания его из водного концентрированного раствора.
Интересные химические опыты с перекисью водорода — видео:
Водные растворы перекиси водорода и их применение
Перекись водорода в чистом виде не является коммерчески доступным веществом, поскольку законы большинства европейских стран и США запрещают его продажу по соображениям безопасности.
В торговле (максимум 70% растворов) это соединение доступно после соблюдения особых условий (правила RID и ADR), а наиболее распространенной коммерческой формой является пергидроль 30% водный раствор и 3-5% растворы для домашнего использования, называемые перекисью водорода.

Перекись в растворе 3-3,5% используется для дезинфекции ран, и такие растворы для непосредственного использования доступны в аптеках. H2O2 оказывает особенно сильное разрушающее действие на анаэробные бактерии (анаэробы).
Дезинфекция раны с использованием перекиси водорода значительно снижает риск попадания бактерий в организм через поврежденный эпидермис. Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению.
7-15% растворы обычно используются в качестве так называемых «Активных кислородных отбеливателей» в бытовой химии, 5% водный раствор используется для обесцвечивания волос. Очень разбавленные растворы (прибл. 1%) применяются в народной медицине для перорального применения. До сих пор считаются спорным способом лечения некоторых видов рака.
Источник: https://sodaperekis.ru/pergiddrol-himicheskaja-formula/
Формула водорода в химии
Атомная масса: 1,008 а.е.м.
Электронная формула водорода
Электронная формула: 1s1
Двойственное положение водорода в периодической системе объясняется тем, что он имеет определенное сходство как со щелочными металлами, так и с галогенами.
Подобно атомам щелочных металлов, атом водорода может отдать свой единственный электрон (окислиться) и превратиться в положительно заряженный и он Н +.
Подобно атомам галогенов, атом водорода может присоединить еще один электрон для получения устойчивой конфигурации благородного газа (гелия), т.е. восстановиться и превратиться в отрицательно заряженный ион Н–.
- Электроотрицательность водорода имеет промежуточное значение (2,1) между величинами электроотрицательностей типичных металлов и типичных неметаллов.
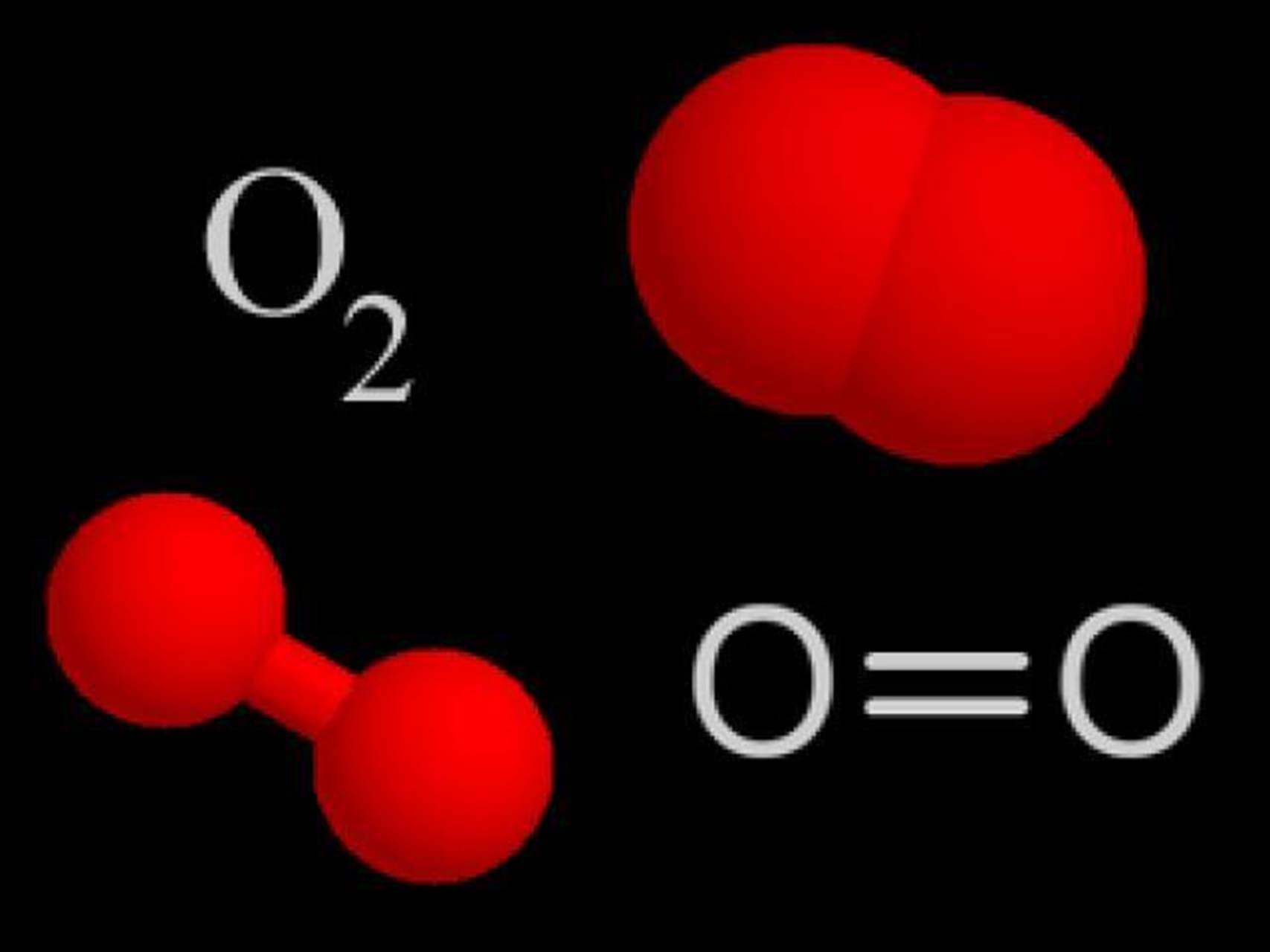
- Водород – простое вещество, состоящее из двух атомов водорода.
- Формула: H2.
Структурная формула водорода
Структурная формула:

При нормальных условиях водород – газ без цвета, вкуса и запаха. Самое легкое из известных веществ. Плотность водорода составляет 0,08987 г/л при нормальных условиях.
В природе водород существует в виде трёх изотопов, имеющих индивидуальные названия: 1H – протий (Н), 2Н – дейтерий (D), 3Н — тритий (T). Протий и дейтерий – стабильные изотопы, тритий – радиоактивный с периодом полураспада 12,32 лет.
Природный водород состоит из молекул H2 и HD в соотношении 3200:1. Содержание чистого D2 ещё меньше.
Физические и химические свойства изотопов водорода довольно сильно отличаются друг от друга, в отличие от изотопов других химических элементов. Это связано с тем, что добавление каждого дополнительного протона вызывает сильное относительное увеличение массы атома.
Водород является основной составной частью звёзд и межзвёздного газа. Доля атомов водорода во Вселенной составляет 88,6 %.
Массовая доля водорода в земной коре –1%. Однако доля его атомов составляет 17% (второе место после кислорода). Водород на Земле большей частью находится в виде соединений; только небольшой процент водорода в виде простого вещества содержится в воздухе (0,00005% по объёму).
Водород входит в состав подавляющего большинства органических соединений и присутствует во всех живых организмах. В живых клетках водород занимает первое место по числу атомов – на его долю приходится почти 63%.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-vodoroda/
Водород
Водород — первый элемент периодической системы элементов; обозначается символом H.
Простое вещество водород H2 (легкий водород, дипротий) — легкий бесцветный газ без запаха и вкуса; обладает, в особенности при повышенных температурах, сильным восстановительным действием.
Природный водород содержит изотоп 1H (протий) с примесью стабильного изотопа 2H (дейтерий D, преобладает) и радиоактивного изотопа 3H (тритий T, следы).
Физические свойства
| Молярная масса | H2 2,016 г/моль |
| Температура плавления, tпл. | -259,34 °C |
| Температура кипения, tкип. | -252,87 °C |
| Плотность, ρ | 0,082 г/дм3 |
Неметалл. Бесцветный трудносжижаемый газ. Очень мало растворяется в воде, лучше — в органических растворителях.
Хемосорбируется металлами (Fe, Ni, Pt, Pd).
Методы получения
Искать химические свойства и методы получения в базе химических реакций. Выпускающийся в стальных баллонах водород получают электролизом или из водяного газа.
Электролитический водород представляет собой газ 99,7-99,8%-ной чистоты, который в виде примеси содержит только воздух — и, в частности, кислород — в количестве, меньшем 0,1%. Этот газ пропускают при 400°С через трубку, наполненную восстановленным оксидом меди (в виде проволоки), или, по методу Мейера и Ронге, через башню с «активной медью», или при 30—50°С через колонку с восстановленным катализатором BTS фирмы BASF. Далее водород высушивают хлоридом кальция и пентаоксидом фосфора. Такой водород можно применять для большинства лабораторных целей, так как присутствие незначительного количества азота (около 0,2%) редко служит помехой.
Водород, полученный из водяного газа, содержит заметные количества примесей оксида углерода, диоксида углерода, кислорода и азота, а иногда также AsH3 и Fe(CO)5. Для поглощения диоксида углерода применяют гидроксид калия или натронную известь; AsH3 поглощают насыщенным раствором перманганата калия в присутствии избытка твердого KMnO4.
Для удаления кислорода газ пропускают, как это описано выше, над нагретой медью или раскаленным докрасна платинированным асбестом, причем одновременно происходит термическое разложение Fe(CO)5. Оксид углерода удаляется при пропускании газа через восстановленный BTS-катализатор, а также путем вымораживания жидким азотом.
Вообще для получения очень чистого водорода следует по возможности исходить из электролитического водорода.
Дальнейшую очистку водорода проводят, адсорбируя примеси на активном угле, силикагеле или молекулярных ситах. Для получения наиболее чистого, совершенно не содержащего воздуха, водорода используют следующие методы:
- Способ 1. Нагревание палладия, насыщенного водородом (см. ниже);
- Способ 2. Диффузия через палладий или сплав палладия с серебром (см. ниже);
- Способ 3. Диффузия через никель (см. ниже);
- Способ 4. Разложение гидрида урана(III);
- Способ 5. Разложение гидрида титана;
- Способ 6. Электролиз без доступа воздуха.
Нагревание палладия, насыщенного водородом
Губку палладия, полученную путем восстановления дихлорида палладия в растворе, тщательно промывают горячей водой и после высушивания сильно прокаливают в пламени паяльной горелки. Еще в горячем состоянии губку помещают в нагретую трубку с присоединенным к ней манометром и медленно охлаждают в вакууме.
Затем при комнатной температуре через трубку пропускают поток тщательно очищенного и высушенного водорода. Поглощение палладием водорода сопровождается слабым раскаливанием. Путем последующего нагревания до 200°C поглощенный водород можно снова выделить, причем при слабом отсасывании ею насосом получается равномерный поток очень чистого газа.
Количество выделившегося водорода составляет при нормальных условиях около 100 мл/г палладия.
Диффузия через палладий или сплав палладия с серебром

Рис. Разрез электролизера для получения водорода высокой чистоты путем электролиза поды с последующей диффузией через сплав палладий-серебро. 1 — стеклянный цилиндр (диаметр 10 см);
2 — концентрические платиновые аноды;
3 — диффузионные трубки из сплава палладий-серебро (100 штук), нижние концы которых закреплены путем припайки золотом к платиновой пластине 4;
5 — тефлоновое уплотнение;
6 — основание в виде стальной плиты;
7 — трубка для отвода водорода высокой чистоты.
Метод диффузии при повышенной температуре через металлический палладий или его сплавы с серебром в основном используется в технике для непрерывного получения больших количеств очень чистого водорода.
Получение водорода в лабораторных условиях удобно осуществлять в приборе для электролиза и диффузии, устройство которого показано на рис. Прибор заполняется разбавленной серной кислотой и работает при температуре 70°С и плотности тока 2 А/см2.
Между двумя анодами из платины находятся 100 трубок из сплава палладия с серебром (25% Ag), служащие катодами. Наружный диаметр трубок равен 1,6 мм при толщине стенок 7,6·10-2 мм.
Прибор работает на постоянном токе (выпрямитель) и дает 2 л водорода в минуту при содержании примесей менее 1 млн-1. Прибор прост в эксплуатации, поскольку не требует дополнительного подогрева, и для его заправки необходима только дистиллированная вода.
Диффузия через никель
Очистку поступающего в продажу водорода проводят в приборе, схема/ которого показана на рис. 98. Прибор позволяет получить поток очень чистого водорода при атмосферном давлении.
Пять цельнотянутых никелевых трубок диаметром 2 мм, с толщиной стенок 0,1 мм и длиной 5 м, изогнутых в виде спиралей, одним концом впаиваются в латунную головку, оканчивающуюся нормальным шлифом. Для того чтобы трубки было легче вставлять в головку, их в течение 2 ч нагревают до 1000°С в атмосфере водорода, после чего их можно легко гнуть руками.
Другие концы трубок запаивают наглухо. Никелевые спирали помещают в кварцевую трубку диаметром 35 мм и длиной 1 м. Латунные головки приклеивают на пиценне.
 Рис. Конструкция прибора для очистки водорода путем его диффузии через никель. В головке с нормальным шлифом имеется игольчатый вентиль, служащий для тонкой регулировки избыточного давления и выжигания примесей, накапливающихся в кварцевой трубке. В головке на другом конце кварцевой трубки подсоединен ртутный манометр. Нагревание кварцевой трубки производят только в ее центре так, чтобы места припаивания никелевых трубок не нагревались. В зависимости от режима работы прибора его производительность (мл/мин) изменяется следующим образом:
Рис. Конструкция прибора для очистки водорода путем его диффузии через никель. В головке с нормальным шлифом имеется игольчатый вентиль, служащий для тонкой регулировки избыточного давления и выжигания примесей, накапливающихся в кварцевой трубке. В головке на другом конце кварцевой трубки подсоединен ртутный манометр. Нагревание кварцевой трубки производят только в ее центре так, чтобы места припаивания никелевых трубок не нагревались. В зависимости от режима работы прибора его производительность (мл/мин) изменяется следующим образом:
| Температура, °C | Избыточное давление, мм рт. ст. | |||
| 15 | 20 | 25 | 30 | |
| 750 | 20 | 27 | 34 | 41 |
| 815 | 27 | 36 | 43 | 52 |
| 860 | 34 | 45 | 55 | 68 |
| 900 | 41 | 54 | 68 | 84 |
Скорость подачи газа пропорциональна величине избыточного давления, тогда как зависимость от температуры не является линейной. Путем изменения давления скорость подачи может быть практически моментально отрегулирована до нужного уровня. При наличии хорошего вентиля на баллоне с водородом аппаратура работает без сбоев. Продолжительность непрерывной работы составляет не менее 250 ч. Перед каждым новым опытом следует убедиться в герметичности аппаратуры.
Химические свойства
Искать химические свойства и методы получения в базе химических реакций.
Сильный восстановитель. При повышенных температурах, реагирует с металлами, неметаллами, оксидами металлов. Особенно высока восстановительная способность у атомного водорода H0. образующегося при термическом разложении молекулярного водорода H2 или в результате реакций непосредственно в зоне проведения восстановительного процесса. Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. — Мн.: Современная школа, 2005. — 608 с ISBN 985-6751-04-7. [c. 151]
- M. Баудлер, Г. Брауэр, Ф. Губер, В. Квасник, П.В. Шенк, М. Шмайсер, Р. Штойдель. Руководство по неорганическому синтезу: В 6-ти томах. Т.1. Пер. с. нем./Под ред. Г. Брауэра. — М.: Мир, 1985. — 320 с., ил. [с. 147-152]
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд. испр./Р.А. Лидин, В.А. Молочко, Л.Л Андреева; Под ред. Р.А. Лидина. — М.: Химия, 2000. 480 с. ил. ISBN 5-7245-1163-0
Источник: https://chemiday.com/ru/encyclopedia/h2
Водород. Получение водорода
Водород замечателен уже тем, что он открывает таблицу Менделеева.
Это самый простой химический элемент, ядро которого состоит из одного протона, и вокруг этого ядра вращается один электрон.
А вот нейтронов в ядре водорода нет, и это ещё одна уникальная особенность водорода: это единственный стабильный элемент без нейтронов.
Обратите внимание, что сейчас мы говорим о протии, изотопе водорода, самом распространённом в природе. Но у водорода существуют ещё два хорошо изученных изотопа: дейтерий и тритий. Дейтерий часто называют «тяжёлым водородом», его ядро состоит из одного протона, одного нейтрона, а вокруг ядра вращается один электрон.
Тритий, именуемый «сверхтяжёлый водород», имеет ядро из протона и двух нейтронов, вокруг которого вращается один электрон.
youtube.ru
Водород – это самый распространённый во Вселенной элемент, он входит в состав вещества звёзд и межзвёздного газа. На Земле водорода тоже очень много, ведь он присутствует во всех живых клетках, да и во всех органических веществах.
В обычных условиях водород – это газ, не имеющий цвета и запаха.
Формула водорода Н2, он легче воздуха и воды, в воде растворяется плохо.
Работая с водородом, нужно быть внимательным, поскольку в смеси с кислородом или он становится горючим и даже взрывоопасным. Такая смесь называется гремучим газом, она может воспламениться от небольшой искры и сгорает моментально.
Получение водорода
- В промышленности водород получают, пропуская раскалённый водяной пар над углём, при этом протекает такая реакция:
- Н2О + С = СО + Н2
- Ещё один промышленный способ получения водорода – электролиз воды, при котором вода под действие электрического тока разлагается на кислород и водород:
- 2Н2О = 2Н2 + О2
В лаборатории водород получают иначе. Самый удобный способ – взаимодействие металлов с кислотами. При этом протекает реакция замещения, в результате которой образуются соль и газообразный водород. Чаще всего используется цинк и соляная кислота:
- Zn + 2HCl = ZnCl2 + Н2
- А вот Генри Кавендиш, английский химик, который первым описал водород, хотя и не дал ему названия, получал его, обрабатывая железо серной кислотой:
- Fe + H2SO4 = FeSO4 + Н2
- Другой способ – провести реакцию между кальцием и водой. При этом образуется гидроксид кальция и водород:
- Са + 2Н2О = Са(ОН)2 + Н2
Пишите, пожалуйста, в х, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник: https://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/5c8a638c7951ff00b405b6b2
Водород как химический элемент — Основы химии на Ида Тен
Водород – первый химический элемент Периодической Системы химических элементов Д.И. Менделеева. Химический элемент водород расположен в первой группе, главной подгруппе, первом периоде Периодической Системы.
Относительная атомная масса водорода = 1.
Водород имеет наиболее простое строение атома, он состоит из единственного электрона, который находится в околоядерном пространстве. Ядро атома водорода состоит из одного протона. Атом водорода, в химических реакциях может как отдавать, так и присоединять электрон, образуя два вида ионов:
H0 + 1ē → H1 − H0 – 1ē → H1+.
Водород – самый распространённый элемент во Вселенной. На его долю приходится около 88,6% всех атомов (около 11,3% составляют атомы гелия, доля всех остальных вместе взятых элементов – порядка 0,1%).
Таким образом, водород – основная составная часть звёзд и межзвёздного газа.
В межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Массовая доля водорода в земной коре составляет 1%.
Это девятый по распространённости элемент. Значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках.
Физические свойства водорода
Простое вещество, образованное химическим элементом водородом, имеет молекулярное строение. Его состав отвечает формуле Н2. Как и химический элемент, простое вещество также называют водородом.
Водород – бесцветный газ без запаха и вкуса, практически нерастворим в воде. При комнатной температуре и нормальном атмосферном давлении растворимость составляет 18,8 мл газа на 1 л воды.
Водород – самый легкий газ, его плотность составляет 0,08987 г/л. Для сравнения: плотность воздуха равна 1,3 г/л.
Водород способен растворяться в металлах, так например, в одном объеме палладия может раствориться до 850 объемов водорода. Из-за крайне малого размера молекул водород способен к диффузии через многие материалы Подобно другим газам водород при низких температурах конденсируется в бесцветную прозрачную жидкость, это происходит при температуре –252,8°С.
При достижении температуры –259,2°С водород кристаллизуется в виде белых кристаллов, похожих на снег. В отличие от кислорода, для водорода не характерна аллотропия
Применение водорода
Водород используют в различных отраслях промышленности. Много водорода уходит на производство аммиака (NH3). Из аммиака получают азотные удобрения, синтетические волокна и пластмассы, лекарства.
В пищевой промышленности водород используют при производстве маргарина, в состав которого входят твердые жиры. Чтобы их получить из жидких жиров, через них пропускают водород. Когда водород горит в кислороде, то температура пламени составляет около 2500°C.
При такой температуре можно плавить и сваривать тугоплавкие металлы. Таким образом, водород используется при сварке.
Смесь жидких водорода и кислорода применяют как ракетное топливо.
В настоящее время в ряде стран начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород.
При сгорании водорода в кислороде образуется экологически чистый продукт – вода, а не углекислый газ, вызывающий парниковый эффект. Ученые предполагают, что в середине XXI века должно быть начато серийное производство автомобилей на водороде.
Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
В конце XIX – начале ХХ веков, на заре эры воздухоплавания, водородом заполняли воздушные шары, дирижабли и аэростаты, так как он намного легче воздуха. Однако эпоха дирижаблей начала стремительно уходить в прошлое после катастрофы, случившейся с дирижаблем Гинденбург.
6 мая 1937 года дирижабль, заполненный водородом, загорелся, что повлекло за собой гибель десятков его пассажиров. Водород крайне взрывоопасен в определенной пропорции с кислородом. Несоблюдение правил техники безопасности и привело к воспламенению и взрыву дирижабля.
Итог статьи:
- Водород – первый химический элемент Периодической Системы химических элементов Д.И. Менделеева
- Водород расположен в I группе, главной подгруппе, 1 периоде Периодической Системы
- Валентность водорода в соединениях – I
- Водород – бесцветный газ без запаха и вкуса, практически нерастворим в воде
- Водород – самый легкий газ
- При низких температурах получают жидкий и твердый водород
- Водород способен растворяться в металлах
- Сферы применения водорода разнообразны
Источник: https://idaten.ru/chemistry/vodorod-kak-himicheskii-element
Водород
Продажа
Производство
Доставкамарка 4.6марка 5.0марка 6.0марка 7.0технический марка «Б»технический марка «В»чистый I сорттехнический марка «А»технический марка «Б»технический марка «В»
Водород (лат.
Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, платине.
История
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом».
При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом.
Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии сломоносовским «кислородом».
Распространённость
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа.
В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %).
Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы.
В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество.
Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода.
Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности
- 1.Электролиз водных растворов солей:
- 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
- 2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
- H2O + C ? H2 + CO
3.Из природного газа.
- Конверсия с водяным паром:
- CH4 + H2O ? CO + 3H2 (1000 °C)
- Каталитическое окисление кислородом:
- 2CH4 + O2 ? 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
- Zn + 2HCl → ZnCl2 + H2↑
- 2.Взаимодействие кальция с водой:
- Ca + 2H2O → Ca(OH)2 + H2↑
- 3.Гидролиз гидридов:
- NaH + H2O → NaOH + H2↑
- 4.Действие щелочей на цинк или алюминий:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
- Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
Физические свойства
Водород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип.
−252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1.
Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25).
Без катализатора превращение происходит медленно (в условиях межзвездной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре.
Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому.
Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.
), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация).
Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз).
Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии,пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10−22 — 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
|
|
|
|
|
| H2 | 13.96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| D | 16,65 | 22,13 | 16,60 / 12,8 | 35,91 / 1,48 | 114,80 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,310 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,230 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
- Доля диссоциировавших молекул водорода
- Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 = 2Н − 432 кДж
- Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca + Н2 = СаН2
- и с единственным неметаллом — фтором, образуя фтороводород:
- F2 + H2 = 2HF
- С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 + 2Н2 = 2Н2О
- Он может «отнимать» кислород от некоторых оксидов, например:
- CuO + Н2 = Cu + Н2O
- Записанное уравнение отражает восстановительные свойства водорода.
- N2 + 3H2 → 2NH3
- С галогенами образует галогеноводороды:
- F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
- С сажей взаимодействует при сильном нагревании:
- C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
- При взаимодействии с активными металлами водород образует гидриды:
- 2Na + H2 → 2NaH
- Ca + H2 → CaH2
- Mg + H2 → MgH2
- Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
- Оксиды восстанавливаются до металлов:
- CuO + H2 → Cu + H2O
- Fe2O3 + 3H2 → 2Fe + 3H2O
- WO3 + 3H2 → W + 3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
- На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
- Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
- В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водородпожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75(74) % объёмных.
Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг.
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
- При производстве аммиака, метанола, мыла и пластмасс
- При производстве маргарина из жидких растительных масел
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Пищевая промышленность
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколькокатастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
«Жидкий водород»
Источник: https://tgko.ru/spravka/gaz/vodorod




