В этом уроке вы узнаете про «мать всех металлов» – серу, чем она вредна и чем полезна, как между собой связаны Чёрное море и тухлые яйца, как правильно разбавлять электролит для аккумулятора и ещё много полезного и интересного.


Сера – химический элемент главной подгруппы VI группы периодической системы элементов.
Эту подгруппу ещё называют халькогены. Название это произошло от двух греческих слов – «халькос», что в разных переводах значит «медь» или «руда», и «генос» – «рождаю».
- Кислород и сера – это элементы, которые входят в состав многих руд металлов.
- Русское слово «сера» восходит к старославянским корням, которые обозначали горючие вещества, смолы.
- Латинское sulfur скорее всего произошло от индоевропейского swelp– «гореть».
- Сера с древних времён использовалась жрецами храмов при проведении обрядов – она считалась произведением существ из мира духов.
- Ещё в Древней Греции сера использовалась в военных действиях – она входила в состав знаменитого «греческого огня».

- Алхимики считали серу отцом всех металлов – и теперь мы с вами знаем причину: большинство металлических руд представляют собой именно сульфиды.
- На внешнем электронном слое серы шесть электронов, из них два – неспаренных, поэтому сера может принимать два электрона, проявляя степень окисления –2, выступая окислителем.
- Но за счёт распаривания остальных четырех электронов на 3d-подуровень максимальная степень окисления серы в соединениях с более сильными окислителями (фтором, кислородом, хлором) +6.
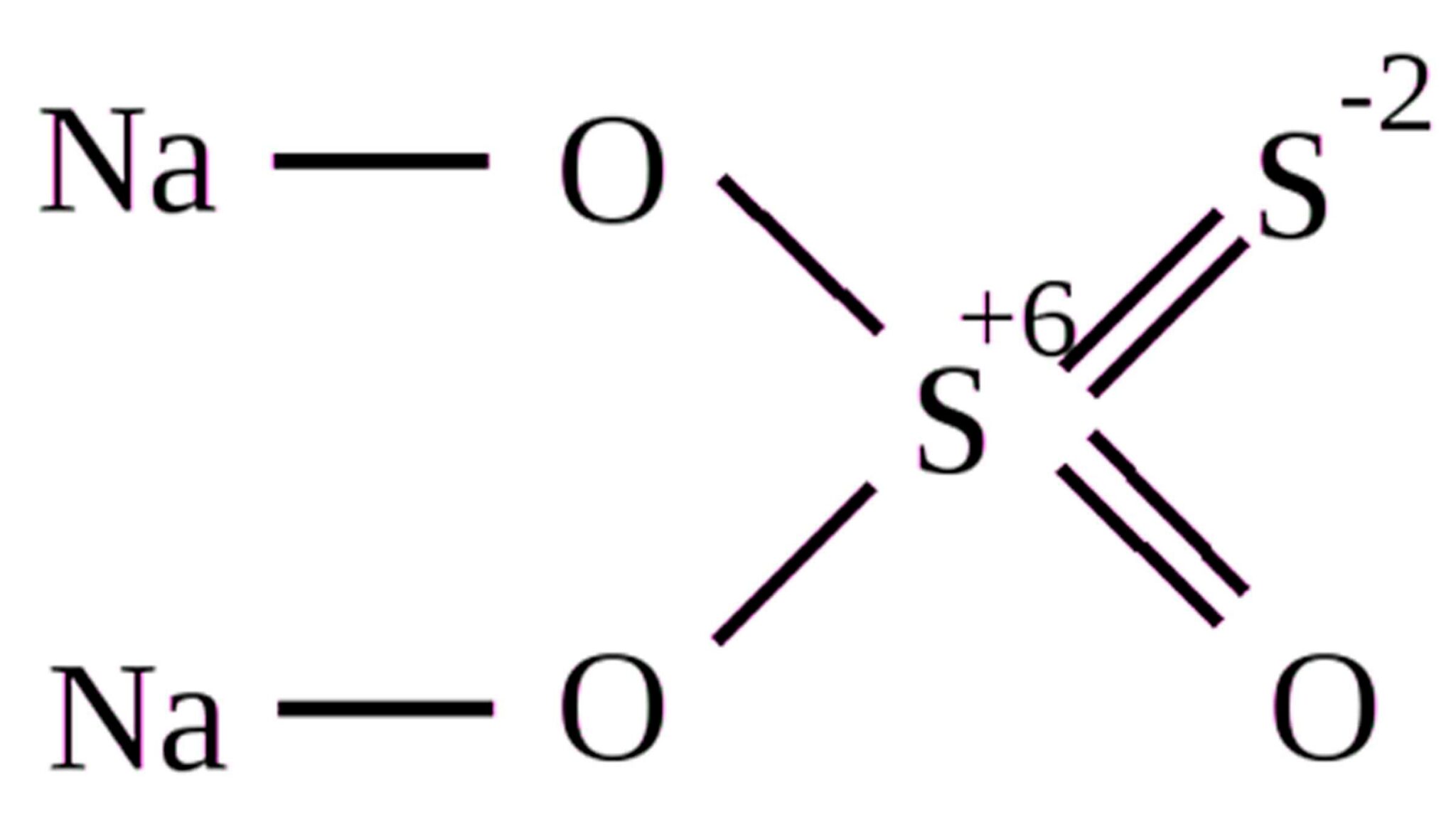
- Химически сера очень активна, но всё же встречается в природе в виде простого вещества (самородная сера).
- Основной источник самородной серы – вулканический пепел и горные породы вулканического происхождения.
- В большинстве случаев сера в природе встречается в виде соединений:
- пирит (железный колчедан) FeS2
- медный блеск CuS
- цинковая обманка ZnS
- гипс CaS04
- киноварь HgS

Сера образует три простых вещества (аллотропные модификации):
- ромбическую
- моноклинную
- пластическую
Ромбическая сера
Наиболее устойчивая, хрупкое вещество желтого цвета.
Это именно та сера, которую мы все привыкли видеть. Сера часто встречается в домашних аптечках (применяется как пищевая добавка, а также как наружное средство при лечении кожных заболеваний), а также она используется в сельском хозяйстве для окуривания растений от паразитов и грибков.
- Моноклинная сера
- Менее устойчивая модификация, образуется при медленном охлаждении расплавленной серы.
- Пластическая сера
- Неустойчива, получить её можно, если расплавленную серу охладить резко (например, вылить в холодную воду).
- Моноклинная и пластическая модификации с течением времени самопроизвольно переходят в ромбическую.
У меня есть дополнительная информация к этой части урока!
Закрыть
Аллотро́пия (от греческого аллос «другой» и тропос «поворот, свойство») — существование веществ одного и того же химического элемента, различных по строению и свойствам, так называемых аллотропных модификаций или форм.
Явление аллотропии обусловлено различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).

- Сера – активный неметалл.
- В химических реакциях она может быть как окислителем, так и восстановителем.
- Окислителем сера выступает в реакциях с металлами, водородом и некоторыми неметаллами.
- При комнатной температуре сера реагирует со всеми щелочными и щёлочно-земельными металлами, ртутью, медью, серебром, образуя сульфиды:

- Эту реакцию используют в лабораториях для удаления разлитой ртути, пары которой очень токсичны.
- Щели, в которые могла попасть разлитая ртуть, посыпают порошком серы.
- С серебром способна реагировать не только сера, но и сероводород в присутствии кислорода воздуха, образуя черный налет сульфида серебра:

- Хотя с химической точки зрения в данной реакции окислителем является не сера, а кислород.
- Человеческий пот содержит небольшое количество сероводорода (продукт разложения белков, в которых содержится сера).
- Именно поэтому серебряные украшения со временем чернеют.
- С большинством металлов и водородом сера реагирует при нагревании.
- Сера является окислителем по отношению к углероду и фосфору, проявляя степень окисления –2, а восстановителем – по отношению ко фтору, кислороду, хлору, проявляя степень окисления +4 и +6.
- Многие соединения серы с неметаллами токсичны.
- Интересен фторид серы SF6 , называемый элегаз, – тяжелый газ без цвета и без запаха, почти не токсичный из-за большой химической устойчивости.
Источник: https://ladle.ru/education/himia/8class/sera
ПОИСК
Соединения со степенью окисления водорода —1 [c.290]
Гидриды неметаллов. Соединения неметаллических элементов с водородом, в которых степень окисления водорода -f-I, называют гидридами неметаллов. Гидриды многих неметаллов газообразны, имеют ковалентный тип связей в молекулах.
В подгруппах периодической системы с увеличением порядкового номера элемента стандартная энергия Гиббс-а образования гидридов неметаллов возрастает (рис. 79). Следовательно, уменьшаются химическое сродство между водородом и неметаллическими элементами и устойчивость молекул гидридов.
Из гидридов галогенов — галогеноводородов — наиболее устойчивы молекулы HF, заметная диссоциация которых на атомы не наблюда- [c.236]
Таким образом, водород — неметаллический элемент. В соединениях 04 может иметь степени окисления —1 и +1- Для него, как и для галогенов, характерны ионные соединения, в которых он выступает в качестве простого аниона Н . При положительной степени окисления водород образует только ковалентные соединения и может играть роль комплексообразователя в анионных комплексах. [c.273]
Соединения со степенью окисления водорода —1. В зависимости от природы связанного с ним элемента атомы водорода в соединениях могут быть поляризованы положительно (степень окисления 1) или отрицательно (степень окисления —1) [c.275]
Водород образует с другими р-элементами ковалентные соединения, формально не относящиеся к гидридам СН4, NH3, РНз, Н2О, H2S, НС1 и др.
По физическим свойствам они при условиях, близких к нормальным, являются газами или легко испаряющимися жидкостями, поэтому иногда называются летучими гидридами.
В этих соединениях степень окисления водорода -1-1, а характер химической связи меняется от малополярной ковалентной до полярной ковалентной. [c.344]
Водород — неметаллический элемент. Он образует ковалентные соединения (степень окисления водорода положительная) и ионные соединения, содержащие ани- [c.373]
У Кислоты и основания. Как мы видели, ионизация соединений со / степенью окисления водорода +1 в жидком состоянии происходит с образованием сольватированных положительного и отрицательного ионов [c.132]
Учитывая, что сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе — заряду иона, можно вычислить степень окисления атомов в сложных соединениях. Определим степень окисления серы в НаЗОз.
Степень окисления водорода в этом соединении (+1), кислорода (—2). Сумма всех степеней окисления должна быть равна нулю, поэтому, обозначив степень окисления серы через л и умножив известные нам [c.
317]
В соединениях с активными металлами (например, Li, Ыя, Са) степень окисления водорода равна —1. Эти соединения (гидриды металлов) при обычных условиях представляют собой твердые вещества. [c.129]
В соединениях неметаллов, ие включающих водород и кислород, неметалл с большей электроотрицательностью считается отрицательно заряженным. Степень окисления такого неметалла полагается равной заряду его наиболее распространенного отрицательного иона. Например, в I4 степень окисления хлора — 1, а углерода + 4. В СН4 степень окисления водорода + 1, а углерода — 4, В SF степень окисления фтора — 1, а серы + 6, но в S2 степень окисления серы — 2, а степень окисления углерода -I- 4. В молекулах типа N4S4 с ковалентными связями (где соединяющиеся атомы имеют близкие или совпадаюшие электроотрицательности) понятие степени окисления теряет смысл. [c.416]
Степень окисления водорода в соединениях с неметаллами (Н2О, НгЗ и т. д.) всегда равна +1. Химическая связь между атомами в молекулах ковалентная полярная. [c.256]
Степень окисления водорода в соединениях с металлами (ЫаН, КН и др.) равна —1. Гидриды металлов могут быть ионными, металлическими и ковалентными. [c.256]
Водород в соединениях с неметалла ли имеет степень окисления +1, а в солеобразных гидридах (СаНг, НаН и т. д.) степень окисления водорода равна — 1. [c.136]
Водородные соединения щелочных металлов отвечают формуле RH. Это гидриды металлов — белые кристаллические вещества. В гидридах степень окисления водорода равна —1. [c.169]
Водород во всех соединениях имеет степень окисления -j-1. Исключением являются гидриды, где степень окисления водорода равна —1. [c.18]
Среди водородных соединений азота наименьшая отрицательная степень окисления азота представлена в азиде водорода ННз. В этом соединении степень окисления азота равна —1/3. Необычная степень окисления азота обусловлена структурной неравноценностью атомов азота в этом веществе. С позиций МВС эта структур- [c.253]
Сумма всех степеней окисления в соединении должна быть равна нулю, поэтому, обозначив степень окисления фосфора через х и умножив известные степени окисления водорода (+1) и кислорода (—2) на число их атомов в соединении, составим уравнение (+1)3-]- +(—2)4—0. Из этого уравнения найдем, что л =+5. [c.64]
В любом соединении каждому атому может быть приписана степень окисления. Так, для фтора во всех его соединениях степень окисления равна —1, для кислорода —2 (только в ОРг степень окисления кислорода +2, а в пероксидах она равна —1).
Для водорода наиболее характерна степень окисления -(-1, но встречается и —1 (в гидридах металлов). Степень окисления молекул простых веществ, а также атомов элементов равна нулю, а одноатомных ионов —их заряду.
Во всех соединениях щелочные металлы имеют степень окисления -Ь1, а щелочноземельные -Ь2. [c.145]
При высокой температуре водород соединяется с щелочными и щелочноземельными металлами, образуя белые кристаллические вещества — гидриды металлов (Ь Н, ЫаН, КН, СаНг и др.). В этих соединениях металл имеет положительную степень окисления, водород— отрицательную. [c.163]
Что образуется при взаимодействии водорода со щелочными и щелочноземельными металлами Какова степень окисления водорода в образующихся соединениях [c.338]
Степень окисления водорода в соединениях с металлами — 1, что соответствует способности атома водорода присоединять экзотермически один электрон [c.20]
Во всех соединениях степень окисления водорода равна 4-1, за исключением гидридов металлов, например NaH. aHj, в которых она равна —1.
Кислород в подавляющем большинстве соединений имеет степень окисления —2, но, например, в соединении с фтором степень окисления кислорода равна +2, так как у фтора она всегда равна —I.
В пероксидах, например в NaaOa, степень окисления кислорода равна —1, потому что атомы натрия имеют степень окисления +1 и на два атома натрия приходится два атома кислорода. У одноатомных ионов степень окисления равна заряду иона К +1, Ва + +2, А1 ++3, С1-—1, 5= -—2. [c.78]
Водород во всех соединениях, кроме гидридов металлов (NaH, СаНг и др.), имеет степень окисленияЧ-1 в гидридах металлов степень окисления водорода равна —1. [c.78]
Степень окисления водорода в любом неионном соединении равна -1- 1. Это правило применимо к подавляюшему большинству соединений водорода, таких, как HjO, NH3 или СН4. Для ионных гидридов металлов, например NaH, степень окисления водорода — 1. [c.416]
Соединения водорода. По значению своей электроотрицательности водород близок к фосфору (см. табл. 4.2). Поэтому следовало бы ожидать образования гидридов (соединений со степенью окисления водорода -1) многих металлов, кремния и бора.
На самом деле известны солеобразные гидриды для щелочных и щелочноземельных элементов (твердые LiH, СаНг и др.), ковалентные (газообразные SiH4, ВгНе) и металлоподобные.
В последнем случае еще не ясно, являются ли они индивидуальными соединениями d- и /-элементов с водородом, или это твердые растворы. [c.344]
Для нахождения степеней окисления руководствуются следующими правилами 1) степень окисления атомов в простых веществах равна нулю 2) в молекулах алгебраическая сумма степеней окисления атомов с учетом их числа равна нулю, для ионов эта сумма равна заряду иона 3) степень окисления щелочных металлов всегда равна -1 4) водород во всех соединениях, кроме гидридов (солеподобных соединений активных металлов ЫаН, СаНа и др.), имеет степень окисления +1, в гидридах степень окисления водорода равна -1 5) степень окисления кислорода равна -2. Исключение составляют пероксиды — соединения, содержащие группу -0-0-, где степень окисления кислорода -1, и некоторые другие вещества (надперокси- [c.48]
Бинарные соединения называют по более электроотрицательному элементу с добавлением окончания ид , а в формулах символ этого элемента ставят на второе место. Бинарные соединения самого электроотрицательного элемента фтора являются только фторидами.
Водород может иметь в соединениях степень окисления +1 и —1. Бинарные соединения первого типа являются для водорода более характерными и относятся к основным классам НГал, HjO, H3N (привычная формула NH3) и др.
Метан СН4 — представитель основного класса органических соединений — алканов, но может быть отнесен также и к неосновны.м классам неорганических соединений, таких, как карбид водорода. Бинарные соединения второго типа — гидриды— образуются водородом с менее электроотрицательными элементами.
При близких значениях электроотрицательности положительная или отрицательная поляризация во- [c.61]
Большинство элементов могут проявлять разную степень окисления в соединениях.
При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах — заряду этих ионов.
В качестве примера рассчитаем степень окисления азота в соединениях KNO2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна +1, а степень окисления кислорода — (—2). Соответственно степень окисления азота равна [c.179]
Труднее найти степень окисления в соединении, где неизвестна степень окисления ни одного из атомов, например в сульфиде мышьяка AS2S3. В этом случае следует подумать, какой кислоте соответствует это соединение.
Очевидно, сероводородной кислоте H2S, где степень окисления водорода известна и равна (+1), а серы (—2). Следовательно, в сульфиде мышьяка степень окисления мышьяка 2д +(—2)3=0 равна (+3).
Так же формально вычисляется степень окисления и в органических соединениях. [c.318]
В качестве примера определим степень окисления серы в соединениях НгЗОз и Н2304. В НгЗОз степень окисления водорода + 1, кислорода —2. Тогда степень окисления серы (л ) определится из уравнения (+1) 2+л +(—2)-3 = 0, откуда х=- -4. [c.145]
Степени окисления элементов. Классы неорганических соединений. Номенклатура. Составление эмпирических формул и образование названий химических соединений основано на знании и правильном использовании степеней окисления элементов .
Если допустить, что химические соединения состоят из ионов, то степень окисления показывает заряд иона, входящего в соединение. На самом деле чисто ионные соединения практически не существуют, поэтому степень окисления представляет собой величину условную, формальную.
При определении степени окисления исходят из того, что в соединениях, как правило, степень окисления водорода +1, а кислорода —2.
Исключением являются гидриды активных металлов (ЫаН или СаНг), в которых водород имеет степень окисления —1, пероксид водорода и его производные (Н2О2 или Ва02), где кислород имеет степень окисления —1, а также фторид кислорода ОРг, степень окисления кислорода в котором равна +2. [c.25]
Источник: https://www.chem21.info/info/1484801/
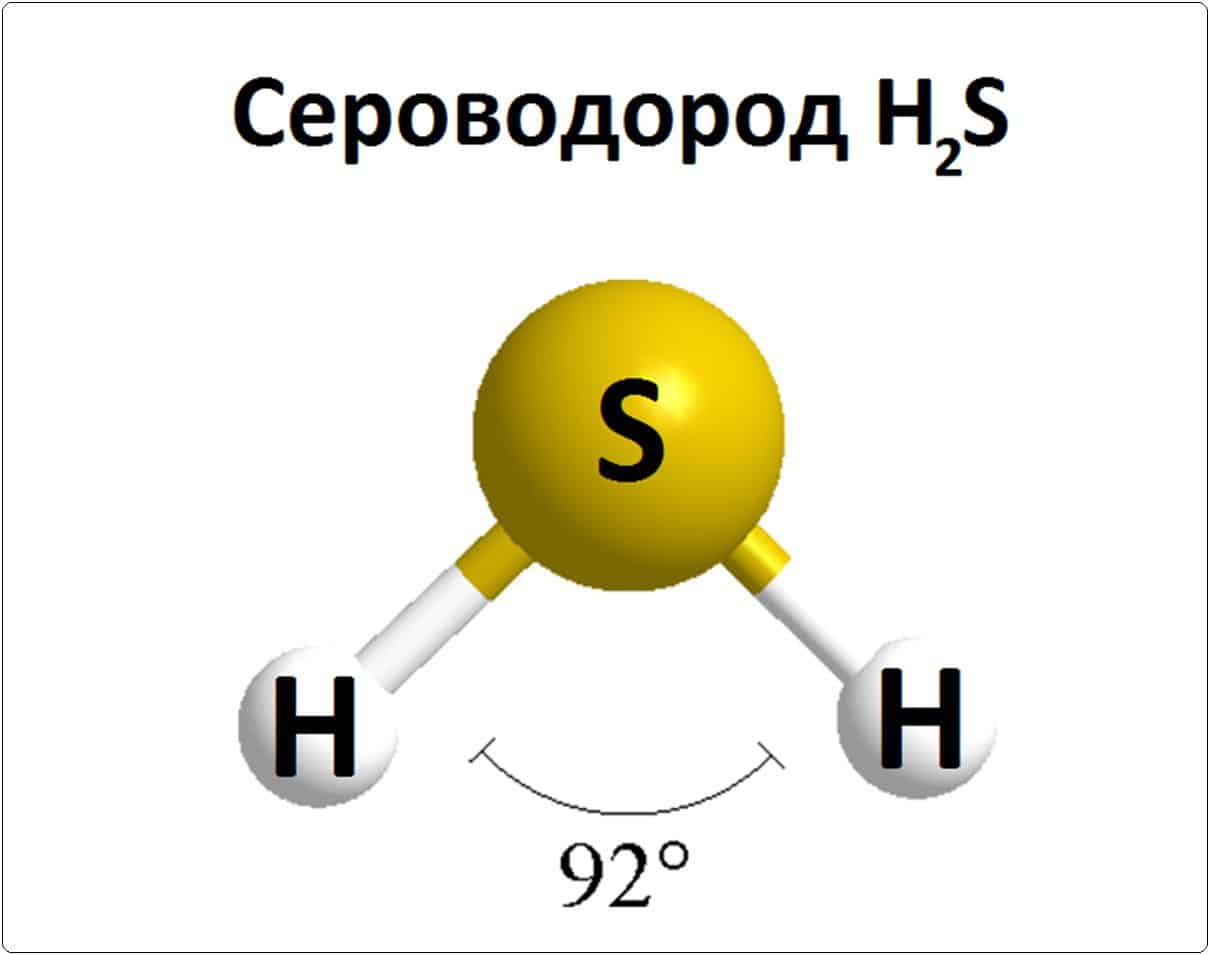
Сероводород
Сероводород (H₂S) представляет собой бесцветный газ c запахом тухлых яиц. По плотности он тяжелее водорода. Сероводород смертельно ядовит для человека и животных.
Даже незначительное его содержание в воздухе вызывает головокружение и тошноту, но самым страшным является то, что при длительном его вдыхании этот запах уже не ощущается.
Однако при отравлении сероводородом существует простое противоядие: следует завернуть в платок кусок хлорной извести, затем смочить, и какое-то время нюхать этот сверток.
Сероводород получают путем взаимодействия серы с водородом при температуре 350 °С:
H₂ + S → H₂S↑
Это окислительно-восстановительная реакция: в ходе нее изменяются степени окисления участвующих в ней элементов.
В лабораторных условиях сероводород получают воздействием на сульфид железа серной или соляной кислоты:
FeS + 2HCl → FeCl₂ + H₂S
Это реакция обмена: в ней взаимодействующие вещества обмениваются своими ионами. Данный процесс обычно проводят с помощью аппарата Киппа.
- При горении сероводорода образуется оксид серы 4 и водяной пар:
- 2H₂S + 3О₂ → 2Н₂О + 2SO₂
- H₂S горит голубоватым пламенем, а если над ним подержать перевернутый химический стакан, то на его стенках появится прозрачный конденсат (вода).
- Однако при незначительном понижении температуры данная реакция проходит несколько иначе: на стенках предварительно охлажденного стакана появится уже желтоватый налет свободной серы:
- 2H₂S + О₂ → 2Н₂О + 2S
- На этой реакции основан промышленный способ получения серы.
- При поджигании предварительно подготовленной газообразной смеси сероводорода и кислорода происходит взрыв.
- Реакция сероводорода и оксида серы(IV) также позволяет получить свободную серу:
- 2H₂S + SО₂ → 2Н₂О + 3S
Сероводород растворим в воде, причем три объема этого газа могут раствориться в одном объеме воды, образуя слабую и нестойкую сероводородную кислоту (Н₂S). Эту кислоту также называют сероводородной водой. Как видите, формулы газа-сероводорода и сероводородной кислоты записываются одинаково.
Если к сероводородной кислоте прилить раствор соли свинца, выпадет черный осадок сульфида свинца:
H₂S + Pb(NO₃)₂ → PbS + 2HNO₃
Это качественная реакция для обнаружения сероводорода. Она же демонстрирует способность сероводородной кислоты вступать в реакции обмена с растворами солей.
Таким образом, любая растворимая соль свинца является реактивом на сероводород.
Некоторые другие сульфиды металлов также имеют характерную окраску, например: сульфид цинка ZnS — белую, сульфид кадмия CdS — желтую, сульфид меди CuS — черную, сульфид сурьмы Sb₂S₃ — красную.
- Кстати, сероводород является нестойким газом и при нагревании практически полностью разлагается на водород и свободную серу:
- H₂S → Н₂ + S
- Сероводород интенсивно взаимодействует с водными растворами галогенов:
- H₂S + 4Cl₂ + 4H₂O→ H₂SO₄ + 8HCl
Сероводород в природе и жизнедеятельности человека
Сероводород входит в состав вулканических газов, природного газа и газов, сопутствующих месторождениям нефти. Много его и в природных минеральных водах, например, в Черном море он залегает на глубине от 150 метров и ниже.
Сероводород применяют:
- в медицине (лечение сероводородными ваннами и минеральными водами);
- в промышленности (получение серы, серной кислоты и сульфидов);
- в аналитической химии (для осаждения сульфидов тяжелых металлов, которые обычно нерастворимы);
- в органическом синтезе (для получения сернистых аналогов органических спиртов (меркаптанов) и тиофена (серосодержащего ароматического углеводорода).
Еще одно из недавно появившихся направлений в науке — сероводородная энергетика. Всерьез изучается получение энергии из залежей сероводорода со дна Черного моря.
Природа окислительно-восстановительных реакций серы и водорода
Реакция образования сероводорода является окислительно-восстановительной:
Н₂⁰ + S⁰→ H₂⁺S²⁻
Процесс взаимодействия серы с водородом легко объясняется строением их атомов. Водород занимает первое место в периодической системе, следовательно, заряд его атомного ядра равен (+1), а вокруг ядра атома кружится 1 электрон. Водород с легкостью отдает свой электрон атомам других элементов, превращаясь в положительно заряженный ион водорода — протон:
Н⁰ -1е⁻= Н⁺
Сера находится на шестнадцатой позиции в таблице Менделеева. Значит, заряд ядра ее атома равен (+16), и количество электронов в каждом атоме также 16е⁻.
Расположение серы в третьем периоде говорит о том, что ее шестнадцать электронов кружатся вокруг атомного ядра, образуя 3 слоя, на последнем из которых находится 6 валентных электронов.
Количество валентных электронов серы соответствует номеру группы VI, в которой она находится в периодической системе.
- Итак, сера может отдать все шесть валентных электронов, как в случае образования оксида серы(VI):
- 2S⁰ + 3O2⁰ → 2S⁺⁶O₃⁻²
- Кроме того, в результате окисления серы, 4е⁻могут быть отданы ее атомом другому элементу с образованием оксида серы(IV):
- S⁰ + О2⁰ → S⁺4 O2⁻²
- Сера может отдать также два электрона c образованием хлорида серы(II) :
- S⁰ + Cl2⁰ → S⁺² Cl2⁻
Во всех трех вышеуказанных реакциях сера отдает электроны. Следовательно, она окисляется, но при этом выступает в роли восстановителя для атомов кислорода О и хлора Cl.
Однако в случае образования H2S окисление — удел атомов водорода, поскольку именно они теряют электроны, восстанавливая внешний энергетический уровень серы с шести электронов до восьми.
В результате этого каждый атом водорода в его молекуле становится протоном:
- Н2⁰-2е⁻ → 2Н⁺,
- а молекула серы, наоборот, восстанавливаясь, превращается в отрицательно заряженный анион (S⁻²):
S⁰ + 2е⁻ → S⁻² - Таким образом, в химической реакции образования сероводорода окислителем выступает именно сера.
- С точки зрения проявления серой различных степеней окисления, интересно и еще одно взаимодействие оксида серы(IV) и сероводорода — реакция получения свободной серы:
- 2H₂⁺S-²+ S⁺⁴О₂-²→ 2H₂⁺O-²+ 3S⁰
Как видно из уравнения реакции, и окислителем, и восстановителем в ней являются ионы серы. Два аниона серы (2-) отдают по два своих электрона атому серы в молекуле оксида серы(II), в результате чего все три атома серы восстанавливаются до свободной серы.
2S-² — 4е⁻→ 2S⁰ — восстановитель, окисляется;
S⁺⁴ + 4е⁻→ S⁰ — окислитель, восстанавливается.
Источник: https://melscience.com/RU-ru/articles/serovodorod/
Огэ по химии. валентность и степень окисления
Валентность – одно из фундаментальных понятий в химии, поэтому задания на определение валентности обязательно встретятся в ОГЭ по химии.
Показывает валентность, сколько связей может образовать атом в соединении.
Нужно помнить, что валентность всегда положительна (число связей не может быть отрицательным) и обозначается римскими цифрами. Валентность помогает составить формулу соединения, а узнать её можно из таблицы Менделеева:
валентность элементов, стоящих в основных подгруппах, часто совпадает с номером группы.
Некоторые элементы имеют постоянную валентность (например, металлы первой группы всегда проявляют валентность I), другие – переменную (например, сера может проявлять валентность II, IV или VI).
naked-science.ru
Также в химии существует понятие «степень окисления».
Степень окисления – это условный заряд атома в соединении, который он приобрёл бы, будь все связи ионными (то есть если бы электроны полностью перешли бы от одного атома к другому).
Обратите внимание на слово «условный»! Степень окисления – это просто некий удобный инструмент для описания, на самом же деле она не показывает истинный заряд.
В отличие от валентности степень окисления может быть и отрицательной (поскольку заряд может быть и положительным, и отрицательным) и обозначается арабскими цифрами.
У ряда элементов степень окисления постоянна (например, металлы второй группы всегда имеют степень окисления +2), у других она может меняться в разных соединениях (например, сера может иметь степень окисления -2, +4, +6).
Теперь рассмотрим ряд заданий.
Задание 1.
- В каком соединении азот проявляет валентность III?
- 1. НNO3
- 2. HNO2
- 3. NO
- 4. N2O5
- Ответ: 2.
Объяснение: для начала посмотрим более лёгкие варианты 3 и 4.
В соединении NO азот имеет валентность II, в соединении N2O5 валентность азота V. Оба этих варианта исключаем, поскольку нас интересует валентность III. В варианте 1 представлена азотная кислота, где азот имеет валентность V.
А вот в варианте 2 показана азотистая кислота, где азот и имеет валентность III.
Задание 2.
- В каком соединении сера имеет степень окисления +4?
- 1. SO2
- 2. SO3
- 3. H2S
- 4. SF6
- Ответ: 1.
Объяснение: кислород за крайне редким исключением имеет степень окисления -2, водород +1, фтор -1.
Тогда в соединении SO2 степень окисления серы +4, в SO3 сера имеет степень окисления +6, в H2S степень окисления серы -2, в SF6 степень окисления серы +6. Таким образом, единственный вариант, где степень окисления серы +4, — вариант 1.
Задание 3
- Степени окисления азота в соединениях NaNO3 и Mg3N2 соответственно равны:
- 1. +5 и +5
- 2. -5 и +3
- 3. -5 и -5
- 4. +5 и -3
- Ответ: 4.
Объяснение: в нитрате натрия NaNO3 степень окисления азота +5, в нитриде магния Mg3N2 степень окисления азота -3. Таким образом, правильный вариант +5 и -3 (то есть номер 4).
Задание 4
- Какую степень окисления имеет хлор в хлорной кислоте НClO4?
- 1. -1
- 2. III
- 3. +7
- 4. VII
- Ответ: 3.
Объяснение: степень окисления обозначается арабскими цифрами и имеет знак, то есть варианты с номерами 2 и 4 можно смело откинуть.
Степень окисления -1 более характерна для хлора, но он проявляет её в хлоридах, бинарных (то есть состоящих из двух элементов) соединениях. В хлорной кислоте у нас есть водород со степень окисления +1 и кислород, имеющий степень окисления -2.
Путём несложных расчётов получаем, что здесь у хлора положительный заряд, и равен он +7.
Задание 5
- В каком соединении атом серы имеет такую же степень окисления, как в сероводороде?
- 1. Li2SO3
- 2. SO2
- 3. Fe2S3
- 4. CaSO4
- Ответ: 3.
Объяснение: для начала выясним степень окисления серы в сероводороде.
Его формула H2S, степень окисления водорода +1, следовательно, степень окисления серы здесь -2. Теперь перейдём к вариантам ответов.
В сульфите лития Li2SO3 сера имеет степень окисления +4, в диоксиде серы SO2 тоже +4, в сульфиде железа (III) Fe2S3 степень окисления серы -2, в сульфате кальция CaSO4 сера в степени окисления +6. Таким образом, единственный верный вариант – номер 3.
Пишите, пожалуйста, в х, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник: https://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/5c9a362c923be2390e3ced3d
Задание 3. Степень окисления. Валентность. ЕГЭ 2020 по химии
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.Средний процент выполнения: 80.6%Ответом к заданию 3 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
1) O 2) N 3) S 4) C 5) As
Из числа указанных в ряду элементов выберите два элемента, которые образуют кислоты, в которых элементы имеют степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Мышьяк не образует кислоты, кислород имеет степень только -2 в кислотах, а у азота в кислоте степень +5, так как он в пятой группе, а устойчивые степени идут на каждую вторую степень от группы, так что выбираем серу ($H_2SO_3$) и углерод ($H_2CO_3$).
Ответ: 34
1) K 2) S 3) Na 4) Si 5) Se
Из числа указанных в ряду элементов выберите два элемента, ко- торые в соединениях имеют единственную степень окисления. Запишите в поле ответа номера выбранных элементов.
Единственную степень окисления (+1) в соединениях проявляют щелочные металлы. Среди представленных элементов щелочными металлами являются K и Na.
Ответ: 13
1) N 2) S 3) P 4) Se 5) As
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют валентность, равную II. Запишите в поле ответа номера выбранных элементов.
В соединении с водородом проявляют валентность II сера и селен в сероводороде (H2S) и селеноводороде (H2Se) соответственно.
Ответ: 24
1) Te 2) I 3) O 4) S 5) Sr
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +6. Запишите в поле ответа номера выбранных элементов.
Высшая степень окисления для элементов, находящихся в главных подгруппах, равна, как правило, номеру группы. В VI группе находятся элементы теллур (ответ — 1), кислород (ответ — 3) и сера (ответ — 4).
Кислород не может образовывать соединений в степени окисления +6, потому что в атоме кислорода имеется только 2 электронных уровня, отсутствует d-подуровень и образование состояния с шестью неспаренными электронами невозможно.
Вывод: правильные ответы — 1, 4.
Ответ: 14
1) Sn 2) Pb 3) Ca 4) Ba 5) Sr
Из числа указанных в ряду элементов выберите два элемента, которые в высшем оксиде и летучем водородном соединении проявляют одинаковую валентность. Запишите в поле ответа номера выбранных элементов.
Валентность — число химических связей, которые атом образует в соединении. Для высших оксидов валентность равна высшей степени окисления.
Высшая степень окисления для элементов главных подгрупп равна номеру группу (исключения — кислород (+2) и фтор (0)).
Валентность в летучем водородом соединении равна низшей степени окисления; низшая (отрицательная) степень окисления вычисляется по формуле (номер группы (IV–VII) — 8).
- 1) Для олова: высшая степень окисления +4, высший оксид $SnO_2$, валентность $Sn^{IV}$; низшая степень окисления (4 – 8) = –4, летучее водородное соединение $SnH_4$, валентность $Sn^{IV}$ (ответ правильный).
- 2) Для свинца: высшая степень окисления +4, высший оксид $PbO_2$, валентность $Pb^{IV}$; низшая степень окисления (4 – 8) = –4, летучее водородное соединение $PbH_4$, валентность $Pb^{IV}$ (ответ правильный).
- Вывод: правильные ответы (1, 2) найдены, оставшиеся варианты рассматривать не будем.
Ответ: 12
1) Al 2) S 3) P 4) Cr 5) Si
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших оксидах равна +6. Запишите в поле ответа номера выбранных элементов.
Базовые знания. Для большинства элементов номер группы равен высшей степени окисления элемента.
- Исключения:
- а) высшая степень окисления кислорода +2, фтора – 0, инертных газов – 0;
- б) высшая степень окисления меди +2, золота +3;
- в) из элементов побочной подгруппы VIII группы только осмий образует соединения, в которых имеет степень окисления +8.
- Вывод: степень окисления +6 в соединениях могут иметь сера (находится в главной подгруппе VI группы, номер (2)) и хром (находится в побочной подгруппе VI группы, номер (4)).
Ответ: 24
1) Se 2) O 3) K 4) Te 5) Cs
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять высшую степень окисления +6. Запишите в поле ответа номера выбранных элементов.
Высшую степень окисления +6 имеют теллур ($Te^{+6}O_3$) и селен ($Se^{+6}O_3$).
Ответ: 14
1) F 2) Br 3) N 4) P 5) I
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять высшую степень окисления, равную +7. Запишите в поле ответа номера выбранных элементов.
Высшую степень окисления +7 способны проявлять элементы главной подгруппы VII группы таблицы Менделеева, то есть галогены. Но фтор имеет наивысшую среди элементов электроотрицательность и поэтому не проявляет степени окисления +7. Из представленных элементов её проявляют I и Br .
Ответ: 25
1) S 2) Na 3) He 4) Cl 5) Se
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять степень окисления +1. Запишите в поле ответа номера выбранных элементов.
Степень +1 могут проявлять металлы, то есть натрий, а также хлор, например в соединении $Cl_2O$.
Ответ: 24
1) Cu 2) Te 3) Se 4) Ag 5) O
Из числа указанных в ряду элементов выберите два элемента, которые образуют оксиды в степени окисления +1. Запишите в поле ответа номера выбранных элементов.
Теллур и селен могут образовывать только диоксиды и триоксиды, а кислород не может образовать оксид сам с собой, поэтому выбираем медь и серебро.
Ответ: 14
1) S 2) K 3) O 4) Te 5) Na
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления +6. Запишите в поле ответа номера выбранных элементов.
Высшую степень окисления +6 проявляют элементы главной подгруппы VI группы (халькогены), к ним относятся сера, кислород и теллур, но кислород имеет очень высокую электроотрицательность и поэтому его максимальная степень окисления +2.
Ответ: 14
1) Se 2) Ca 3) Br 4) Sr 5) Ba
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют свою низшую степень окисления. Запишите в поле ответа номера выбранных элементов.
Соединения металлов с водородом – гидриды, в них металлы проявляет не низшую степень, а вот селен и бром образуют кислоты и в них проявляют низшую степень окисления.
Ответ: 13
1) Li 2) Ar 3) Na 4) Ne 5) Cs
Из числа указанных в ряду элементов выберите два, которые соответствуют условию: степень окисления кислорода в продуктах сгорания простых веществ, образованных этими элементами, не равна –2. Запишите в поле ответа номера выбранных элементов.
Аргон и неон не горят, а у лития получается оксид лития (2). Оставшиеся варианты: натрий и цезий.
Ответ: 35
1) O 2) S 3) N 4) Te 5) P
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять степени окисления +3 и +5. Запишите в поле ответа номера выбранных элементов.
Как правило, устойчивые СО элементов следуют через одну, поэтому СО +3 и +5 могут проявлять элементы, стоящие в пятой группе, то есть азот и фосфор.
Ответ: 35
1) Ga 2) S 3) B 4) In 5) Se
Из числа указанных в ряду элементов выберите два элемента, которые образуют с водородом соединения со степенью окисления –2. Запишите в поле ответа номера выбранных элементов.
Отрицательную степень проявляют только неметаллы. Для бора нехарактерна степень окисления -2. Значит, сера и селен.
Ответ: 25
1) Cs 2) He 3) Na 4) Ar 5) Ne
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления +1, и расположите их в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов.
Высшую степень окисления +1 проявляют элементы главной подгруппы первой группы. Электроотрицательность в пределах группы увеличивается снизу-вверх, по мере удаления от цезия и приближения ко фтору. Правильный порядок следующий: цезий, натрий.
Ответ: 13
1) Cl 2) Fe 3) I 4) Mn 5) Br
Из числа указанных в ряду элементов выберите два элемента, которые могут образовывать соединения в степени окисления +6. Запишите в поле ответа номера выбранных элементов.
Для галогенов не характерна степень окисления +6. Она встречается в соединениях железа и марганца, например, в ферратах и манганатах.
Ответ: 24
1) N 2) Be 3) B 4) Al 5) P
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях с донорно-акцепторной связью могут проявлять степень окисления –3, и расположите их в порядке уменьшения длины связи Э–Н. Запишите в поле ответа номера выбранных элементов.
Отрицательную степень проявляют только неметаллы. Ищем их, это азот, бор и фосфор. Однако бор имеет электроотрицательность меньше водорода и проявляет в соединении с ним положительную степень окисления +3. Длина связи Э-Н увеличивается снизу вверх и слева направо в таблице Менделеева, поэтому сначала фосфор, а потом азот.
Ответ: 51
1) N 2) Sb 3) P 4) O 5) S
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –2. Запишите в поле ответа номера выбранных элементов.
Низшая степень окисления неметаллов находится как разность номера их группы и восьми, то есть, чтобы она равнялась -2, неметалл должен находиться в -2 + 8 = 6-ой группе. В этой группе находятся кислород и сера.
Ответ: 45
Источник: https://egeturbo.ru/ege/chem/tasks/3
Большая Рнциклопедия Нефти Рё Газа
- Cтраница 1
- Степень окисления серы в обоих случаях равна VI. [1]
- Степень окисления серы повышается на 2 единицы, а марганца уменьшается на 5 единиц. [2]
Степень окисления серы РІ S0l — имеет промежуточное значение ( 4), поэтому РѕРЅР° может РЅРµ только повышаться, РЅРѕ Рё понижаться.
Другими словами, 5РћР· — способен Рё окисляться, Рё восстанавливаться. [3]
Степень окисления серы повышается на 2 единицы, а марганца уменьшается на 5 единиц. [4]
Степень окисления серы РІ H2S равна — 2 ( СЃРј. пример. [5]
- Степень окисления серы повышается на 2 единицы, марганца уменьшается на 5 единиц. [6]
- Степень окисления серы повышается на 2 единицы, а марганца уменьшается на 5 единиц. [7]
- Степень окисления серы РІ H2S равна — 2, поэтому сероводород, как правило, проявляет восстановительные свойства. [8]
- Степень окисления серы РІ H2S равна — 2, поэтому сероводород, как правило, проявляет восстановитель — — ные свойства. [9]
- Степень окисления серы 6 проявляется в гекс. [10]
- Каковы степени окисления серы, проявляемые ею в соединениях. [11]
Но степень окисления серы, входящей в состав этих ионов, различна. В первом случае степень окисления железа совпадает с зарядом простого иона Fe2 и с валентностью железа.
Таким образом, валентностью данного элемента РІ комплексном соединении называют РІСЃСЋ СЃСѓРјРјСѓ связей, которой обладает РІ данном соединении центральный атом — комплексообразователь. [12]
- Определите степень окисления серы Рё — укажите, какие реакции РёР· РЅРёС… окислительно-восстановительные. [13]
- Чему равна степень окисления серы в молекуле пероксодисульфата аммония. [14]
- В результате реакции степень окисления серы повышается на 2 единицы, а марганца уменьшается на 5 единиц. [15]
- Страницы: 1 2 3
Источник: https://www.ngpedia.ru/id480651p1.html
Тест по химии на тему "Сера и ее соединения" (9 класс)
Тест по теме «Сера и ее соединения»Часть 11. Распределение электронов по энергетическим уровням в атоме серы:1) 2, 6 2) 2, 8, 8 3) 2, 8, 6 4) 2, 8, 8, 62. Сера — более сильный окислитель, чем:1) фтор 2)хлор 3) фосфор 4) кислород3. Степени окисления серы изменяются с +6 до 0 в группе веществ:
1)S,SO
2, SO3 2) H2SO4, SO2, H2S 3) Na2SO4, K2S, S 4) SO2, K2SO3, S4. Раствор серной кислоты может взаимодействовать со всеми веществами из группы:
1) MgO, CO
2, NaCl, Fe(OH)3 3) NaOH, ZnO, Cu, Na2CO3
2) CuO, Fe, HNO
3, NaOH 4) Mg(OH)2, BaCl2, FeO, Zn^ 5. Схеме превращения S+6 → S+4 соответствует уравнению реакции:
1) SO
3 + H2O = H2SO4 3) H2SO4 + Zn = ZnSO4 + H2
2) 2SO
2 + O2 = 2SO3 4) Cu +2H2SO4 = CuSO4 + SO2 + 2H2O^ 6. И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
1) H
2O , CO2 2) NaOH, CaO 3) H2O, Cl2 4) H2S, O27. Для осуществления превращения H2S → SO2 → SO3→ K2SO4нужно последовательно использовать:1) воду, кислород, оксид калия 3) кислород, воду, калий2) кислород, кислород. гидроксид калия 4) воду, кислород, карбонат калия^ 8. В реакции, уравнение которой H2SO3 + Br2 + H2O= H2SO4 + HBr , сера1) является восстановителем 3) является окислителем2) понижает степень окисления 4) не изменяет степень окисления^ 9. Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
1) CuO, HCl 2) Cu, NaCl 3) Zn, NaOH 4) CuSO
4, MgO10. Для осуществления превращения S → H2S → SO2→ CaSO3нужно последовательноиспользовать:1) водород, воду, оксид кальция 3) водород, кислород, гидроксид кальция2) водород, кислород, кальций 4) воду, воду, кальций^ 11.Для осуществления превращения BaCO3→ X → Ba(NO3)2 → BaSO4 нужно последовательно использовать:
1) HCl, HNO
3, H2SO4 3) H2SO4, HNO3, H2SO4
2) разложение при нагревании, HNO
3,, K2SO4 4) разложение при нагревании, NaNO3, H2SO4^ 12. Для осуществления превращения CuO → Cu → X → CaSO4 нужно последовательноиспользовать:1) водород, хлор, серную кислоту2) водород , раствор серной кислоты, гидроксид кальция3) водород, концентрированную серную кислоту, гидроксид кальция4) углерод, концентрированную серную кислоту , карбонат кальция^ 13. К окислительно-восстановительным относится реакция между водой и1) оксидом серы(IV) 2) оксидом кальция 3) натрием 4) аммиаком14. При растворении в воде полностью распадается на ионы1) гидроксид калия 2) сульфат бария 3) сероводород 4) глюкоза^ 15. Через 160 г 10% раствора гидроксида натрия пропустили сернистый газ. Сколько г средней соли получится?1) 28,4 г 2) 25, 2 г 3) 56,8 г 4) 50,4 г16. В результате реакции раствора хлорида бария с 200 г 7% раствора серной кислоты выпал осадок массой:1) 33,3 г 2) 31,4 г 3) 23,3 г 4) 20,8 гЧасть 2^ 1. Оксид серы(IV) вступает в реакцию с 1) водой 2) азотом 3) сероводородом 4) хлоридом натрия 5) фосфорной кислотойОтвет:________2. Раствор серной кислоты вступает в реакцию с1) медью 2) оксидом кремния 3) оксидом кальция 4) нитратом бария 5) фосфоромОтвет:________^ 3. Установите соответствие между схемой превращения и изменением степени окисления атома серы. ^ Схема превращений
- Изменение степени окисления
- А) Zn + H2SO4 (конц) → H2S + ZnSO4 + H2O
- 1) S0 → S+4
- Б) H2S + O2(избыток) → SO2 + H2O
- 2) S+6 → S-2
- В) H2SO3 + Br2 + H2O → H2SO4 + HBr
- 3) S+4 → S+6
- 4) S-2 → S+4
- 5) S+6 → S+4
- Ответ:
- Б
- В
^ 4. Установите соответствие между схемой превращения и изменением степени окисления атома окислителя.
^ Схема превращений
- Изменение степени окисления атома окислителя
- А) Cu + H2SO4 (конц) → SO2 + CuSO4 + H2O
- 1) Э-2 → ,Э+4
- Б) H2S + FeCl3 → FeCl2 + HCl + S
- 2) Э0 → Э+4
- B) S + HNO3(разбав.) → NO + 2SO4
- 3) Э+6→ Э+4
- 4) Э+3 → Э+2
- 5) Э+5 → Э+2
- Ответ:
- Б
- В
^ 5. Установите соответствие между схемой превращения и изменением степени окисления атома восстановителя.
^ Схема превращений
- Изменение степени окисления атома восстановителя
- А) C + H2SO4(конц.) → SO2 + CO2 +H2O
- 1) Э+4→ Э+6
- Б) P + H2SO4(конц.) → SO2 + H3PO4 + H2O
- 2) Э0 → Э-2
- В) O2 + H2SO3 → H2SO4
- 3) Э0 → Э+5
- 4) Э0 → Э+6
- 5) Э0 → Э+4
- Ответ:
- Б
- В
- ^ 6. Установите соответствие между веществом и реагентами, с которыми оно можетвступать в реакцию:
Вещество
- Реагенты
- А) сероводород
- 1) Fe, H2O
- Б) оксид серы(VI)
- 2) H2O, NaOH
- В) сера
- 3) SO2, O2
- 4) О2, Al
- Ответ:
- Б
- В
- Ответы:Часть 1
1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 3
- 3
- 3
- 4
- 4
- 2
- 2
- 1
- 2
- 3
- 2
- 3
- 3
- 1
- 2
- 1
- Часть 2
1
- 2
- 3
- 4
- 5
- 6
- 1,3
- 3,4
- А-2, Б-4, В-3
- А-3, Б-4, В-5
- А-5, Б-3, В-1
- А-3, Б-2, В-4
Источник: https://infourok.ru/test-po-himii-na-temu-sera-i-ee-soedineniya-klass-1601045.html




