Описание и свойства лития
Литий – элемент, с отношением к первой группе, во втором периоде таблицы, его атомный номер – 3. Формула лития — Li2O. Элемент открыли в 1817 г., был произведён только 1825 г. Название дословно переводится как «камень».

Литий – это металл, с щелочными свойствами, серебристого цвета, обладающий выраженными пластичными свойствами. Легко поддаётся обработке.
Характерен наиболее большой температурой плавления, это 180,54º С, кипения — 1340º С и низкой плотностью по сравнению с остальными металлами щелочного ряда. Его плотность ниже плотности воды.
Это позволяет ему оставаться на плаву на водной поверхности и даже в керосине.
Атом лития своими небольшими размерами позволяет металлу выказывать определённые свойства. Смешение с натрием происходит только в определённой температуре,а с цезием, рубидием и кадмием, он не смешиваться вовсе. Остальные металлы этого ряда подобными свойствами не обладают.
Не смотря на то, что литий это металл с щелочных свойств, он наименее активный из всех прочих, и с кислородом не взаимодействует, с сухим тоже. Поэтому хранить его в керосине, защищая от взаимодействия с кислородной средой, как это делается с другим щелочным металлам, нет необходимости.
К тому же это бесполезно – на практике он всё равно всплывёт на поверхность. Поэтому его можно спокойно хранить на открытом воздухе длительное время, не опасаясь, что в нём произойдут нежелательные изменения.

При достаточной влажности происходит реакция с азотом и другими газами, растворёнными в воздухе. Превращения зависят от свойств контактирующего агента (газа). Может образоваться гидроксид, карбонат или нитрит лития. В процессе нагревания в кислородной среде образуется оксид лития Li2O.
Определить литий несложно – оказавшись в открытом пламени, он окрашивает его своеобразными красными оттенками. Самовоспламеняется при 300º С. Следует быть осторожным при этих процессах, так как продукты его горения раздражающе действуют на оболочки дыхательных путей, а также глаза. Также он может вызвать ожоги, попадая на мокрую кожу.
Реакция на воду спокойная, при неё образуется гидроксид лития и водород. Также характерны реакции с этилом, водородом, и аммиаком. Реакция на серу происходит при 130º С, с образованием сульфидов. На углерод реагирует при 200º С, в полном вакууме, во время этого образуется ацетиленид. Растворяясь в аммиаке, образует раствор синеватого цвета.
При необходимости длительного хранения литий хранится в отдельных коробках из жести, погружённый в петролинейный эфир или парафин.
Месторождения и добыча лития
Литий представитель литофильных фрагментов ионного происхождения, из них можно отметить цезий, калий и рубидий. К основным минералам, содержащим литий, относятся пироксен, сподумен, слюда и лепидолит. Помимо его нахождения в самостоятельно образованных минералах, его можно обнаружить на месте калия в сторонних соединениях.

Образование лития происходит на почве редкометальных гранитных интрузий, в литиеносных пегматитах или гидротермальных месторождениях, которые помимо лития, в комплексе с вольфрамом, висмутом, оловом и т.д. Наиболее высокая концентрация лития, присуща породам онгонитам – гранитам, содержащих большое количество воды и фтористых образований.
В определённом количестве литий содержит вода в сильносолёных озёрах. Его месторождения имеются в Бразилии, Аргентине, Чили, Канаде, США, Конго, Швеции, Испании, Афганистане, Китае, и Австралии. А также в России, где половина залежей содержащих этот элемент, находится в Мурманской области.
Применение лития
Литий применяется в изготовлении керамики и стеклянной продукции, источников напряжения, горюче-смазочных материалов и полимеров, а также в металлургической промышленности и фармацевтике.

Нередко для устройства требуется мощный и ёмкий аккумулятор. Литий наиболее подходящая составляющая для его изготовления. Если для начинки используется литий, батарея прослужит гораздо дольше. Можно отметить, например, литий-ионный тип подзаряжающихся батарей.
Купить аккумуляторы литийного типа можно двух типов. Разница заключается в используемых электролитах. Литий-ионный аккумулятор – содержит электролит гелевого типа. Модель используется для питания большинства портативной электротехники, в частности, сотовых телефонах, ноутбуках, цифровых фотоаппаратах и видеокамерах.
Литий-полимерный аккумулятор – усовершенствованный вариант первого. В виде начинки используется полимер, содержащий литий. Для устройств имеющих большое потребление энергии, более подходит литий-полимерный вариант.
Также литий добавляют в электролиты других типов аккумулирующих устройств, например, щелочного вида. Это значительно повышает их ёмкость и срок эксплуатации.

Литий, в частности, применяется в металлургической промышленности при изготовления различных необходимых сплавов. Изготовляются сплавы с золотом, серебром, кадмием, магнием, и медью. Эти сплавы нашли своё применение в различных космических и авиационных технологиях.
Для военных нужд, с применением лития, изготовляются керамические элементы для различной техники и особо крепкое стекло. Также он используется в радиотехнических и оптических областях. Литий также применяется в металлогалогеновых лампах.
Идёт этот металл и на медицинские нужды. Доказано, что в небольшом количестве он необходим для нормальной работы организма. Его содержат все внутренние органы. Он участвует во многих обменных процессах и стимулирует иммунитет. Он применяется в препаратах для лечения психологических заболеваний и благотворно сказывается на работе нервной системы.
Цена лития
До 2008 г цена на литий постепенно росли, потом в связи с экономическим кризисом заметно упали. Если в то время цена на килограмм лития составляла порядком 66 долларов, то позже она понизилась с отметки 6,5 тыс. долларов до 5 тыс. долларов за тонну продукта, и после почти не поменялась. Но данные расценки относятся к товару относительно низкого качества.
На более чистый продукт, идущий, например, на изготовление батарей, идёт соответствующая накрутка около 700-800 $. Производители, несмотря на это, предпочитают доплачивать за качество, поэтому доходы от надбавки пока стабильные. Резкого повышения цен в обозримом будущем не ожидается. Чистый литий купить можно будет, приблизительно, за 6 тыс. долларов за тонну.

Прогнозы мирового рынка лития дают определённые надежды на его развитие. Это в основном обусловлено новыми амбициозными проектами в области строения электромобилей, для которых использоваться будут соответственно литиевые аккумуляторы.
С каждым годом этот проект становится всё более реальным, в связи со злободневностью загрязнения окружающей среды выхлопными газами и повышенным спросом на доступные средства передвижения.
Особенно проблема актуальна для развивающихся стран. Но сама технология ещё сырая, в частности, это проблема с хорошими дорогами, и электрическими заправками. Поэтому крупных подвижек на мировом рынке лития в ближайшие годы не предвидится.
Источник: https://tvoi-uvelirr.ru/litij-metall-svojstva-litiya-primenenie-litiya/
Литий: свойства и области применения

Компании, которые специализируются на скупке металлов, охотно принимают изделия, включающие в свой состав литий. На этот металл установлены достаточно высокие цены. Давайте попробуем разобраться в том, чем обусловлена высокая стоимость лития и изделия из него. Для этого нужно углубиться в историю этого металла и изучить сферы его применения.
История металла, химические и физические свойства
Литий представляет собой мягкий щелочной металл, обладающий серебристо-белым цветом. Особенность данного металла состоит в том, что среди всех существующих он обладает самыми высокими температурами кипения и плавления.
Литий всплывает в воде, поскольку он обладает очень низкой плотностью. Если другие пары щелочных металлов прекрасно поддаются смешиванию друг с другом, то сказать о литии этого нельзя. Он обладает уникальным свойством.
Его нельзя смешать с рубидием, цезием, калием, только с натрием и то при температуре, которая должна быть не ниже 380 градусов по Цельсию.

Если говорить о химических свойствах металла, то следует отметить его достаточно высокую устойчивость на воздухе. Он не вступает в реакцию с воздухом. Во влажной среде может реагировать с азотом и некоторыми другими газами, однако все это происходит очень медленно.
Добыча лития
Литий – довольно редкий металл, основными минералами которого являются слюда лепидолит и пироксен сподумен. Также он входит в состав пород онгонитов.
Этот металл еще добывают в месторождениях, которые расположены в сильносоленых озерах. Их называют рассолы. Самые крупные месторождения этого полезного ископаемого были обнаружены в Чили, США, Конго, Китае, Бразилии.
Самое знаменитое и богатое литием месторождение находится в Боливии. Его название – Солончак Уюни.

Если верить ученым, то по их словам аномальное количество этого полезного ископаемого содержится в звездных образованиях. Такие звездные образования состоят из красного гиганта, в центре которого расположена нейтронная звезда. Это «меторождение» было обнаружено на объектах, названных в честь Ландау, Житкова и Торна.
Литий получают путем разложения его минералов серной кислотой. Эту технологию называют кислотной. Второй способ получения – спекание или обработка с последующим выщелачиванием водой.

К самым крупным поставщикам полезного ископаемого следует отнести Австралию, Аргентину и Чили. Если говорить о России, то в нашей стране добыча лития в настоящее время не ведется, так как ресурсы лития исчерпаны, а новые месторождения не обнаружены.
Области применения лития
За счет того, что литий обладает уникальными свойствами, несравнимыми со многими другими металлами, он получил широкую сферу применения. Сейчас мы рассмотрим некоторые из них:
- Производство термоэлектрических материалов. Сульфид меди и лития зарекомендовали себя в качестве одних из лучших полупроводников, предназначенных для изготовления термоэлектропреобразователей.
- Изготовление лазерных материалов. В этой области широкое распространение получил фторид лития. Его применяют для изготовления лазеров и оптики, которые отличаются высокой эффективностью.
- Производство пиротехники. Если бы этот металл не использовали бы в этой сфере, то, скорее всего, невозможно было бы получить красный цвет огней.
- Современная электроника. Щелочные аккумуляторы, которые в настоящее время пользуются повышенным спросом при производстве различной техники, выполняют с использованием гидроксида лития. Такое решение позволяет значительно продлить срок службы устройств. Если говорить о производстве металлогалогеновых ламп, то здесь литий используют в качестве их наполнения. Также литий хорошо себя зарекомендовал в качестве оптического материала.
- Изготовление сплавов для различных сфер производства. В авиации и космонавтике используют сплавы лития, камдия, меди, скандия. Для изготовления припоев применяют сплавы лития с золотом и серебром.
- Металлургическая отрасль. Здесь это полезное ископаемое используют в качестве вспомогательного вещества при выплавке алюминия. Этот редкоземельный металл способствует повышению показателей пластичности и прочностных характеристики различных сплавов.
- Ядерная энергетика. Этот металл получил распространение в производстве ядерных реакторов. Здесь пригодились его превосходные свойства высокой удельной теплоемкости.
- Медицина. Соли лития обладают целебными свойствами, поэтому они используются при лечении различных заболеваний.
На самом деле сферы применения лития гораздо шире. По этой причине скупка лития пользуется популярностью. Наша компания предлагает выгодные условия сотрудничества для физических и юридических лиц. У нас самые высокие цены на литий и изделия из него.
Источник: https://goldform.ru/litij-svojstva-i-oblasti-primeneniya
Все о литий-ионных аккумуляторах
13 декабря 2019
Литий-ионные аккумуляторы (Li-ion) на сегодняшней день являются одни из самых распространенных. Фотоаппараты, смартфоны, видеокамеры, электроинструменты – это лишь небольшая часть списка предметов, в которых используется этот источник питания. Это один из самых новых типов аккумуляторов (первый был выпущен в 1991 году), а в 2019 году за его изобретение трем ученым дали Нобелевскую премию.
Хотя литий-ионные аккумуляторы относятся к самым распространенным, их нельзя назвать идеальным, у них есть не только плюсы, но и минусы. Другое дело, что альтернатив нет, что и обуславливает их повсеместное использование. В нашей статье мы подробно разберем их устройство, плюсы, минусы, особенности работы и другие важные нюансы.
Принцип работы и устройство
Ниже на схеме можно посмотреть устройство литий-ионного аккумулятора. У него есть два типа электродов: катоды на алюминиевой фольге и аноды на медной, которые разделены пористым сепаратором, который, в свою очередь, пропитан электролитом. Заряд переносит ион лития, которые может внедряться в кристаллические решетки иных материалов, образовывая химические связи.
Если говорить простым языком, то при подаче напряжения на электроды, ионы лития переходят из литиевого катода в угольный, что сопровождается химической реакцией, а при подаче нагрузки (то есть, при зарядке), происходит обратный процесс.
К сожалению, при зарядке отрицательный электрод восстанавливается не до конца, кроме того, продукты окисления постепенно скапливаются, поэтому Li-ion АКБ постепенно теряет свою емкость и сделать с этим ничего нельзя.
Особенно ярко это видно на примере смартфонов, которые в самом начале эксплуатации могут работать 10 часов в активном режиме, а через год-два это значение может очень существенно сократиться.
На практике считается, что при снижении емкости на 30-35%, жизненный цикл литий-ионного аккумулятора завершается и его нужно менять.
Устройство литий-ионного аккумулятора подразумевает использование платы, которая контролирует зарядку (это необходимо). Впрочем, о зарядке мы еще поговорим отдельно: там особый процесс. Также отметим, что в качестве катодных материалов сегодня используют разные соединения: литий-феррофосфат, литий-марганцевая шпинель, кобальт лития.
Преимущества
К ключевым преимуществам относят следующие параметры:
- Очень высокая энергоплотность (соотношения количества мАч и объема);
- Высокий ток при работе;
- Нет необходимости в обслуживании;
- Саморазряд очень низкий;
- Готовность к эксплуатации в любой момент;
- Нет эффекта памяти;
- Возможность создавать аккумуляторы любых размеров и форм;
- Диапазон рабочих температур очень широкий.
Каждое из преимуществ обуславливает применение литий-ионных аккумуляторов в той или иной сфере. Например, высокая энергетическая плотность делает их фактически безальтернативным источником энергии для компактных устройств.
Недостатки
Список недостатков литий-ионных аккумуляторов короче, но и здесь есть достаточно важные моменты. Отметим, что некоторые особенности мы будем подробно разбирать в следующем разделе, так как они очень важны.
- Дорогие (относительно других АКБ);
- При высоких температурах работа ухудшается, при низких снижается емкость, хотя диапазон все же широк;
- Срок службы зависит от времени использования;
- Опасность взрыва или возгорания;
- Не самое большое количество циклов зарядки и разрядки;
- Недопустимы механические повреждения;
- Требуют строгого соблюдения правил зарядки и иных требований к эксплуатации.
Особенности литий-ионных аккумуляторов
Некоторые плюсы и минусы, а также особенности литий-ионных аккумуляторов стоит разобрать отдельно. В первую очередь те, которые оказывают существенное влияние на эксплуатацию и срок жизни АКБ.
Опасность взрыва и возгорания
Считается, что это одна из ключевых проблем. Именно поэтому их запрещено провозить в багаже на самолетах. Тем не менее, в данный момент опасность преувеличена (хотя, в случае с авиацией, лучше перестраховаться и здесь запрет имеет смысл).
Часто взрывались литий-ионные аккумуляторы первого поколения, где анод был из лития. После циклов зарядки и разрядки на нем образовывались дендриты, которые приводили к замыканию, которое и вызывало возгорание или взрыв.
Материал анода заменили на графит и от этого недостатка избавились.
Сегодня такое происходит редко, но в СМИ можно часто увидеть новости, о взрыве смартфонов и т.д.
Причин может быть много, но чаще всего это механические повреждения, АКБ низкого качества, короткие замыкания внутри аккумулятора (полностью от этой проблемы не избавились).
В настоящее время самым опасным компонентом является электролит, который способен разлагаться на воспламеняющиеся материалы при повышении температуры.
В принципе, если используется качественный литий-ионный аккумулятор, соблюдаются все правила эксплуатации, то вероятность взрыва или возгорания крайне низка. Это примерно как пострадать от удара молнии: никто не застрахован, но происходит это очень редко.
Отдельно расскажем про тушение. В ходе горения происходят не совсем традиционные химические реакции, поэтому литий-ионный аккумулятор может гореть даже без кислорода. Кроме того, при контакте с водой литий может образовывать водород. Если небольшой аккумулятор можно затушить водой, то в случае с крупными (например, в электромобилях) это будет неэффективным способом тушения.
Эффект памяти
К преимуществам литий-ионных аккумуляторов традиционно относят отсутствие эффекта памяти, особенно в сравнении с никель-кадмиевыми АКБ. Тем не менее, последние исследования показали, что это ошибка, однако эффект является настолько незначительным, что его можно не учитывать.
Все дело в ионах лития, которые теряют свои свойства при неполной зарядке. Часть из них остается на катоде, они переходят в пограничное состояние. То есть, они фактически подошли к барьеру освобождения, но не преодолели его.
Поэтому при зарядке, когда свободные ионы пытаются вернуться на свое место, они встречаются с теми, которые находятся в пограничном состоянии и тем самым процесс становится более сложным, а структура электрода изменяется.
Существуют определенные предложения, как избавиться от этого эффекта, но, повторим, он носит незначительный характер.
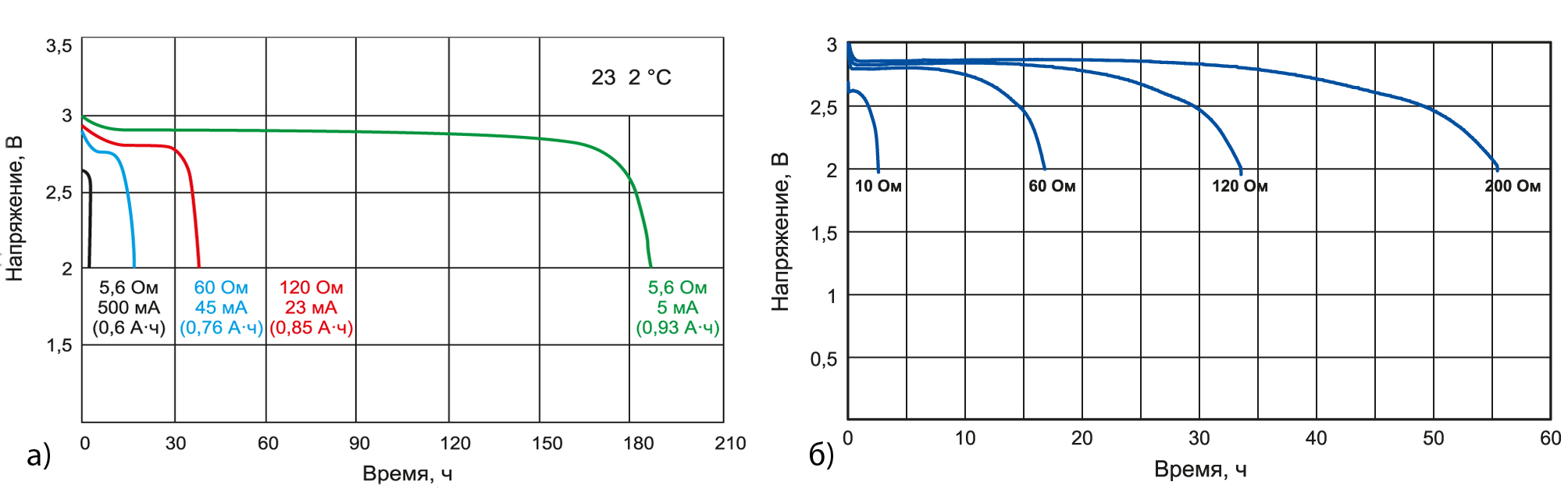
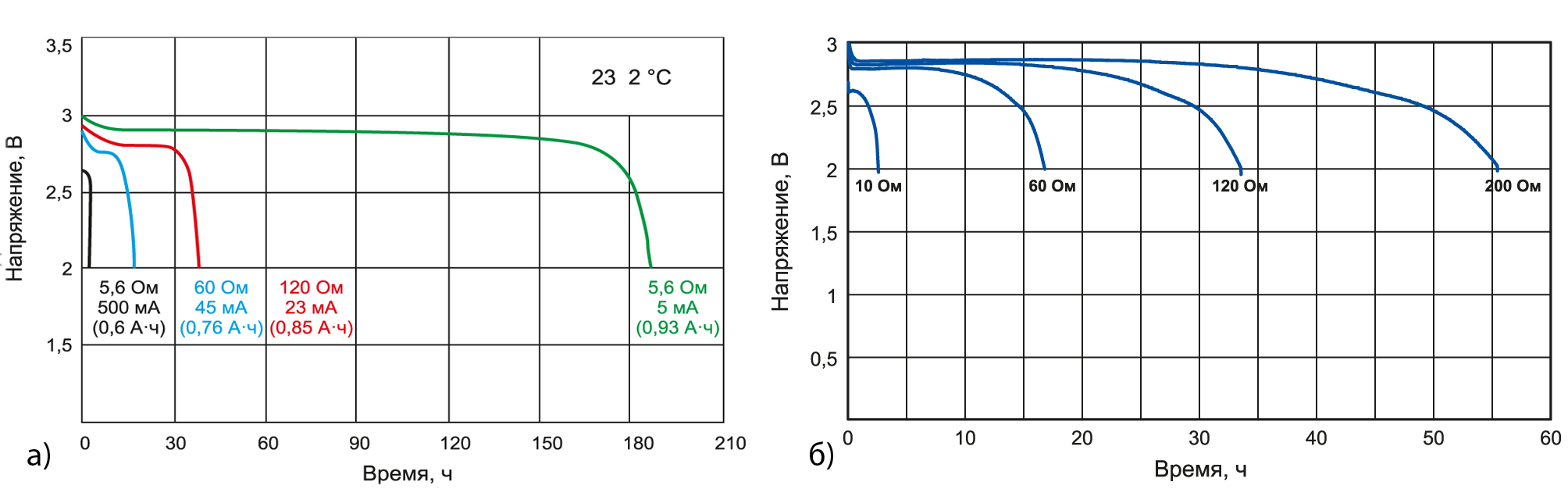
Зарядка литий-ионного аккумулятора и разряд
Выше мы писали, что в данных АКБ используется контроллер, который автоматически регулирует зарядку. Это является критически важным, ведь при повышении напряжения аккумулятор может деградировать. Обычная зарядка происходит следующим образом:
- На первом этапе используется небольшой ток напряжением до 2,9 В (при сильном разряде);
- Номинальный ток, напряжение до 4,2 В;
- На финальном этапе напряжение также 4,2 В, но ток минимальный.
В принципе, рядовому пользователю знать этого не нужно, контролеры и зарядные устройства поддерживают данные режимы автоматически. Данная схема является стандартной и в современных устройствах обеспечивается в автоматическом режиме.
Относительно глубокого разряда есть вполне четкое мнение: его допускать нельзя. В идеале, батарею не нужно доводить до разряда ниже 20%, это существенно продлит срок ее службы. Простой пример: если литий-ионный аккумулятор регулярно разряжается на 100%, то его количество циклов разряда и заряда будет около 500, а если лишь на 10%, то 4500 и выше. То есть, разница будет в 9 раз.
Здесь многое зависит от типа устройства, в котором используется АКБ. Разумеется, для смартфона или электроинструмента зарядка на уровне даже 70-80% емкости батареи выглядит невозможной, это попросту затруднит эксплуатацию. Но допускать разряд ниже 20% стоит только в крайнем случае, это действительно очень существенно продлевает срок жизни аккумулятора.

Старение
Данный тип аккумуляторов подвержен процессу старения, это достаточно серьезный недостаток.
С этой точки зрения нет никакого смысла покупать батареи «про запас» и хранить их длительное время, но при этом не использовать.
Поэтому если вы покупаете литий-ионный аккумулятор отдельно, стоит обратить пристальное внимание на дату его изготовления. Подавляющее большинство не могут служить более пяти лет (усредненное значение).
Кроме того, условия хранения также оказывают существенное воздействие на время хранения. Оптимальные условия: 40% заряд, температура от 0 до +10 градусов по Цельсию. А под сроком хранения до 5 лет подразумевается снижение емкость до уровня 80% от номинальной.
Оригинальные и не оригинальные
Литий-ионные аккумуляторы производят многие компании и каждый видел картину, когда АКБ от производителя устройства стоит значительно дороже, чем аналог. При этом емкость может быть одинаковой. Стоит ли экономить? Вопрос сложный, который зависит от того, в каком именно устройстве используется аккумулятор.
Разберем на примере смартфонов. Выше мы писали, что при заряде используется контроллер, но в случае со смартфонами, он находится не в АКБ, а в самом телефоне. То есть, все функции, которые должны обеспечивать эффективную работу, делегированы в само устройство. Это сделано сознательно, подобный подход как раз и создает не оригинальным АКБ изначально худшие условия.
Но есть устройства (например, электроинструмент, часть ноутбуков), где данная проблема не является актуальной и там никакой разницы вы не заметите.
Поэтому мнение о том, что «дешевые китайские литий-ионные аккумуляторы плохие» — отчасти миф.
Да, встречается продукция низкого качества, но зачастую снижение характеристик обусловлено факторами, на которые производитель АКБ повлиять никак не может.
Температура использования
Для большинства литий-ионных аккумуляторов температура эксплуатации находится в диапазоне от – 20 до +50 градусов. Перегрев и переохлаждение не допускаются. Зарядка при низкой температуре также недопустима. Также, при падении температуры, снижается емкость. При отрицательной температуре батарея может потерять до 50% емкости, то есть, разрядится в два раза быстрее.
Существуют аккумуляторы с внутренним подогревом (если подразумевается эксплуатация при очень низких температурах), также некоторые устройства сами могут служить в роли обогревателя при работе, что несколько расширяет диапазон значений. Самая лучшая температура для работы литий-ионных аккумуляторов +20 градусов. Изменения как в плюс, так и в минус, негативно сказываются на емкости и ресурсе.

Характеристики
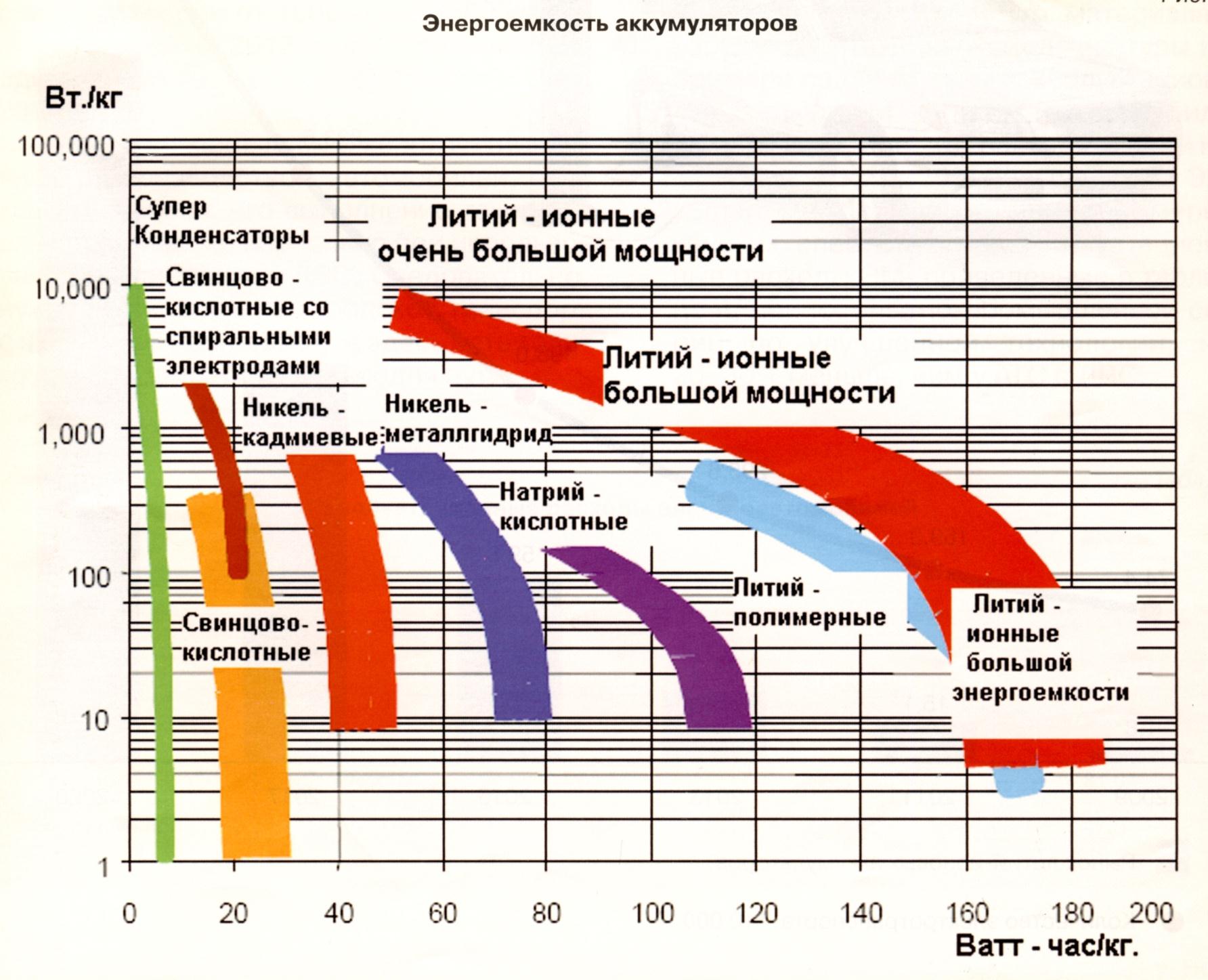
Характеристики могут зависеть от типа аккумулятора, химического состава его компонентов и варьироваться в определенных пределах.
- Энергоемкость: от 110 до 280 Втч/кг;
- Количество циклов заряда и разряда при емкости 80%: 600-700;
- Значение внутреннего сопротивления: от 4 до 15 мОм/Ач;
- Напряжение одного элемента: от 2,5 В до 4,2 В;
- Саморазряд: зависит от температуры и степени заряда. При 100% заряде и оптимальной температуре – около 1,5% в месяц;
- Скорость быстрой зарядки: около 60 минут.
Это диапазоны основных значений. Могут быть определенные отличия у аккумуляторов различных форм-факторов, например, напряжение 1,5 В (АА и ААА), но здесь речь идет о стабилизированном выходном напряжении, которое не зависит от напряжения в самих ячейках.
Восстановление аккумулятора
Ситуаций, когда литий-ионный аккумулятор может потребовать восстановление может быть две:
- Аккумулятор работает, однако разряжается очень быстро;
- Он полностью разряжен, но зарядка не работает.
В первом случае речь идет про естественную потерю емкости, и поделать с этим ничего нельзя. Даже в теории не существует способа вернуть номинальную емкость у литиевого аккумулятора. Во втором случае кое-что сделать можно, в интернете можно найти очень подробные инструкции по восстановлению в данном случае.
Чаще всего это происходит из-за глубокой разрядки, длительного не использования аккумулятора (когда он разряжен) или после воздействия очень низких температур.
Проблема здесь в зарядных устройствах, которым кажется, что на аккумуляторе недопустимо низкое напряжение и поэтому они препятствуют подачи тока. Это сделано не просто так, цель – безопасность.
Просто тут зарядное устройство ошибочно «думает», что внутри произошло замыкание или другие неполадки, а при таких ситуациях заряжать его попросту опасно. То есть, это вопрос безопасности.
При данной неполадке восстановление аккумулятора заключается в обмане зарядного устройства. Например, можно взять другую зарядку, которая не такая «умная». Однако, в этом случае нужно ограничивать максимальный ток. Здесь мы не будем писать длинные и подробные инструкции, их вы легко найдете сами, мы лишь отметили, что восстановление литий-ионного аккумулятора возможно.
Частые вопросы
В заключительной части мы разберем самые частые вопросы про литиевые аккумуляторы и дадим на них подробные ответы.
Есть ли альтернатива у литий-ионных аккумуляторов?
В настоящее время – нет. Можно сказать, что данная технология – апогей развития химических аккумуляторов. Теоретически (да и практические) альтернативы есть, но у них либо слишком высокая цена, либо низкий ток, либо внушительные размеры. Очевидно, что пока не произойдет прорыва в технологиях, вменяемой альтернативы не будет.
Можно ли заменить другие типы аккумуляторов на литиевые?
Да, это возможно и не требует специальных знаний и большого опыта. Чаще всего замену делают в электроинструментах, где меняют никель-кадмиевые на литий-ионные. Последние стоят дороже, зато их характеристики лучше. Чаще всего делают переделку шуруповертов и других подобных электроинструментов с питанием от АКБ.
Как утилизировать?
Литиевые аккумуляторы чаще всего просто выкидывают, особенно если говорить о совсем небольших, отдавать которые на переработку никому даже в голову не приходит. Кроме того, в России очень мало предприятий, которые занимаются данным типом аккумуляторов. Конечно, выкидывать их не правильно, но, к сожалению, зачастую другого выбора просто нет.
Кадмиевые аккумуляторы лучше литиевых? Или наоборот?
Данный вопрос не совсем корректный. Без уточнения характеристик, которые имеют значение, ответить на него невозможно. Где-то будет лучше один тип, где-то совсем другой. У всех есть свои плюсы и минусы, поэтому нельзя сказать, какой из них лучше.
Правда ли то, что китайские литий-ионные аккумуляторы плохие?
Откроем секрет: большинство литиевых АКБ производят в Китае. В данном случае вопрос не в месте производства, а в контроле качества. Те, которые стоят значительно дешевле аналогов, очевидно, будут иметь худшие характеристики, поэтому от экономии толку не будет. Есть определенная цена, которая обусловлена производственными затратами, ее снижение автоматически снижает характеристики.
Источник: https://tze1.ru/articles/detail/vse-o-litiy-ionnykh-akkumulyatorakh/
Литий
Химический элемент Литий получил известность благодаря открытию Иоганна Августа Арфведсона в 1817 г в составе алюмосиликата, петалита. Затем «огнепостоянную щёлочь» нашли в других минералах естественного происхождения. Это белый, с серебристым блеском металл, который можно разрезать ножом. В таблице Менделеева занимает третье место и обозначается Li (от латинского Lithium).
Краткое описание химического элемента Литий
Порядковый (атомный) номер элемента в периодической системе химических элементов Менделеева равен трём. В обычных условиях металлический Li обладает самой низкой плотностью из всего числа известных металлов. Кроме того, он возглавляет семейство щелочных металлов по температуре плавления и кипения.
Исторические факты
Первый металлический образец был получен сэром Гемфри Дэви в процессе разложения электрическим током расплава гидроксида лития. Вместе с первым результатом электролиза лития, Леопольд Гмелин, экспериментируя с литий содержащими солями, отметил окрашивание пламени в тёмно-карминовый цвет.
Химические свойства лития
Литий проявляет «капризные» свойства при смешивании с натрием, совсем не реагирует с расплавами калия, рубидия и цезия.
В условиях комнатной температуры литий не взаимодействует с сухим воздухом или водородом. В отличие от остальных щелочных металлов, его невозможно хранить в керосине.
Для данной цели используют масло Шервуда, парафин, газовый бензин или минеральное масло в герметичных жестяных ёмкостях.
При температуре выше 100, но ниже 300 градусов цельсия, на поверхности лития образуется защитная оксидная плёнка, препятствующей дальнейшему взаимодействию хим. Элемента с окружающей средой, даже во влажном воздухе. Металлическая форма элемента обжигает при попадании на влажную поверхность кожи или слизистой.
Применение лития
Сам элемент и его соединения широко применяются для производства стекла, в качестве покрытия фарфора.
Чёрная и цветная металлургия используют литий для придания сплавам прочности и пластичности, в изготовлении смазок.
Текстильная промышленность применяет этот элемент в качестве отбеливателя тканей, пищевая – в роли консерванта, фармацевтика успешно использует в косметических препаратах.
Жидкий литий нашёл своё применение в ядерных реакторах, радиоактивный тритий получают при помощи изотопа лития-6. Широкое применение щелочной металл нашёл в химической промышленности, как катализатор многих процессов, компонент сплавов, из которых изготавливают холодные катоды, а также аноды источников тока.
Фторид лития в виде монокристаллов применяют для создания высокоточных лазеров с КПД 80%. Различные соединения с литием участвуют в дефектоскопии, пиротехнике, радиоэлектронике, оптоэлектронике.
 Литий-ионные аккумуляторы
Литий-ионные аккумуляторы
Интересные факты о литии
Соли лития – психотропное вещество, положительное влияние которых на психическое состояние человека было подтверждено лишь в середине XX века. Карбонат лития с успехом применяется для лечения людей с биполярным расстройством, маниакальной депрессией, склонных к суициду.
Этим объясняется низкий уровень преступности в тех районах, где в значительной степени литий содержится в питьевой воде.
Механизм воздействия элемента до сих пор изучен слабо, но существуют предположения, что положительный эффект достигается регулятивной функцией активности части ферментов, участвующих в переносе ионов натрия и калия в мозг.
Баланс Na и К напрямую отвечает за состояние психики. Так доказано, что у людей, склонных к депрессии, в клетках избыточное содержание натрия, а литий выравнивает ионную картину.
Свойство лития уменьшать депрессию и риск суицида нашло свое отражение в творчестве групп Nirvana и Evanescence. В их дискографии имеются психоделические песни под названием Lithium.
На роли лития в активизации спящих клеток костного мозга основана надежда современной медицины в деле борьбы с раком крови.
Экспериментально доказано, что литий благоприятно воздействует на области поражения генитальным герпесом. Положительно отмечено применения Li в комплексе лечения гипертонии и диабета.
Безусловна эффективность в рамках предупреждения склероза и заболеваний сердечно-сосудистой системы.
Присутствуя в смазочных материалах, литий позволяет осваивать Антарктиду, в условиях критически низких температур. Без этого элемента техника попросту откажет. Его рассматривают как компонент твёрдого ракетного топлива, ведь результат сгорания 1 кг твёрдого Li более десяти тысяч килокалорий, что почти в пять раз больше, чем результат сгорания 1 кг керосина.
Источник: http://www.alto-lab.ru/elements/litij/
Литий
| Атомный номер | 3 |
| Внешний вид простого вещества |  Мягкий металл серебристо-белого цвета Мягкий металл серебристо-белого цвета |
| Атомная масса (молярная масса) | 6,941 а. е. м. (г/моль) |
| Радиус атома | 155 пм |
| Энергия ионизации (первый электрон) | 519,9(5,39) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s1 |
| Ковалентный радиус | 163 пм |
| Радиус иона | 68 (+1e) пм |
| Электроотрицательность (по Полингу) | 0,98 |
| Электродный потенциал | -3,06В |
| Степени окисления | 1 |
| Плотность | 0,534 г/см³ |
| Молярная теплоёмкость | 24,86 Дж/(K·моль) |
| Теплопроводность | 84,8 Вт/(м·K) |
| Температура плавления | 453,69 K |
| Теплота плавления | 2,89 кДж/моль |
| Температура кипения | 1613 K |
| Теплота испарения | 148 кДж/моль |
| Молярный объём | 13,1 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 3,490 Å |
| Отношение c/a | — |
| Температура Дебая | 400 K |
Ли́тий — химический элемент главной подгруппы первой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 3. Обозначается символом Li (Lithium). Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
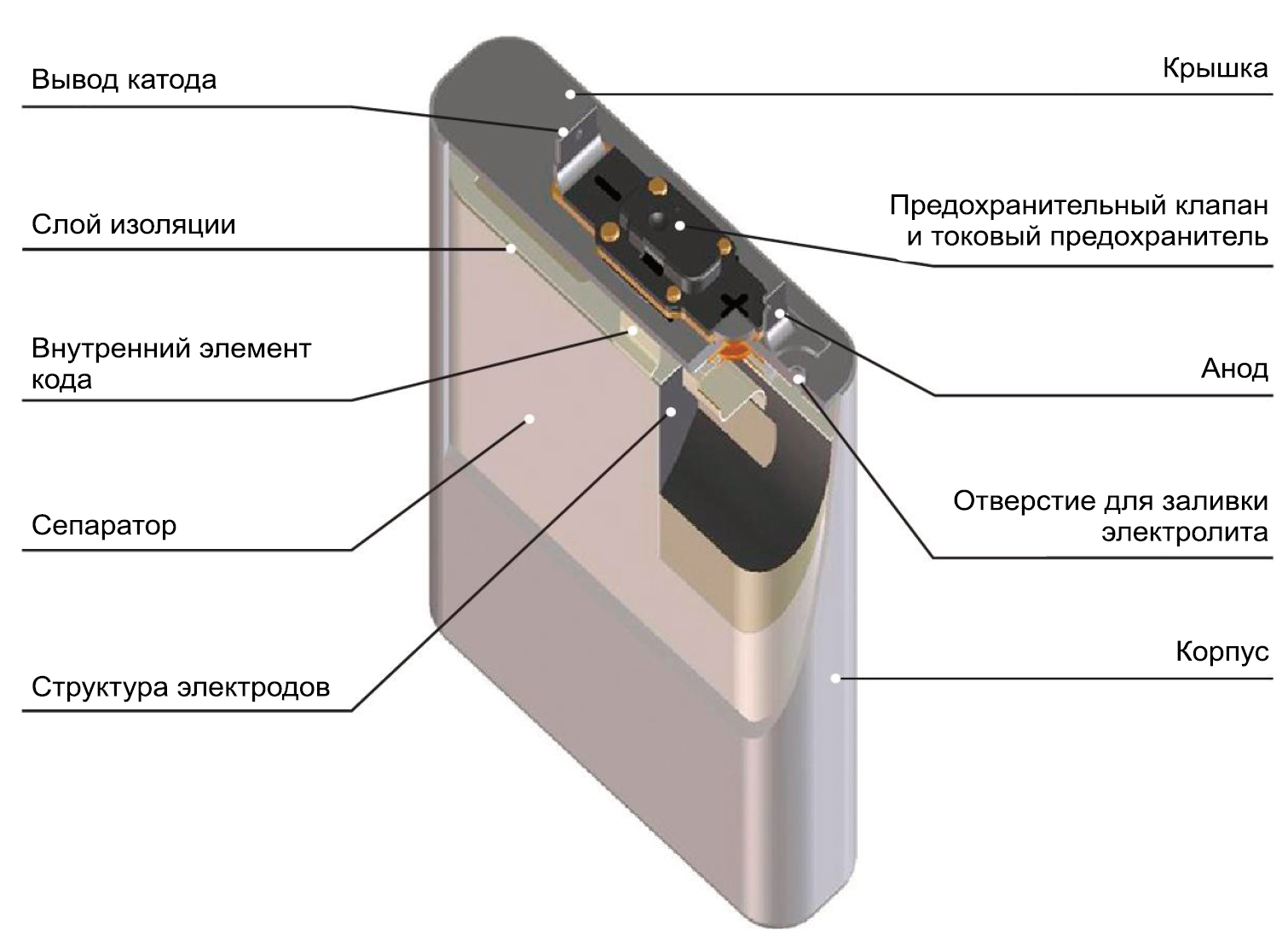 Схема атома лития
Схема атома лития
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Хамфри Дэви в 1825 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» ( λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой.
В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси).
В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Схематическое изображение атома лития.
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), которая при холодной обработке переходит в кубическую плотноупакованную решётку, где каждый атом, имеющий двойную кубооктаэдрическую координацию, окружён 12 другими. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра.
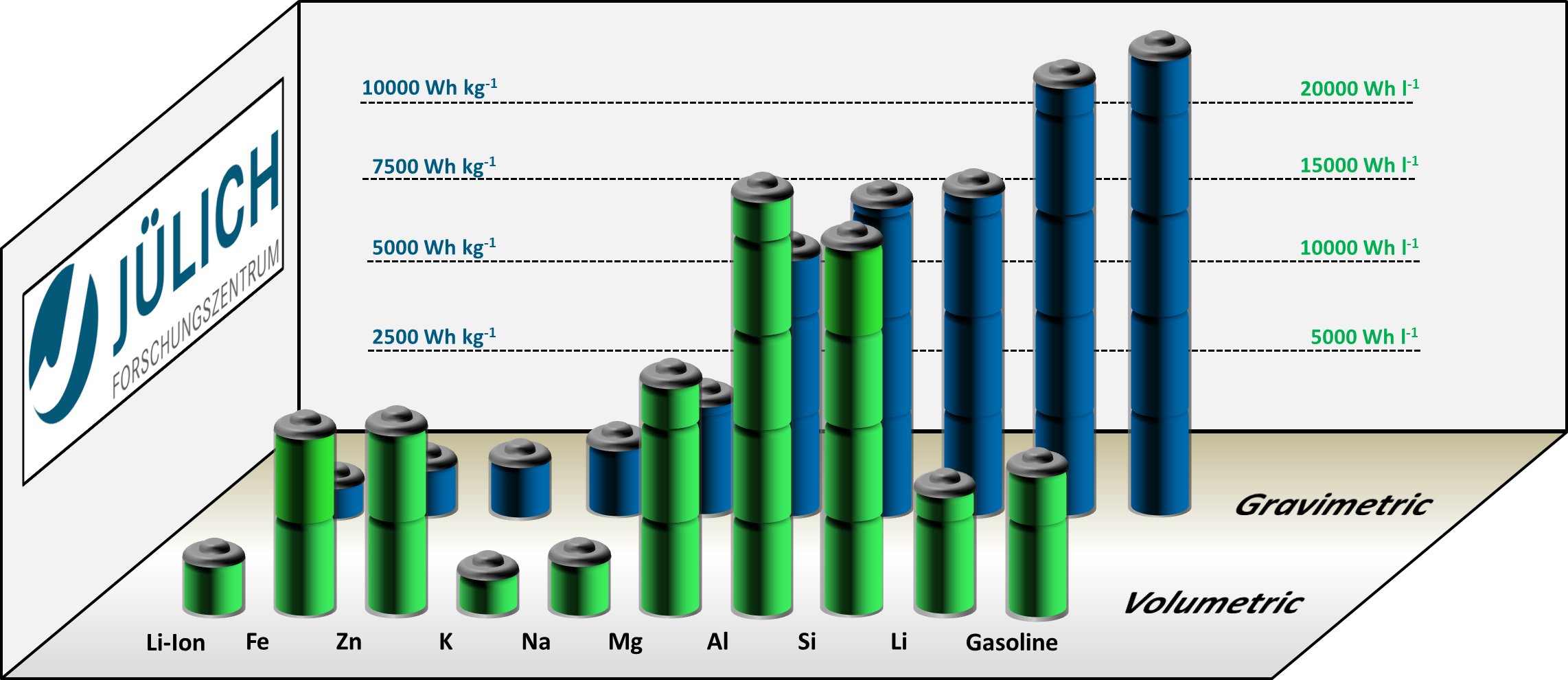
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380° С и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Карминово-красное окрашивание пламени солями лития
Химические свойства
Щелочной металл, неустойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует.
Во влажном воздухе медленно окисляется, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °С до 300 °С литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °С. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с аммиаком и с галогенами (с иодом — только при нагревании).
Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на кожу, слизистые оболочки и в глаза.
Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6Li (7,5 %) и 7Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов.
Это следует иметь ввиду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов и два ядерных изомера (4Li − 12Li и 10m1Li − 10m2Li соответственно). Наиболее устойчивый из них, 8Li, имеет период полураспада 0,8403 с.
Экзотический изотоп 3Li (трипротон), по-видимому, не существует как связанная система.
7Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть вскоре после Большого Взрыва). Образование элемента лития в звездах возможно по ядерной реакции «скалывания» более тяжелых элементов.
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т.
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Применение
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Химические источники тока
Литий используют в анодах химических источников тока (аккумуляторов, например литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидрооксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Ракетное топливо
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Лития сульфат используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике.
На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния.
Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия).
Легирование алюминия
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию.
Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления емкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6Li и 7Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний
Литий-6 (термояд)
- Применяется в термоядерной энергетике.
- При облучении нуклида 6Li тепловыми нейтронами получается радиоактивный тритий 31H (Т):
- 63Li + 10n = 31H + 42He.
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях.
В термоядерном оружии обычно применяется дейтерид лития-6 6LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7 (теплоноситель)
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких как уран, торий или плутоний.
Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов, жидкий литий-7 (часто в виде сплава с натрием или цезием-133) служит эффективным теплоносителем.
Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Соли лития обладают психотропным действием и используются в медицине при профилактике и лечении ряда психических заболеваний. Наиболее распространен в этом качестве карбонат лития. применяется в психиатрии для стабилизации настроения людей, страдающих биполярным расстройством и частыми перепадами настроения.
Он эффективен в предотвращении мании депрессии и уменьшает риск суицида.Медики не раз наблюдали, что некоторые соединения лития (в соответствующих дозах, разумеется) оказывают положительное влияние на больных, страдающих маниакальной депрессией. Объясняют этот эффект двояко.
С одной стороны, установлено, что литий способен регулировать активность некоторых ферментов, участвующих в переносе из межклеточной жидкости в клетки мозга ионов натрия и калия. С другой стороны, замечено, что ионы лития непосредственно воздействуют на ионный баланс клетки.
А от баланса натрия и калия зависит в значительной мере состояние больного: избыток натрия в клетках характерен для депрессивных пациентов, недостаток – для страдающих маниями. Выравнивая натрий калиевый баланс, соли лития оказывают положительное влияние и на тех, и на других.
Смазочные материалы
Стеарат лития — литиевое мыло используется в качестве высокотемпературной смазки.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 и супероксид LiO2 применяются для очистки воздуха от углекислого газа; при этом последние два соединения реагируют с выделением кислорода (например, 4LiO2 + 2CO2 → 2Li2CO3 + 3O2), благодаря чему они используются в изолирующих противогазах, в патронах для очистки воздуха на подлодках , на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление различной косметики).
Дополнительные данные
Соединения лития
Литий, Lithium, Li (3) Когда Дави производил свои знаменитые опыты по электролизу щелочных земель, о существовании лития никто и не подозревал. Литиевая щелочная земля была открыта лишь в 1817 г. талантливым химиком-аналитиком, одним из учеников Берцелиуса Арфведсоном. В 1800 г.
бразильский минералог де Андрада е Сильва, совершая научное путешествие по Европе, нашел в Швеции два новых минерала, названных им петалитом и сподуменом, причем первый из них через несколько лет был вновь открыт на острове Уте.
Арфведсон заинтересовался петалитом, произвел полный его анализ и обнаружил необъяснимую вначале потерю около 4% вещества. Повторяя анализы более тщательно, он установил, что в петалите содержится «огнепостоянная щелочь до сих пор неизвестной природы».
Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь в отличие от кали и натра впервые была найдена в «царстве минералов» (камней); название зто произведено от греч.- камень.
Позднее Арфведсон обнаружил литиевую землю,или литину, и в некоторых других минералах, однако его попытки выделить свободный металл не увенчались успехом. Очень небольшое количество металлического лития было получено Дэви и Бранде путем злектролиза щелочи. В 1855 г.
Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития. В русской химической литературе начала XIX в.
встречаются названия: литион, литин (Двигубский, 1826) и литий (Гесс); литиевую землю (щелочь) называли иногда литина.
Источник: http://himsnab-spb.ru/article/ps/li
Химические и физические свойства лития, его реакция с кислородом
[Deposit Photos]
Литий (Li) — химический элемент с порядковым номером «3» и атомной массой 6,941. Литий встречается в природе в виде двух стабильных нуклидов: 6Li (7,6% по массе) и 7Li (92,4%). В периодической таблице Менделеева литий расположен во втором периоде, первой группе. Элемент принадлежит к щелочным металлам. В соединениях литий проявляет степень окисления +1. В виде простого вещества литий — это пластичный легкий металл серебристого цвета.
[Deposit Photos]
Литий — самый легкий из металлов. Имеет плотность 0,534 г/см³. Плавится при температуре 180,5 °С, кипит при температуре 1330 °С.
Литий очень активен. Вступает в реакцию с кислородом и азотом воздуха при нормальных условиях. По этой причине на воздухе литий быстро окисляется с образованием темного налета продуктов взаимодействия. Уравнения реакций:
4Li + O₂ = 2Li₂O;
6Li + N₂ = 2Li₃N.
Кусочки лития в масле [Wikimedia]
Нажмите здесь, чтобы узнать больше о свойствах лития и других металлов.
Открытие лития и нахождение элемента в природе
Литий был открыт шведским ученым Арфведсоном в 1817 году. Сначала химик обнаружил элемент в минерале петалите, а затем — в сподумене и в лепидолите. Свое название металл получил из-за того, что был обнаружен в «камнях» (в переводе с греческого litos означает «камень»).
В 1818 году немецкий химик Гмелин впервые наблюдал характерное для солей лития пламя красного цвета. В 1821 году английскому химику Уильяму Томасу Бранду удалось выделить металл путем электролиза. В бóльших количествах литий смогли получить в 1855 году путем электролиза расплавленного хлорида. Уравнение реакции:
2LiCl = 2Li + Cl₂.
Литий распространен в земной коре, содержание металла в ней составляет примерно 3% по массе. Литий содержится в преимущественно в таких минералах: петалит, сподумен, лепидолит и амблигонит.
Лепидолит [Deposit Photos]
В виде примеси литий содержится в некоторых породообразующих минералах и присутствует в минерализованных водах и рапе некоторых озер.
Литий: реакция с кислородом, применение металла
Щелочные металлы и их соединения широко используются в технике. Литий применяется в ядерной энергетике. В частности, изотоп 6Li служит промышленным источником для производства трития, а изотоп 7Li используется как теплоноситель. LiF используется при плавке алюминия. Литий и его соединения используются и в качестве добавок к ракетному топливу.
[Flickr, Creative commons by Steve Jurvetson is licensed under CC BY 2.0]
Смазки, содержащие соединения лития, сохраняют свои свойства при повышенных температурах.
Гидроксид лития входит в состав электролита щелочных аккумуляторов, благодаря чему в два-три раза возрастает срок их службы.
Применяется литий также в керамической, стекольной и других отраслях химической промышленности. В целом, по значимости в современной технике этот металл является одним из важнейших элементов.
Реакция лития с кислородом приводит к образованию оксида Li₂O — бесцветного кристаллического вещества, имеющего температуру плавления 1438 °С и температуру кипения — около 2600 °С. Оксид лития получается при непосредственном окислении металлического лития при температуре выше 200 °С, а также разложением гидроксида LiOH, нитрата LiNO₃, карбоната LiNO₃.
Оксид лития Li₂O легко взаимодействует с водой с образованием гидроксида, LiOH. Данная реакция сопровождается сильным разогревом; LiOH поглощает CO₂ из воздуха, образуя карбонат, Li₂CO₃.
Источник: https://melscience.com/RU-ru/articles/himicheskie-i-fizicheskie-svojstva-litiya-ego-reak/




