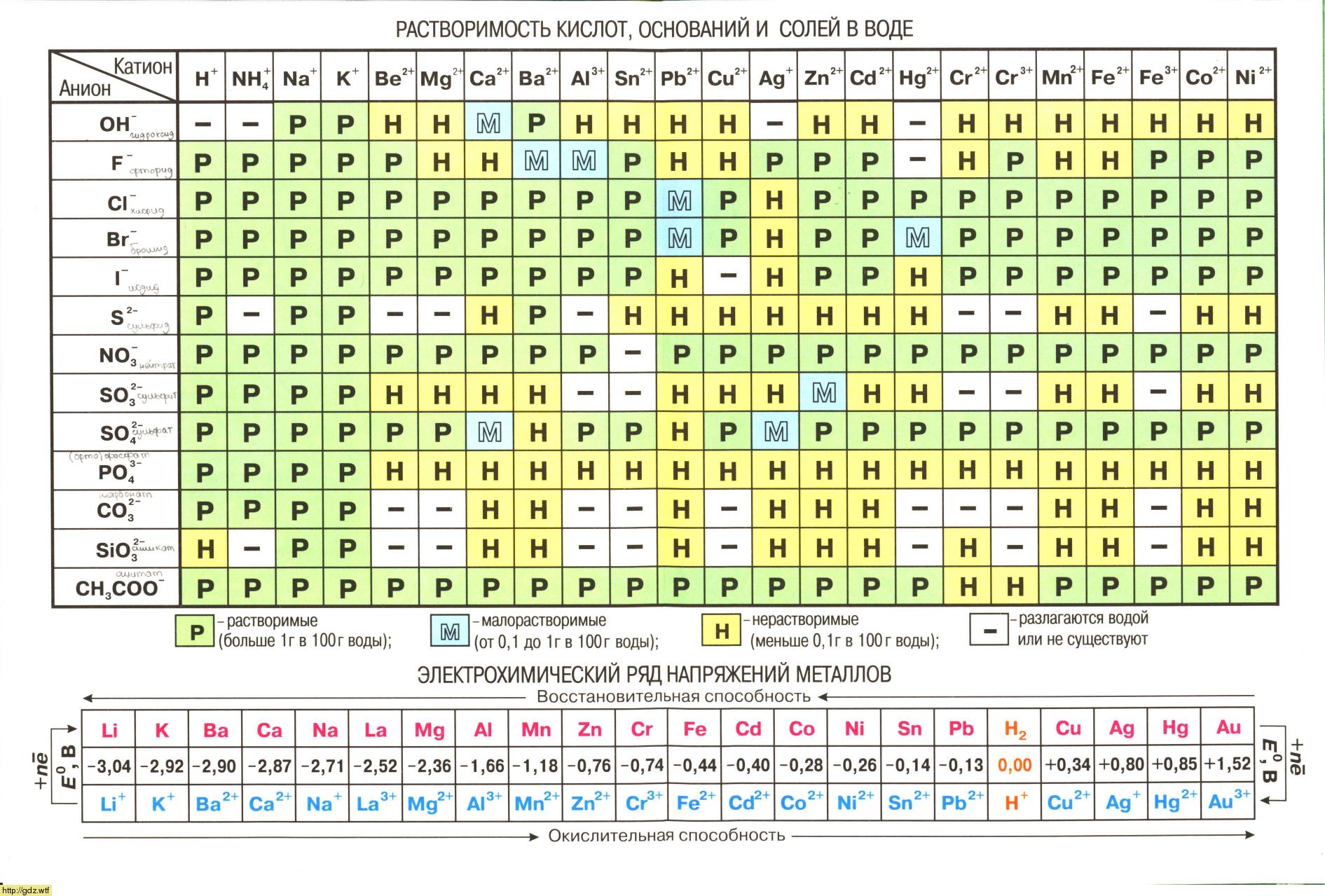
Сколько 9-процентного раствора карбоната калия (K2CO3) и 12-процентного раствора хлорида кальция (CaCl2) (в граммах) потребуется для получения 30 грамм карбоната кальция (CaCO3)?
Решение задачи
Запишем уравнение реакции образования карбоната кальция (CaCO3) при смешении раствора карбоната калия (K2CO3) и раствора хлорида кальция (CaCl2):
![]()
- Учитывая, что молярные массы карбоната калия (K2CO3), хлорида кальция (CaCl2) и карбоната кальция (CaCO3) соответственно равны 138, 111 и 100 г/моль (смотри таблицу Менделеева), вычислим массы данных веществ по формуле, учитывая количество моль из уравнения реакции:
- Получаем:
- m (K2CO3) = 1 моль ∙ 138 г/моль = 138 (г),
- m (CaCl2) = 1 моль ∙ 111 г/моль = 111 (г),
- m (CaCO3) = 1 моль ∙ 100 г/моль = 100 (г).
- Вычислим, сколько карбоната калия (K2CO3) и хлорида кальция (CaCl2) (в граммах) необходимо взять для получения 30 г карбоната кальция (CaCO3):

- для получения 100 г карбоната кальция потребуется 138 г карбоната калия
- для получения 30 г карбоната кальция потребуется х г карбоната калия
- Откуда:
![]()
- для получения 100 г карбоната кальция потребуется 111 г хлорида кальция
- для получения 30 г карбоната кальция потребуется y г хлорида кальция
- Откуда:
![]()
Найдем массу 9-процентного раствора карбоната калия (K2CO3), содержащего 41,4 г карбоната калия (K2CO3) по формуле:

- m (раствора) = 41,4 / 0,09 = 460 (г).
- Если раствор карбоната калия 9-процентный, то массовая доля карбоната калия (K2CO3) в нем 0,09.
- Найдем массу 12-процентного раствора хлорида кальция (CaCl2), содержащего 33,3 г хлорида кальция (CaCl2) по формуле:

m (раствора) = 33,3 / 0,12 = 277,5 (г).
Если раствор хлорида кальция 12-процентный, то массовая доля хлорида кальция (CaCl2)в нем 0,12.
Ответ:
масса раствора карбоната калия равна 460 грамм;
масса раствора хлорида кальция равна 277,5 грамм.
Источник: https://himik.pro/rastvory/rastvor-karbonata-kaliya
Оксид калия: формула, взаимодействие :
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения.
Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция.
Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.

Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
- Температура плавления данного вещества равняется 740 градусам Цельсия.
- Плотность составляет 2,32 г/см3.
- При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
- Растворим в органических растворителях.
- В воде не растворяется, а вступает в реакцию с ней.
- Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
- В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
- Уравнение такой реакции выглядит следующим образом:
- Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.

- Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
- Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
- Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
- Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
- Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.

Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
- К2О + H2SO4 = K2SO4 + Н2О
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
- 2К2О + 4HNO3 = 4KNO3 + 2Н2О
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.

К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений.
Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента.
Кроме того, оно применяется в химической промышленности для получения других соединений калия.
Источник: https://www.syl.ru/article/229823/new_oksid-kaliya-formula-vzaimodeystvie
Калий
| Атомный номер | 19 |
| Внешний вид простого вещества |  |
| Атомная масса (молярная масса) | 39,0983 а. е. м. (г/моль) |
| Радиус атома | 235 пм |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 4s1 |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность (по Полингу) | 0,82 |
| Электродный потенциал | −2,92 В |
| Степени окисления | 1 |
| Плотность | 0,856 г/см³ |
| Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| Теплопроводность | 79,0 Вт/(м·K) |
| Температура плавления | 336,8 K |
| Теплота плавления | 102,5 кДж/моль |
| Температура кипения | 1047 K |
| Теплота испарения | 2,33 кДж/моль |
| Молярный объём | 45,3 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,332 Å |
| Отношение c/a | — |
| Температура Дебая | 100 K |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках).
В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей.
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %).
При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор: K+ + e− → K 2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: 4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH.
Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли.
В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
![]()
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
![]()
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
![]()
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия.
Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
- В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
- Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
- Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.

Электронная оболочка
Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт).
В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия Щелочные металлы Натрий, по химическим свойствам очень схожий с калием
Источник: http://himsnab-spb.ru/article/ps/k
Калий. Свойства калия. Применение калия
0,12 грамма убивают человека за 5 часов. Так действует цианистый калий. Один из самых сильны ядов – это соль циановодородной кислоты. Ее еще называют синильной. В состав вещества входит 19-ый элемент таблицы Менделеева. Однако, чистый калий – благо для организма, а не его убийца.
Даже ребенку в день требуется минимум 600 миллиграммов элемента. Иначе, нарушается работа мускулатуры, в том числе и сердечной. Возникают судороги, может развиться невралгия.
Восполнить дефицит удается, употребляя курагу, морепродукты, орехи, цитрусовые, бананы. Подвигайте эти продукты поближе и продолжайте знакомство с элементом №19.
Химические и физические свойства калия
Название элементу дало одно из его соединений, известное с древности, — карбонат калия. Арабы именовали его «аль-кали» и использовали при стирке одежды. Реагируя с водой, соли калия «рождают» щелочную среду. В ней очищают ткани и поныне.
С веками карбонату нашли и иное применение. Вещество стало пищевым стабилизатором. Как выполняет эту роль калий? Вода и масло, к примеру, не смешиваются. Но, в присутствии карбоната получить однородный состав, все же, удается. На упаковке будет отмечено «Е501».
У калия масса соединений. 19-ый элемент включен в первую группу периодической системы, а в ней лишь щелочные металлы. Все они имеют на внешнем электронном уровне лишь 1 электрон.
Это делает элементы активными восстановителями. Электронная формула калия четырехслойная. Поэтому, металл находится в 4-ом периоде таблицы Менделеева. То есть, внешний электрон удален от ядра и легко отсоединяется, замещается.
В чистом виде калий – вещество твердое и, при этом, легкое. Плотность элемента равна лишь 0,06 грамма на кубический сантиметр. Невелика и атомная масса – 39, 098 граммов на моль. Кстати, в калии только и есть, что атомы. Именно они формируют кристаллическу решетку. Молекул простое вещество не формирует.

Масса калия невелика, как и большинство показателей металла. Он даже твердостью похвастаться не может, хоть агрегатное состояние вещества в обычных условиях и таково. По шкале Мооса элементу дают меньше 1-го балла.
Калий без труда режется ножом, словно это не металл, а сыр. Не сложно и расплавить вещество. Достаточно нагрева до 63,5 градусов. Добиться кипения сложнее, нужен показатель 700 по шкале Цельсия.
Будучи металлом, элемент имеет характерный блеск. Цвет вещества серебристо-белый, с сероватым отливом. Если рядом вода, любоваться слитками лучше на расстоянии.
Погружаясь в жидкость, калий взрывается. Легко металл реагирует и с кислородом, моментально окисляясь. Особых условий для этого не надо. Требуется лишь атмосфера и калий.
Какой итог реакции металла с кислородом? Образуется оксид 19-го элемента. Образуется и пламя. Загораясь на воздухе, калий вспыхивает фиолетовым. Реакция является одним из способов идентификации щелочного металла.
Кислород – один из галогенов, то есть элементов 17-ой группы таблицы Менделеева. Калий легко реагирует с каждым из них по принципу присоединения. Вещества объединяются в одно. Так получаются хлорид калия, йодит, бромид, фторид и не только. Присоединение всегда происходит при повышенных температурах.
Во взаимодействие 19-ый элемент вступает и с некоторыми сложными веществами. Это не только вода. Реагировать с металлом может и любая кислота. Калий вытесняет из вещества атомы гидрогена. Так, от смешивания с соляной кислотой «рождается» водород и хлорид. Реакция проходит в обычных условиях.
Взаимодействие с оксидами возможно лишь при повышенных температурах. Большинство реакций протекают по схеме обмена. Здесь-то и проявляются восстановительные свойства калия. Реакция с оксидом купрума, к примеру, дает оксид уже 19-го элемента и чистый купрум.
По принципу восстановления проходит, так же, взаимодействие с солями. Если в них включены менее активные с химической точки зрения элементы, калий замещает их атомы. В итоге, добываются чистые металлы. Так, соединение с хлоридом алюминия дает алюминий уже в чистом виде.

С гидроксидами металлов реакции происходят лишь в том случае, если они располагаются правее калия в ряду электрохимической активности. Возьмем для примера барий, точнее, его гидроксид. Союз с 19-ым элементом гарантирует наличие уже гидроксида калия. Барий освободится.
Применение калия
Калий нужен не только организму людей, но их промышленности. Цианид металла закупают золотодобытчики. Реагент помогает им извлекать драгоценные элементы из руды. Облегчается получение не только золота, но и серебра.
В сфере нефтедобычи пригождается формиат металла. Он служит жидкостью для добуривания скважин, то есть, используется раствор калия. Фтористый металл применяется в металлургии в качестве флюса. Так промышленники называют добавки, снижающие температуру плавления. Флюсы, так же, облегчают отделение от металла пустой породы, шлаков.
На атомных станциях присутствует тетрафторобромат калия. Без него не получить гексафторид урана. Он является стадией отделения урана от примесей редкоземельных элементов. С помощью калия получают, так же, фториды вольфрама, рения и молибдена Без них атомная промышленность не обходится.
В стекольной промышленности нашел место углекислый калий. Небольшие добавки вещества улучшают оптические свойства продукции. Углекислая форма металла идет и на мыловарение. В пиротехнических изделиях содержится хлорат 19-го элемента, а в бытовой химии – фосфат.

Сульфат калия – популярное удобрение для растений. Вообще, примерно 90% добываемых солей 19-го металла идут именно на производство подкормок. Они ускоряют рост культур, увеличивают урожайность, провоцируют пышное цветение. Так, вместо сульфата можно выбрать нитрат калия. Кроме удобрения он котируется, как пищевая добавка, усилитель вкуса.
Элемент не упустили и поля зрения медики. Оротат калия – лекарство, применяемое при заболеваниях желчных путей и печени. Перманганат калия – антисептик. Калий-магний – дуэт, включенный в «Панангин». Он восполняет дефицит обоих элементов.
Лучше всего металлы усваиваются в паре. Если соединить в препарате натрий и калий, можно отладить в организме проведение нервных импульсов. Так что, сфер применения 19-го элемента масса. На руку человечеству то, что калий не является редкостью.
Добыча калия
В природе наиболее часто встречаются соли калия. Больше всего их в России, на Урале. Не зря один из городов региона назван Соликамском. Крупные месторождения разрабатываются и в Белоруссии. Третьи по величине запасы калия в мире обнаружены 10 лет назад в Бразилии.
Если нужно выделить чистый металл, ископаемые смешивают с жидким натрием. Работает и электролиз хлорида калия. Ток проводят в его смеси с карбонатом 19-го элемента при температуре около 800-от градусов Цельсия.
После реакции калий требует очистки. Помогает вакуумная дистилляция. Порой, электролизу подвергают гидроксид калия. Метод не распространен. Трудно соблюсти технику безопасности. Не устраивает промышленников и выход по току.
Цена калия
На биржах цветных металлов за 19-ый элемент просят не менее 1 000 долларов США. Это ценник за тонну металла. На соединения калия стоимость разнится. Все зависит от востребованность вещества, объемов поставок. Калиевую селитру, к примеру, продают по 60-75 рублей за килограмм.

Лекарство орорат тоже стоит около 50-ти рублей. За 100 таблеток йодита калия просят 140-170 рублей. 10-миллимитровая ампула хлорида 19-го элемента обходится покупателям в 30-40 рублей.
Столько же стоит аналогичный объем перманганата. 40-килограммовый мешок удобрения в виде сульфата предлагают за 3 200 – 3 700 рублей. Цены усреднены. В разных регионах и у разных поставщиков они отличаются. Нередко запросы продавцов зависят от объемов поставок. Оптовикам обещают скидки.
Источник: https://tvoi-uvelirr.ru/kalij-svojstva-kaliya-primenenie-kaliya/
Калий (K, Kalium)
Калий был открыт осенью 1807 года английским химиком Дэви при электролизе твёрдого едкого кали.
Увлажнив едкий кали, ученый выделил металл, которому дал название потассий, намекая на производство поташа (необходимого ингредиента для изготовления моющих средств) из золы.
Своё привычное название металл получил через два года, в 1809г, инициатором переименования вещества стал Л.В. Гильберт, предложивший название калий (от арабского аль-кали – поташ).

Общая характеристика калия
Калий (лат. Kalium) является мягким щелочным металлом, элементом главной подгруппы I группы, IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 19 и обозначение – К.
Нахождение в природе
Калий в свободном состоянии в природе не встречается, он входит в состав всех клеток. Достаточно распространённый металл, занимает 7-е место по содержанию в земной коре (calorizator). Основными поставщиками калия являются Канада, Белоруссия и Россия, имеющие крупные месторождения данного вещества.
Физические и химические свойства
Калий – легкоплавкий металл серебристо-белого цвета. Имеет свойство окрашивать открытый огонь в яркий фиолетово-розовый цвет.
Калий имеет высокую химическую активность, это сильный восстановитель. При реакции с водой происходит взрыв, при длительном нахождении на воздухе полностью разрушается. Поэтому калий требует определённых условий для хранения – его заливают слоем керосина, силикона или бензина, для исключения вредных для металла контактов с водой и атмосферой.
Продукты питания богатые калием
Основными пищевыми источниками калия являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград, все зелёные овощи с листьями, листья мяты, семечки подсолнуха. Калия достаточно много в рыбе и молочных продуктах. Вообще, калий входит в состав почти всех растений. Яблочный уксус и мёд – чемпионы по содержанию калия.

Суточная потребность в калии
Суточная потребность организма человека в калии зависит от возраста, физического состояния и даже места проживания. Взрослым здоровым людям нужно 2,5г калия, беременным женщинам – 3,5г, спортсменам – до 5-ти грамм калия ежедневно. Количество необходимого калия для подростков рассчитывается по весу – 20 мг калия на 1 кг массы тела.
Полезные свойства калия и его влияние на организм
Калий вместе с натрием регулирует водный баланс в организме и нормализует ритм сердца, поддерживает концентрацию и физиологические функций магния.
Калий участвует в процессе проведения нервных импульсов и передачи их на иннервируемые органы. Способствует лучшей деятельности головного мозга, улучшая снабжение его кислородом.
Оказывает положительное влияние при многих аллергических состояниях. Калий необходим для осуществления сокращений скелетных мышц.
Калий регулирует содержание в организме солей, щелочей и кислот, чем способствует уменьшению отёков.
Калий содержится во всех внутриклеточных жидкостях, он необходим для нормальной жизнедеятельности мягких тканей (мышц, сосудов и капилляров, желез внутренней секреции и т.д.)
Усвояемость калия
Калий всасывается в организм из кишечника, куда поступает с пищей, выводится с мочой обычно в таком же количестве. Излишний калий выводится из организма тем же путём, не задерживается и не накапливается. Препятствиями для нормального всасывания калия могут послужить чрезмерное употребление кофе, сахара, алкоголя.
Взаимодействие с другими
Калий работает в тесном контакте с натрием и магнием, при росте концентрации калия из организма стремительно выводится натрий, а уменьшение количества магния может нарушить усвоение калия.

Признаки нехватки калия
Нехватка калия в организме характеризуется мышечной слабостью, быстрой утомляемостью, снижением иммунитета, сбоями в работе миокарда, нарушениями показателей артериального давления, учащённым и затруднённым дыханием.
Кожные покровы могут шелушиться, повреждения плохо заживают, волосы становятся очень сухими и ломкими. Происходят сбои в работе желудочно-кишечного тракта – тошнота, рвота, расстройства желудка вплоть до гастрита и язвы.
Признаки избытка калия
Переизбыток калия наступает при передозировке препаратов, содержащих калий и характеризуется нервно-мышечными расстройствами, повышенной потливостью, возбудимостью, раздражительностью и плаксивостью. Человек постоянно испытывает чувство жажды, которое приводит к частым мочеиспусканиям. Желудочно-кишечный тракт реагирует кишечными коликами, чередованием запоров и поносов.
Применение калия в жизни
Калий в виде основных соединений находит широкое применение в медицине, сельском хозяйстве и промышленности. Калийные удобрения необходимы для нормального роста и вызревания растений, а всем известная марганцовка, это не что иное, как перманганат калия, испытанный временем антисептик.
Источник: http://www.calorizator.ru/element/k
Калий — это… Что такое Калий?
| 19 | Калий |
| [Ar]4s1 |
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках).
В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д.
Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3].
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г. Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[6][7]
Физические свойства
Калий под слоем ТГФ
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет[8].
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат).
При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью.
С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
с халькогенами (100—200 °C, E = S, Se, Te):
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
Взаимодействие со сложными веществами
- Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
- Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
- При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
- При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
- Металлический калий реагирует со спиртами с образованием алкоголятов:
- Алкоголяты щелочных металлов (в данном случае, этаноат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
- При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
- Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Советский изолирующий противогаз ИП-5
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия.
Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
- В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
- Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
- Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
- Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
- Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
Гидроксид
Основная статья: Гидроксид калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Кристаллы перманганата калия
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, батат, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Основная статья: Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.
) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт).
В минералах, содержащих калий, постепенно накапливается калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
- Натрий
- Щелочные металлы
- Банановый эквивалент
Примечания
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST Physical Measurement Laboratory. Архивировано из первоисточника 22 августа 2011. Проверено 16 ноября 2010.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Архивировано из первоисточника 22 августа 2011. Проверено 26 января 2010.
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др.
Источник: https://dic.academic.ru/dic.nsf/ruwiki/6519




