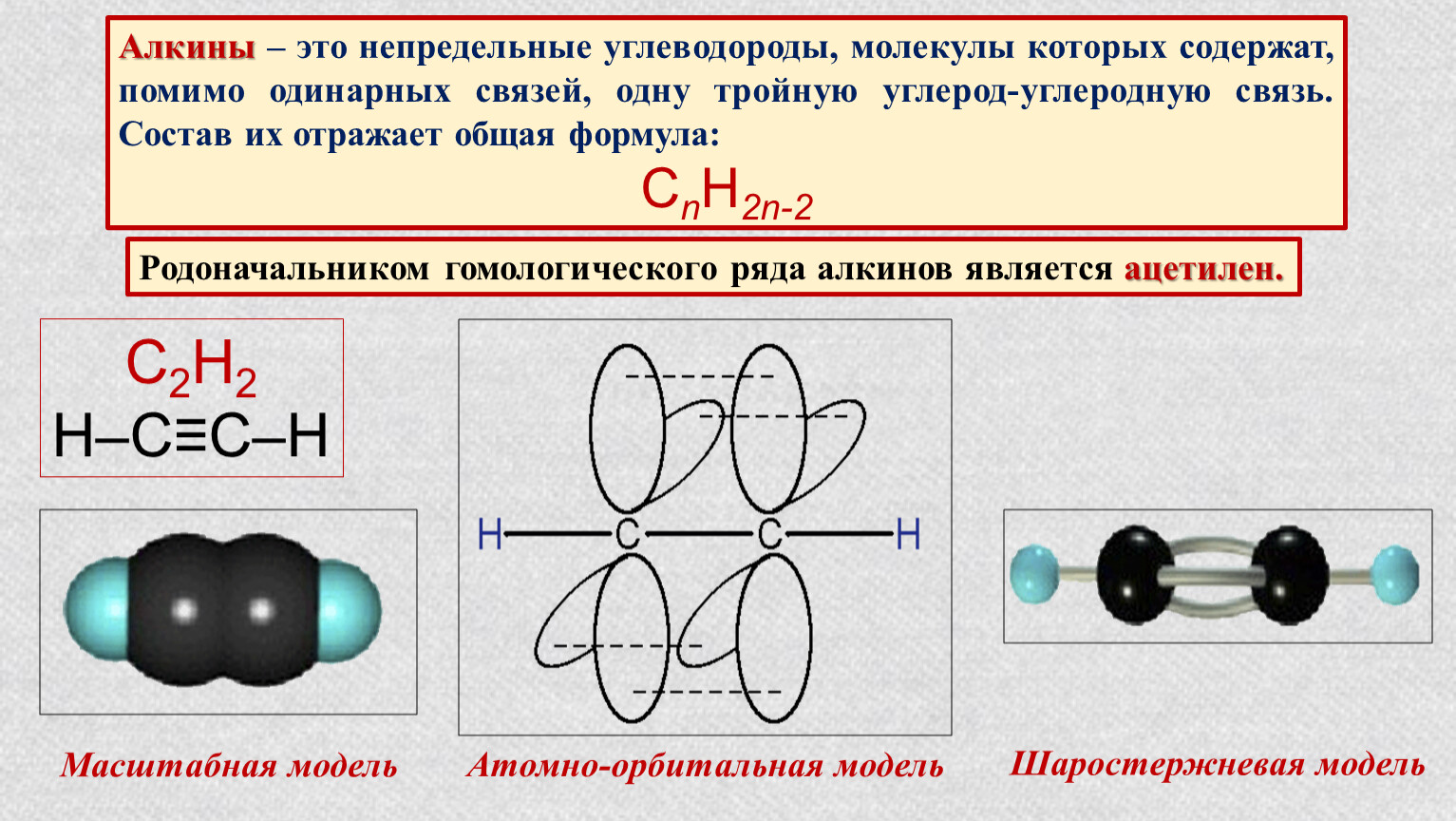
Алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp — гибридизации.
- Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
- структурная формула
- Н — С ≡ С — Н
- или
- электронная формула
- Н:С:::С:Н
- По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной σ — и двух π -связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль.
Номенклатура
Простейшим алкином является этин (ацетилен С2Н2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH-C- называется «этинил».
Гомологический ряд
Этин:C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Изомерия
Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
1. Изомерия углеродного скелета
(такая же как у алканов и алкенов)
2. Изомерия положения кратной связи

Н — С ≡ С — СН2 — СН2 — СН3 пентин-1
Н3С — С ≡ С — СН2 — СН3 пентин-2
3. Межклассовая изомерия:
Алкины являются изомерами с алкадиенами.

Физические свойства алкинов
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
![]()
Плохо растворимы в воде.
Химические свойства
Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Реакции присоединения
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, — в одинарную.

Казалось бы, алкины, обладая двумя π-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния.
Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы).
В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
1. Гидрирование
- Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем — алканы:
- HC ≡ CH + H2 → H2C = CH2 + H2 → H3C—CH3
- ацетилен → этилен → этан
2. Галогенирование
- Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
- HC ≡ CH + Br2 → CHBr = CHBr + Br2 → CHBr2 — CHBr2
- ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
- Качественная реакция; бромная вода обесцвечивается.
3. Гидрогалогенирование
- Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
- HC ≡ CH + HCl → H2C = CHCl → H3C — CHCl2
- ацетилен → хлорэтен → 1,1-дихлорэтан
- Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
4. Гидратация (реакция М.Г.Кучерова,. 1881)
Образуется ацетальдегид в случае С2Н2 и кетоны — в случае гомологов ацетилена.
Катализатор — соль ртути: HgSO4

5. Присоединение синильной кислоты
HC ≡ CH + HCN кат.→ H2C = CH — CN (акрилонитрил)
Акрилонитрил — ценный продукт. Он используется в качестве мономера для получения синтетического волокна — нитрон.
6. Присоединение спирта
В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
HC ≡ CH + HO — C2H5 KOH→ H2C = CH — O — C2H5 (этилвиниловый эфир)
Присоединение спиртов в присутствии алкоголятов — типичная реакция нуклеофильного присоединения.
Реакции замещения
Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена — ацетилениды. Такую способность ацетилена можно объяснить следующим образом.
Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях).
Поэтому электронная плотность связи С-H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H→C≡C←H
Образуются нерастворимые соли — ацетилениды. Возможны только для алкинов, содержащих этинильную группу -С=СН (т. н. терминальные алкины).
- HC ≡ CH + 2CuCl → Cu — C ≡ C — Cu↓ + HCl
- этин → ацетиленид меди(I) двузамещенный
- CH3 — C ≡ CH + CuCl → CH3 — C ≡ C- Cu↓ + HCl
- пропин → метилацетиленид меди (I)
- Образование темно-красных осадков ацетиленидов меди — качественная реакция на этинильную группу, позволяющая отличить терминальные алкины от других непредельных углеводородов.


С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Реакция изомеризации
- Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:
- Н3С — СН2- С ≡ СН Na(спирт р-р)→ Н3С — С ≡ С — СН3
- бутин-1 → бутин-2
Реакции ди-, три- и полимеризации
![]()
Из винилацетилена присоединением HCl получают хлоропрен, при полимеризации которого образуется хлоропреновый каучук:


Циклотримеризация
Полимеризация для алкинов малохарактерна.
Реакции окисления
Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается. Эта реакция является качественной на кратные (двойные и тройные) связи:
3НC ≡ СН + 10KMnO4 + 2H2O → 6CO2 + 10КОН + 10MnO2
3. Горение
- Ацетилен горит коптящим пламенем.
- При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
- 2НС ≡ СН + 5O2 → 4СO2 + 2Н2O
- При неполном сгорании образуется углерод (сажа):
- НС ≡ СН + O2 → С + СО + Н2О
Способы получения
Ацетилен
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
1. Карбидный способ
- Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
- СаО + 3C 2500°C→ CaC2 + CO
- СаС2 + 2Н2O → НС ≡ СН + Са(ОН)2
2. Термическим разложением (крекинг) природного газа — метана:
- 2СН4 1500°C→ НС ≡ СН + 3Н2
- или этана:
- С2Н6 1200°C→ НС ≡ СН + 2Н2
Общие для С2Н2 и его гомологов
Из дигапогеналканов, содержащих атомы галогена у двух соседних атомов углерода, например:
Из дигалогеналканов, содержащих два атома галогена у одного атома углерода, например:
Качественные реакции
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди.
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии.
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применяют:
— для сварки и резки металлов;
— как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды;
— в производстве взрывчатых веществ ацетиленидов (соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод;
Ацетилениды тяжелых металлов обладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются со взрывом.
Наиболее известны как инициирующие взрывчатые вещества (ВВ) ацетилениды серебра Ag2C2 и меди Cu2C2. Также следует отметить сильнейшие взрывчатые способности ацетеленида ртути.
Очень сильными взрывчатыми свойствами обладает ацетеленид золота.
— для получения уксусной кислоты, этилового спирта;
— для получения растворителей — индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов;
— для получения пластических масс — органические материалы, основой которых являются синтетические или природные высокомолекулярные соединения (полимеры). Исключительно широкое применение получили пластмассы на основе синтетических полимеров.
Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять после охлаждения или отвердения заданную форму. Процесс формования сопровождается переходом пластически деформируемого (вязкотекучего) состояния в стеклообразное состояние.
— для получения каучука — натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты.
Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
Источник: http://examchemistry.com/content/lesson/orgveshestva/alkiny.html
Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Органическая химия — это химия углеводородов и их производных.
Основные положения теории строения органических соединений:
- Все атомы, образующие молекулы органического вещества, связаны в определённой последовательности согласно их валентностям.
- Свойства веществ зависят от строения молекул, т. е. свойства и строение взаимосвязаны между собой.
- Зная свойства вещества, можно установить его строение, и наоборот, химическое строение органического соединения может много сказать о его свойствах.
- Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они непосредственно связаны друг с другом.
- Ниже приводятся основные термины, используемые в органической химии.
- Изомерией называют явление существования органических соединений с одинаковым качественным и количественным составом, но с различными свойствами.
- Изомерами называют химические соединения, имеющие одинаковый качественный и количественный состав, но разное химическое строение и разные свойства.
Структурной называют изомерию, вызванную наличием химических соединений с одинаковым составом, но с различным порядком связи структурных элементов. Различают изомерию углеродного скелета, изомерию положения заместителя или кратной связи.
- Геометрическая, или цис-транс-изомерия, — явление существования веществ с различным расположением заместителей относительно двойной связи.
- Геометрическая изомерия возможна как у соединений с двойной связью, так и у алициклических соединений.
- Если одинаковые группы атомов располагаются по разные стороны от плоскости π-связи, то такие соединения называют транс-изомерами, если одинаковые группы атомов располагаются по одну сторону от плоскости -связи, то такие соединения называют цис-изомерами.

Вещества, обладающие сходным химическим строением и химическими свойствами, но отличающиеся между собой на одну или несколько CH2-групп, называют гомологами. Гомологи образуют гомологичные ряды. Свой гомологичный ряд существует для каждого класса органических соединений.
Химическую связь, максимальная электронная плотность которой находится на линии связывания ядер, называют σ-связью. Химическую связь, максимальная электронная плотность которой находится вне линии связывания ядер, называют π-связью.
В молекулах органических веществ атом углерода всегда находится в одном из трёх гибридных состояний с различными типами гибридизации:
sp3-гибридизация. При этой гибридизации происходит смешение одной 2s- и трёх 2p-орбиталей, в результате чего образуются четыре одинаковые sp3-гибридные орбитали. Валентный угол 109° 28′. Атом углерода, находящийся в состоянии sp3, связан с четырьмя другими атомами простыми (одинарными) связями. Все эти связи являются σ-связями.
sp2-гибридизация. При этой гибридизации происходит смешение одной 2s- и двух 2p-орбиталей, в результате чего образуются три одинаковые sp2-гибридные орбитали. Валентный угол 120°. Атом углерода, находящийся в состоянии sp2, связан с каким-либо другим атомом двойной связью, например: >C=CC=O; >C=N–. Одна из двойных связей является σ-связью, другая — π-связью.
sp-гибридизация. При этой гибридизации происходит смешение одной 2s- и одной 2p-орбитали, в результате чего образуются две одинаковые sp-гибридные орбитали. Валентный угол 180°. Атом углерода, находящийся в состоянии sp, связан с каким-либо другим атомом тройной связью, например: –C≡C–; –C≡N. Одна из тройных связей является σ-связью, две другие — π-связями.
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Родоначальником класса предельных углеводородов является метан, CH4. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –162 °С, а температура плавления — –182 °С. Метан широко распространён в природе. Он образуется в результате разложения без доступа воздуха остатков животных и растительных организмов.
Метан — основной компонент природного газа, кроме того, его получают в качестве попутного газа при нефтедобыче.
Метан, как и другие представители предельных углеводородов, достаточно устойчивы химически. Они не взаимодействуют ни со щелочами, ни с кислотами (за исключением азотной), не реагируют с активными металлами.
Для метана прежде всего характерны реакции замещения, которые протекают по радикальному механизму. Этот механизм химической реакции подробнее изучают в курсе органической химии.
Взаимодействие метана с хлором протекает на свету или при температуре 300 °С. Иногда этот процесс может сопровождаться взрывом. При этом происходит последовательное замещение атомов водорода на хлор. В зависимости от соотношения в качестве основного продукта реакции могут образовываться различные хлорпроизводные:


При сгорании метана в кислороде или на воздухе выделяется углекислый газ, вода и значительное количество тепла:
![]()
Именно поэтому его используют в качестве дешёвого топлива.
Термическое разложение метана протекает по различным направления в зависимости от температуры:

При температуре около 800 °С в присутствии никелевого катализатора метан вступает во взаимодействие с водяными парами с образованием так называемого синтез-газа:
![]()
В дальнейшем из синтез-газа получают многочисленные продукты органического синтеза.
Этан — ближайший гомолог метана. Его брутто-формула C2H6, структурная формула H3C–CH3. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –89 °С, а температура плавления –183 °С. Этан широко распространен в природе. В составе попутного газа встречается до 10—15% этана.
Так же, как и метан, этан вступает в реакции замещения:

На воздухе этан горит слабо светящимся пламенем:
![]()
Реакция дегидрирования, т. е. отщепление водорода, приводит к этилену:
![]()
Этан используют как исходное сырье для получения этилена, каучуков и т. д.
Этилен, брутто-формула C2H4, структурная формула H2C=CH2, представляет собой бесцветный газ, малорастворимый в воде. Его температура кипения равна –103,7 °С, а температура плавления –169,1 °С.
Этилен в промышленности получают из этана или метана. Эти реакции были описаны выше. В лабораторной практике этилен получают с помощью реакции дегидратации (отщепления воды) от этилового спирта.
Одновременно катализатором этого процесса и водоотнимающим средством является концентрированная серная кислота:
- Для этилена характерны реакции присоединения. Он легко обесцвечивает раствор брома в воде или четырёххлористом углероде, присоединяет водород (реакция гидрирования), бромоводород (реакция гидробромирования) и воду (реакция гидратации):
Этилен широко применяют для синтеза различных органических веществ: этилового спирта, стирола, галогенпроизводных, полиэтилена, окиси этилена и т. д.
Ацетилен (этин), брутто-формула C2H2, структурная формула HC=CH, представляет собой бесцветный газ, немного растворимый в воде. Его температура кипения равна –83,8 °С.
- Ацетилен в промышленности получают из метана (реакция описана выше) или этана. В лабораторной практике ацетилен получают с помощью реакции карбида кальция с водой или кислотами:
- Для ацетилена прежде всего характерны реакции присоединения.
- В присутствии катализаторов он легко присоединяет водород, образуя вначале этилен, а потом этан:
- Ацетилен обесцвечивает раствор брома в воде или четырёххлористом углероде. При этом происходит последовательное присоединение брома по кратным связям:
- Присоединение хлороводорода вначале приведет к образованию хлористого винила, а затем 1,1-дихлорэтана:
Ацетилен реагирует с водой с образованием уксусного альдегида (реакция Кучерова). Катализатором в данном процессе выступают соли ртути.
- При сгорании ацетилена в кислороде развивается очень высокая температура, поэтому ацетилен-кислородное пламя используют для сварки и резки металлов:
Ацетилен имеет огромное значение как исходное вещество в органическом синтезе. Из ацетилена получают уксусный альдегид, который далее перерабатывают в уксусную кислоту и её различные эфиры; винилацетилен, перерабатываемый в хлоропрен и хлоропреновые каучуки; хлорвинил и поливинилхлорид; дихлорэтан, глицерин, винилацетат, поливинилацетатный клей.
Тренировочные задания
- 1. Для метана верны следующие утверждения:
- 1) его молекула образована атомом углерода в sp-гибридном состоянии 2) это низкокипящая жидкость, хорошо растворимая в воде 3) это низкокипящий газ, плохо растворимый в воде 4) является основным компонентом природного газа
- 5) легко реагирует с разбавленной серной кислотой
- 2. Для метана верны следующие утверждения:
- 1) его молекула образована атомом углерода в состоянии sp2-гибридизации 2) метан реагирует с парами разбавленной азотной кислоты 3) метан обладает характерным неприятным запахом 4) сгорает на воздухе с образованием угарного газа и воды
- 5) сгорает на воздухе с образованием углекислого газа и воды.
- 3. Для этана верны следующие утверждения:
- 1) это бесцветный газ, немного легче воздуха 2) это бесцветный газ, немного тяжелее воздуха 3) при его взаимодействии с водой образуется этиловый спирт 4) при его дегидрировании образуется этилен
- 5) все атомы углерода в нём — третичные
- 4. Для этана верны следующие утверждения:
- 1) оба атома углерода в его молекуле являются первичными 2) не реагирует с гидроксидом натрия 3) реагирует с серной кислотой 4) реагирует с метаном
- 5) обладает резким неприятным запахом
- 5. Для этилена верны следующие утверждения:
- 1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации 2) плотность паров этилена равна плотности паров азота 3) не реагирует с водой 4) не сгорает в кислороде
- 5) не присоединяет хлор
- 6. Для этилена верны следующие утверждения:
- 1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде 2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации 3) взаимодействует с водой с образованием уксусной кислоты 4) взаимодействует с бромной водой с образованием 1,2-дибромэтана
- 5) взаимодействует с водой с образованием этилового спирта
- 7. Для ацетилена верны следующие утверждения:
- 1) при нормальных условиях это газ, пары которого легче воздуха 2) при нормальных условиях это газ, пары которого тяжелее воздуха 3) не реагирует с бромом 4) реагирует с водой с образованием этанола
- 5) реагирует с водой с образованием уксусного альдегида
- 8. Для ацетилена верны следующие утверждения:
- 1) атомы углерода в его молекуле находятся в состоянии sp2-гибридизации и соединены двойной связью 2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации 3) при его сгорании в кислороде образуется угарный газ и вода 4) при его сгорании в кислороде образуется углекислый газ и вода
- 5) реагирует с азотом
Ответы
Источник: https://himi4ka.ru/ogje-2018-po-himii/urok-20-uglevodorody-predelnye-i-nepredelnye-metan-jetan-jetilen-acetilen.html
Х и м и я

Непредельные углеводороды – это соединения, молекулы которых содержат кратные связи (двойные, тройные).
Они отличаются по степени непредельности, т.е. по количеству кратных связей и по их характеру.
Алкены.
Алкены. – это непредельные углеводороды, молекула которых содежит одну двойную связь.
Простейший непредельный углеводород с двойной связью – этилен С2Н4.

Этилен является родоначальником ряда алкенов. Состав любого углеводорода этого ряда выражает общая формула СnН2n (где n – число атомов углерода).
- C2H4 — Этилен,
- C3H6 — Пропилен,
- C4H8 — Бутилен,
- C5H10 — Амилен,
- C6H12 — Гексилен
. . . . . . . . . . . . . .
C10H20 — Децилен и т.д.
Или в структурном виде:
Как видно из структурных схем, помимо двойной связи, молекулы алкенов могут содержать простые связи.
Алкины.
Алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода.
Родоначальником ряда алкинов является этин (или ацетилен) С2Н2.

- Алкины образуют гомологический ряд с общей формулой CnH2n-2.
- Названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
- Гомологический ряд алкинов:
- Этин — C2H2,
Пропин — C3H4, Бутин — C4H6, Пентин — C5H8 и пр.
В природе алкины практически не встречаются. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
Алкадиены.
- Алкадиены (или просто диены) — это непредельные углеводороды, молекулы которых, содежат две двойных связи.
- Общая формула алкадиенов СnН2n-2 (формула совпадает с формулой ряда алкинов).
- В зависимости от взаимного расположения двойных связей диены подразделяются на три группы:
- Алкадиены с кумулированными двойными связями (1,2-диены). Это алкадиены, в молекулах которых двойные связи не разделены одинарными. Такие алкадиены называют аленами по названию первого члена их ряда.
- Сопряженные алкадиены (1,3-диены). В молекулах сопряжённых алкадиенов двойные связи разделены одной одинарной.
- Изолированные алкадиены В молекулах изолированных алкадиенов, двойные связи разделены несколькими одинарными (двумя и более).
![]()
Эти три вида алкадиенов существенно отличаются друг от друга по строению и свойствам.
Важнейшие представители сопряженных диенов бутадиен 1,3 и изопрен.

Молекула изопрена лежит в основе строения многих веществ растительного происхождения: натурального каучука, эфирных масел, растительных пигментов (каротиноидов) и пр.
Свойства непредельных углеводородов.
По химическим свойствам непредельные углеводороды резко отличаются от предельных. Они исключительно реакционноспособны и вступают в разнообразные реакции присоединения. Такие реакции происходят путём присоединения атомов или групп атомов к атомам углерода, связанным двойной или тройной связью. При этом кратные связи довольно легко разрываются и превращаются в простые.
Важным свойством непредельных углеводородов является способность их молекул соединяться друг с другом или с молекулами других непредельных углеводородов. В результате таких процессов образуются полимеры.
Источник: http://xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai/views/alchemy/theory/chemistry/organic-chemistry/ansaturated_hydrocarbons.php
Непредельные углеводороды.Ацетилен
- МБОУ СОШ №20
- Реферат
- на тему «Ацетилен»
- Выполнил:
- Ученик 10 «а» класса
Васильев П.С.
- Проверил:
- учитель химии
- Иван Августович Штрекер
- 2017
- СОДЕРЖАНИЕ:
- История открытия.
- Физические характеристики.
- Структурная формула ацетилена.
- Характеристика класса органических соединений Ацетилена.
- Реакции получения ацетилена.
- Характерные химические реакции ацетилена.
- Области применения ацетилена.
- Безопасность
ИСТОРИЯ ОТКРЫТИЯ
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом.
Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом.
Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку.
В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами.
Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения.
В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода.
Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3.
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
СТРУКТУРНАЯ ФОРМУЛА АЦЕТИЛЕНА

ХАРАКТЕРИСТИКА КЛАССА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ АЦЕТИЛЕНА
Ацетилен принадлежит к классу алкинов.
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения.
Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода.
Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
- ацетилен реакция соединение формула
- РЕАКЦИИ ПОЛУЧЕНИЯ АЦЕТИЛЕНА
- В лаборатории ацетилен получают действием воды на карбид кальция
- CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
- а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
- 2СН4 = С2Н2↑ +3Н2↑
- ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЦЕТИЛЕНА
- Основные химические реакции ацетилена (реакции присоединения):

Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации).

- ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
- Ацетилен используют:
- — для сварки и резки металлов,
- — как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- — в производстве взрывчатых веществ (см. ацетилениды),
- — для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов,
- — для получения технического углерода,
- — в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
- — в ракетных двигателях (вместе с аммиаком).
- Безопасность
Источник: https://multiurok.ru/index.php/files/niepriediel-nyie-ughlievodorody-atsietilien.html
Читать
Алена Игоревна Титаренко
Шпаргалка по органической химии
1. Предмет органической химии
Органические вещества в своем составе наряду с другими элементами всегда содержат углерод. Изучение соединений углерода – их строения, химических превращений – и составляет предмет органической химии.
Вещества органические и неорганические.
Наряду с углеродом в состав органических веществ чаще всего входят водород, кислород и азот, сравнительно реже – сера, фосфор, галогены и другие элементы. Известно несколько миллионов органических соединений, неорганических же веществ значительно меньше. Из всех химических элементов только углерод образует такое большое число органических соединений.
С органическими веществами мы встречаемся на каждом шагу. Они содержатся во всех растительных и животных организмах, входят в состав нашей пищи, служат материалом для изготовления одежды, образуют различные виды топлива, используются нами в качестве лекарств, красителей, средств защиты урожая и т. д.
Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям подобного типа и изучаются обычно в неорганической химии.
С органическими веществами человек знаком с давних времен. Наши далекие предки применяли природные красители для окраски тканей, использовали в качестве продуктов питания растительные масла, животные жиры, тростниковый сахар, получали уксус брожением спиртовых жидкостей.
В настоящее время синтезированы многие органические вещества, не только имеющиеся в природе, но и не встречающиеся в ней: многочисленные пластмассы, различные виды каучуков, всевозможные красители, взрывчатые вещества, лекарственные препараты.
Синтетически полученных веществ сейчас известно даже больше, чем найденных в природе, и число их быстро растет. Осуществляются синтезы самых сложных органических веществ – белков.
- Название науки «органическая химия», утратив первоначальный смысл, приобрело в связи с этим более широкое толкование.
- Можно сказать, что такое название получило и новое подтверждение, так как ведущей познавательной задачей современной органической химии является глубокое изучение процессов, происходящих в клетках организмов на молекулярном уровне, выяснение тех тонких механизмов, которые составляют материальную основу явлений жизни.
- Изучение химии органических веществ, таким образом, расширяет наши знания о природе.
2. Предпосылки теории строения
Подобно тому как в неорганической химии при изучении элементов и их соединений необходимо постоянно руководствоваться периодическим законом и Периодической системой химических элементов Д.И. Менделеева, в органической химии при изучении веществ необходимо опираться на теорию химического строения.
Основные особенности предпосылок химического строения:
1) теория химического строения в своей основе была создана в 60-е гг. XIX в.;
- 2) основная задача органической химии того времени состояла в изучении состава и свойств природных соединений;
- 3) также основная задача состояла в разработке способов рационального использования состава и свойств природных соединений для практических нужд;
- 4) в связи с развитием промышленности, торговли, ростом городов к органической химии стали предъявляться большие требования;
- 5) текстильная промышленность нуждалась в разнообразных красителях;
- 6) для развития пищевой промышленности требовались более совершенные методы переработки сельскохозяйственных продуктов;
- 7) необходимо было решить проблему освещения растущих городов на основе использования природных материалов;
8) нужно было также удовлетворить потребность населения в лекарственных веществах и т. д.
- Дальнейшее развитие органической химии стало замедляться из-за отставания в ней теоретических представлений.
- Новые теоретические воззрения:
- 1) открывшиеся в процессе исследования веществ новые явления требовали систематизации и объяснения их с единой точки зрения, но теория того времени оказывалась для этого недостаточной;
- 2) органическая химия должна была создавать новые вещества, но теоретические знания не могли указать пути их целенаправленного синтеза;
- 3) необходимость новых теоретических воззрений в органической химии становится более понятной, если знать некоторые известные факторы.
- При изучении курса неорганической химии становится известно, что:
- а) углерод образует с водородом большое число соединений, так называемых углеводородов;
- б) в состав горючего природного газа, например, наряду с простейшим углеводородом метаном СН4, входят этан С2Н6, пропан С3Н8, бутан С4H10 и др.;
в) при термическом разложении каменного угля образуется бензол С6Н6, толуол С7Н8 и т. д.;
- г) много различных углеводородов содержится в нефти;
- 4) углерод, который содержится в природном газе, является четырехвалентным элементом, но только в метане он сохраняет эту валентность;
- 5) в этане С2Н6 углерод должен быть трехвалентным, а в пропане С3Н8 иметь даже дробную валентность.
3. Особенности органических соединений
- В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей:
- 1) атомы углерода способны соединяться друг с другом;
- 2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
- 3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом.
- Время, необходимое для завершения реакций между органическими веществами, измеряется часами, а иногда и днями.
- Если ионные (неорганические) соединения легко диссоциируют в воде на ионы и реакции между ними протекают весьма быстро, то органические вещества, содержащие простые (одинарные) С – С и С – Н связи, взаимодействуют между собой с большим трудом.
- При нагревании в пределах 400–600 °C органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль);
- 4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
- 5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
- 6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
- Особенности атома углерода объясняются его строением:
- 1) он имеет четыре валентных электрона;
2) атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
Источник: https://www.litmir.me/br/?b=117984&p=7




