В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
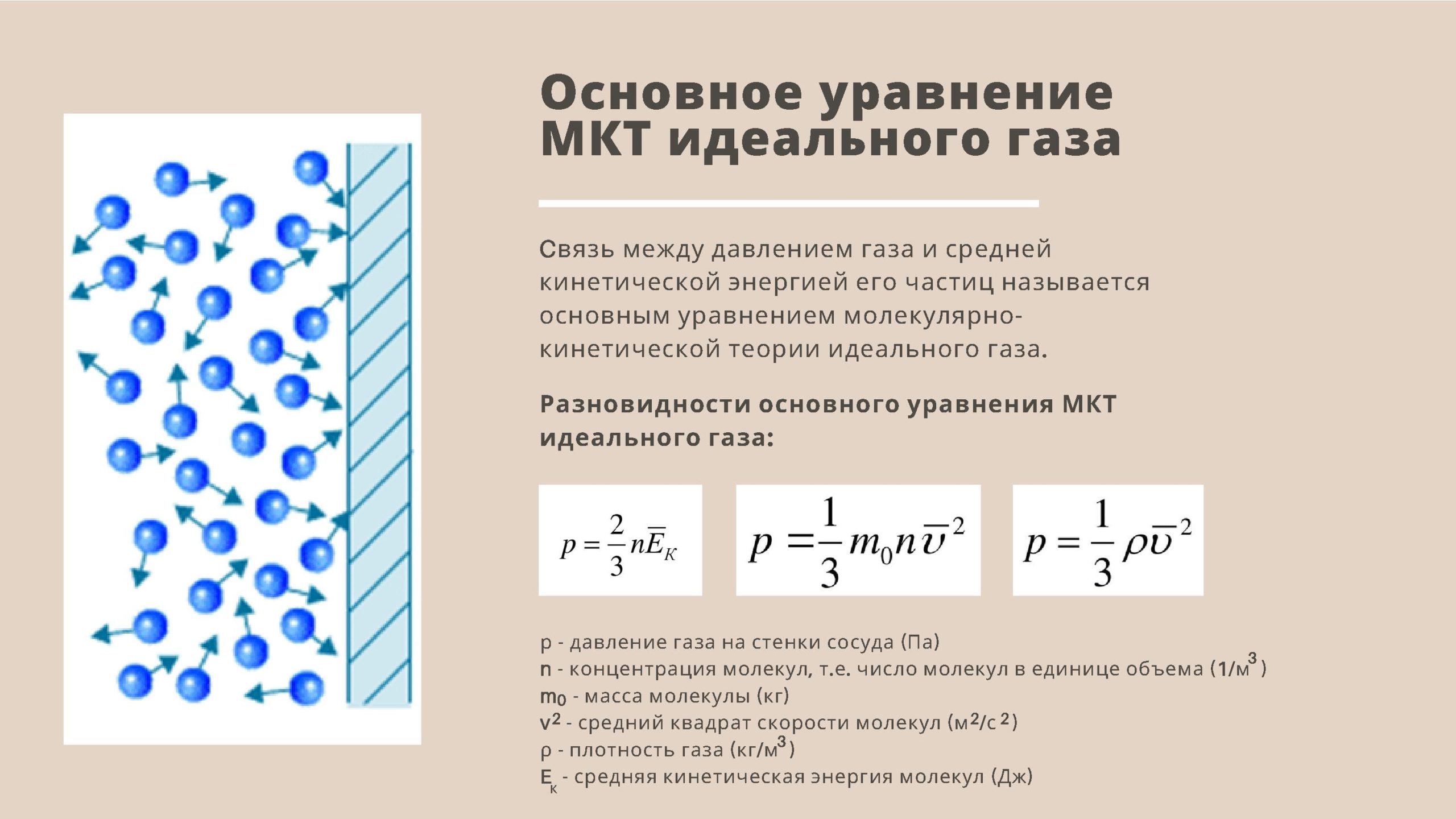
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:

- p – давление молекул газа на границы емкости,
- m0 – масса одной молекулы,
- n — концентрация молекул, число частиц N в единице объема V;
- v2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ

Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
![]()
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:

- S – площадь этой стенки
- n — концентрация частиц
- Давление p равно отношению силы F к площади S, на которую действует эта сила:

Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:

Исходя из вышенаписанного получаем:

Тогда

Если заменить среднее значение кинетической энергии поступательного движения молекул — E:

и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:

Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Источник: https://people-ask.ru/nauki/fizika/osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-mkt-s-vivodom
Основное уравнение МКТ газов. Температура
Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений.
Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур.
Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура).
В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Используя модель идеального газа, вычислим давление газа на стенку сосуда.
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона.
В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной (рис. 3.2.1).
 |
| Рисунок 3.2.1.Упругое столкновение молекулы со стенкой |
Поэтому изменение импульса молекулы будет равно 2m0υx, где m0 – масса молекулы.
Выделим на стенке некоторую площадку S (рис. 3.2.2). За время Δt с этой площадкой столкнутся все молекулы, имеющие проекцию скорости υx, направленную в сторону стенки, и находящиеся в цилиндре с основанием площади S и высотой υxΔt.
 |
| Рисунок 3.2.2.Определение числа столкновений молекул с площадкой S |
Пусть в единице объема сосуда содержатся n молекул; тогда число молекул в объеме цилиндра равно nSυxΔt. Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку S за время Δt равно
- Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0υx, то полное изменение импульса всех молекул, столкнувшихся за время Δt с площадкой S, равно
По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы FΔt, где F – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке S. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку S. Поэтому можно записать:
Разделив обе части на SΔt, получим:
 |
где p – давление газа на стенку сосуда.
При выводе этого соотношения предполагалось, что все n молекул, содержащихся в единице объема газа, имеют одинаковые проекции скоростей на ось X. На самом деле это не так.
В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям.
При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям. Распределение молекул газа по модулю скоростей называется распределением Максвелла.
Джеймс Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из основных положений молекулярно-кинетической теории. На рис. 3.2.3 представлены типичные кривые распределения молекул по скоростям.
По оси абсцисс отложен модуль скорости, а по оси ординат – относительное число молекул, скорости которых лежат в интервале от υ до υ + Δυ. Это число равно площади выделенного на рис. 3.2.3 столбика.
 |
| Рисунок 3.2.3.Распределение молекул по скоростям. T2 > T1 |
- Характерными параметрами распределения Максвелла являются наиболее вероятная скорость υв, соответствующая максимуму кривой распределения, и среднеквадратичная скорость
- где
- – среднее значение квадрата скорости.
- С ростом температуры максимум кривой распределения смещается в сторону больших скоростей, при этом υв и υкв увеличиваются.
 |
| Модель. Распределение Максвелла. |
Чтобы уточнить формулу для давления газа на стенку сосуда, предположим, что все молекулы, содержащиеся в единице объема, разбиты на группы, содержащие n1, n2, n3 и т. д. молекул с проекциями скоростей υx1, υx2, υx3 и т. д. соответственно. При этом
- Каждая группа молекул вносит свой вклад
- в давление газа. В результате соударений со стенкой молекул с различными значениями проекций υxi скоростей возникает суммарное давление
 |
Входящая в это выражение сумма – это сумма квадратов проекций υx всех n молекул в единичном объеме газа. Если эту сумму разделить на n, то мы получим среднее значение квадрата проекции скорости молекул:
 |
Теперь формулу для давления газа можно записать в виде
Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
 |
Последнее равенство вытекает из формулы:

Формула для среднего давления газа на стенку сосуда запишется в виде
Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m0, концентрацией молекул n, средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
- Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
- В основное уравнение молекулярно-кинетической теории газов входит произведение концентрации молекул n на среднюю кинетическую энергию поступательного движения. Если предположить, что газ находится в сосуде неизменного объема V, то
(N – число молекул в сосуде). В этом случае изменение давления Δp пропорционально изменению средней кинетической энергии.
Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема? Какую физическую величину нужно изменить, чтобы изменилась средняя кинетическая энергия Опыт показывает, что такой величиной является температура.
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра.
Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика).
В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными.
Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении.
По температурной шкале Цельсия точке плавления льда приписывается температура 0 °С, а точке кипения воды – 100 °С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0 °С и 100 °С принимается равным 1 °С.
В ряде стран (США) широко используется шкала Фаренгейта (TF), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды равной 212 °F. Следовательно,
Особое место в физике занимают газовые термометры (рис. 3.2.4), в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V = const), а термометрической величиной – давление газа p. Опыт показывает, что давление газа (при V = const) растет с ростом температуры, измеренной по шкале Цельсия.
| Рисунок 3.2.4.Газовый термометр с постоянным объемом |
Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки p0 и p100 на график, а затем провести между ними прямую линию (рис. 3.2.5). Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления.
Экстраполируя график в область низких давлений, можно определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна –273,15 °С и не зависит от свойств газа.
На опыте получить путем охлаждения газ в состоянии с нулевым давлением невозможно, так как при очень низких температурах все газы переходят в жидкое или твердое состояние.
| Рисунок 3.2.5.Зависимость давления газа от температуры при V = const |
Английский физик У. Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например, комнатная температура TС = 20 °С по шкале Кельвина равна TК = 293,15 К.
Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Нет необходимости привязывать шкалу Кельвина к двум фиксированным точкам – точке плавления льда и точке кипения воды при нормальном атмосферном давлении, как это принято в шкале Цельсия.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, достаточно принять еще одну фиксированную опорную точку.
В шкале Кельвина в качестве такой точки используется температура тройной точки воды (0,01 °С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар.
По шкале Кельвина температура тройной точки принимается равной 273,16 К.
Газовые термометры громоздки и неудобны для практического применения: они используются в качестве прецизионного стандарта для калибровки других термометров.
Таким образом, давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре: p ~ T. С другой стороны, опыт показывает, что при неизменных объеме V и температуре T давление газа изменяется прямо пропорционально отношению количества вещества ν в данном сосуде к объему V сосуда
где N – число молекул в сосуде, NА – постоянная Авогадро, n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда). Объединяя эти соотношения пропорциональности, можно записать:
где k – некоторая универсальная для всех газов постоянная величина. Ее называют постоянной Больцмана, в честь австрийского физика Людвига Больцмана, одного из создателей молекулярно-кинетической теории. Постоянная Больцмана – одна из фундаментальных физических констант. Ее численное значение в СИ равно:
Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул.
Следует обратить внимание на то, что средняя кинетическая энергия поступательного движения молекулы не зависит от ее массы. Броуновская частица, взвешенная в жидкости или газе, обладает такой же средней кинетической энергией, как и отдельная молекула, масса которой на много порядков меньше массы броуновской частицы.
Этот вывод распространяется и на случай, когда в сосуде находится смесь химически невзаимодействующих газов, молекулы которых имеют разные массы. В состоянии равновесия молекулы разных газов будут иметь одинаковые средние кинетические энергии теплового движения, определяемые только температурой смеси.
Давление смеси газов на стенки сосуда будет складываться из парциальных давлений каждого газа:
| p = p1 + p2 + p3 + … = (n1 + n2 + n3 + …)kT. |
В этом соотношении n1, n2, n3, … – концентрации молекул различных газов в смеси. Это соотношение выражает на языке молекулярно-кинетической теории экспериментально установленный в начале XIX столетия закон Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений.
| Модель. Полупроницаемая мембрана. |
Источник: https://questions-physics.ru/molekulyarnaya-fizika-i-termodinamika/osnovnoe_uravnenie_mkt_gazov_temperatura.html
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева

Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)

Массу, в свою очередь, можно вычислить, как произведение плотности и объема.

Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:

Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:

Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ

Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:

Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:

Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
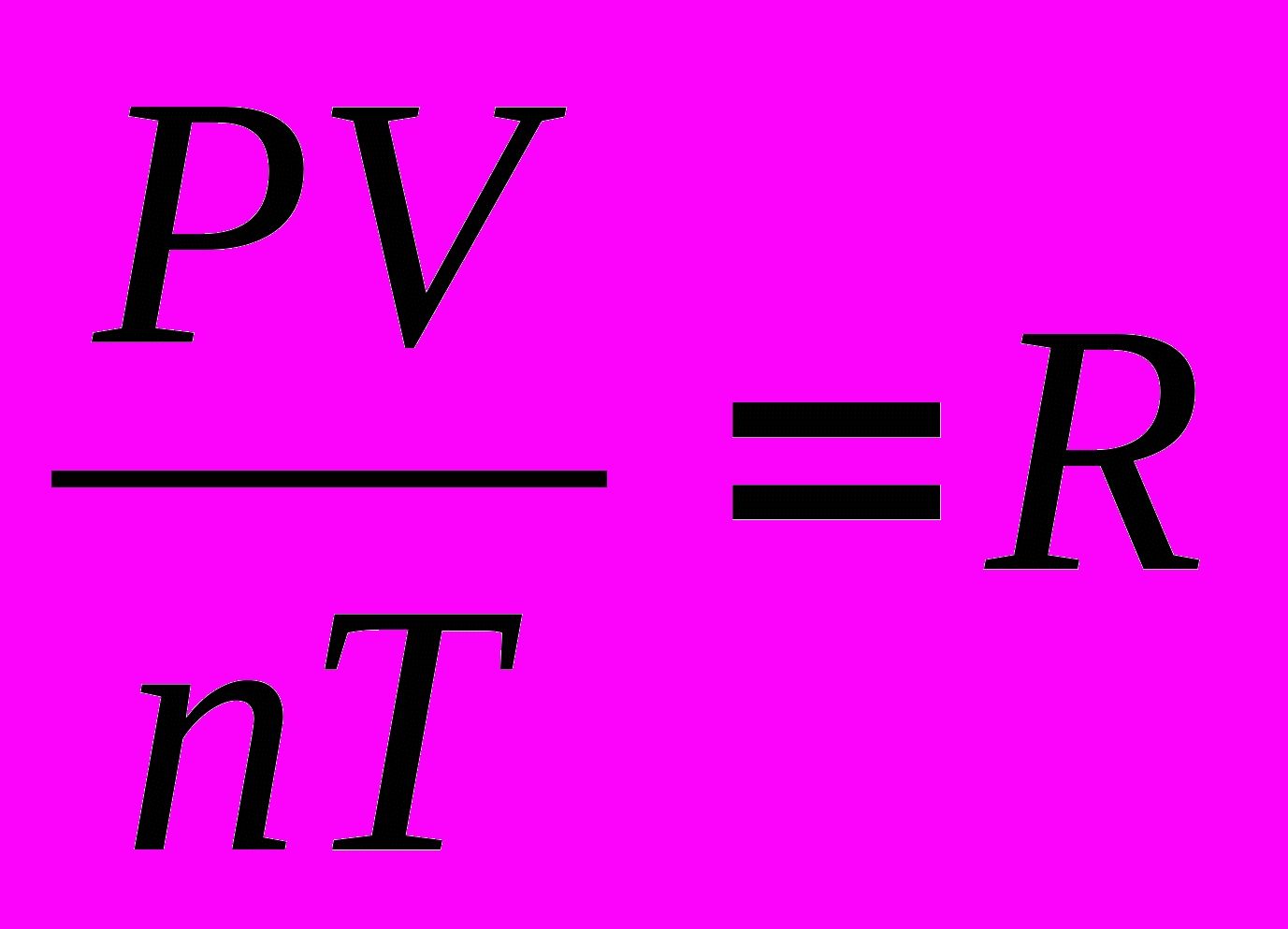
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Внутренняя энергия одноатомного и двухатомного идеального газа
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Источник: https://Zaochnik-com.ru/blog/osnovnye-formuly-termodinamiki-i-molekulyarnoj-fiziki-kotorye-vam-prigodyatsya/
Основное уравнение молекулярно-кинетической теории
Самым простым из всех агрегатных состояний вещества является газообразное. Поэтому изучение свойств веществ и начинают с газов. Интересно, что впервые термин «газ» (а «газ» в переводе с греческого означает ‘хаос’) был введён лишь в начале XVII века нидерландским химиком Яном Баптистом ван Гельмонтом.
На прошлом уроке мы с вами говорили о том, что молекулы газа находятся на значительном расстоянии друг от друга и способны к неограниченному расширению. Даже при редких (в масштабах молекул) столкновениях сил притяжения не хватает, чтобы удержать молекулы друг возле друга.
Сталкиваясь, они разлетаются в разные стороны, подобно бильярдным шарам. Всё это приводит к тому, что средняя кинетическая энергия теплового движения молекул газа намного больше средней потенциальной энергии их взаимодействия. Поэтому часто значением последней мы пренебрегаем.
Это даёт нам право воспользоваться моделью идеального газа.
Итак, идеальный газ — это модель газа, удовлетворяющая следующим условиям: молекулы газа можно считать материальными точками, которые хаотически движутся; силы взаимодействия между молекулами идеального газа практически отсутствуют (они действуют только при столкновении молекул); при столкновениях молекулы идеального газа ведут себя как абсолютно упругие шарики.
При изучении механики мы с вами вводили понятие «механической системы тел» и говорили о том, что состояние любой механической системы определяется её параметрами — координатами, скоростями и импульсами.

В тепловых процессах основными физическими величинами, характеризующими некоторое количество идеального газа как макроскопическую систему, являются давление, объём и абсолютная температура. Эти физические величины называют макроскопическими параметрами состояния газа.
А к микроскопическим параметрам состояния газа относят индивидуальные характеристики молекул: массу отдельной молекулы, её скорость, импульс и кинетическую энергию теплового движения.
Одна из важнейших задач молекулярно-кинетической теории состоит в установлении связи между макроскопическими и микроскопическими параметрами. Найдём эту связь.
Для этого предположим, что у нас есть закрытый сосуд в форме куба, в котором находится идеальный одноатомный газ, находящийся в термодинамическом равновесии (так принято называть состояние, в котором все макроскопические параметры газа остаются неизменными во времени по всему объёму).
Ещё в седьмом классе мы говорили о том, что газ, находящийся в сосуде, будет оказывать давление на его стенки. С точки зрения молекулярно-кинетической теории это давление вызвано ударом молекул газа о стенки сосуда.
Очень слабые силы ударов отдельных молекул складываются для громадного количества молекул в значительную по величине и почти постоянную силу, действующую на тело. Усреднённое по времени значение этой силы, отнесённое к единичной площадке, и есть давление газа.
Итак, пусть молекула идеального газа массой т0 движется перпендикулярно стенке куба с некоторой постоянной скоростью.
В результате абсолютно упругого удара со стенкой сосуда молекула газа передаст участку стенки определённый импульс, а направление скорости молекулы измениться на противоположное.
Тогда проекция изменения её импульса будет равна разности проекций импульсов до и после взаимодействия:
![]()
Для определения давления на стенку куба необходимо вычислить совокупное воздействие молекул на неё за некоторый промежуток времени.

Для этого необходимо умножить изменение импульса одной молекулы на полное число молекул, ударяющихся о стенку за данный промежуток времени:
![]()
Теперь предположим, что в кубе хаотично движется N молекул.
Так как газ у нас находится в термодинамическом равновесии, то из-за беспорядочного движения молекул результат их удара о стенки таков, как если бы треть всех молекул двигалась прямолинейно между правой и левой стенкой, треть — между передней и задней стенкой и треть — между верхней стенкой и нижней. А так как все направления в пространстве равноправны, то число молекул, летящих к выбранной грани куба, составляет шестую часть всех молекул, заключённых в сосуде:
Выберем промежуток времени таким образом, чтобы все молекулы, находящиеся в сосуде, успели хотя бы раз столкнуться с одной из граней куба. При этом время полёта молекулы от одной грани до другой будет определяться отношением длины ребра куба к скорости молекулы:
Тогда суммарное изменение импульса молекул за счёт столкновения с выбранной гранью за время ∆t будет определяться выражением, которое вы видите на экране:
![]()
С другой стороны, мы с вами знаем, что изменение импульса молекул может быть определено и на основании второго закона Ньютона, записанного в импульсной форме:
![]()
- Значение средней силы мы выразим из второго закона Ньютона:
- А время полёта молекулы от одной грани до другой мы с вами нашли ранее. Давайте подставим выражения для промежутка времени и средней силы в формулу давления:
Теперь вспомним, что произведение площади грани на её ребро — это есть объём куба (в нашем случае это объём сосуда, в котором находится газ). А число молекул газа в единице объёма — это концентрация молекул.
Таким образом, мы с вами нашли давление газа для идеального случая. В реальных же условиях молекулы движутся не только хаотически, но и имеют различные скорости, что не было нами учтено. Однако, как показали расчёты, среднее значение модуля этих скоростей имеет вполне определённое значение:
- То же самое будет относиться и к среднему значению квадрата скорости молекул:
- Перепишем формулу для давления газа с учётом этой поправки:
Полученное нами уравнение носит название основного уравнения молекулярно-кинетической теории газов. Оно связывает макроскопическую величину — давление, которое может быть непосредственно измерено с микроскопическими параметрами молекул: массой и скоростью их хаотичного движения.
- А теперь давайте проделаем такую операцию: умножим и разделим на 2 правую часть основного уравнения МКТ
- И поменяем местами сомножители:
- Множитель — это средняя кинетическая энергия поступательного движения молекул.
- Тогда можно записать, что давление идеального газа равно двум третям средней кинетической энергии поступательного движения всех молекул, заключённых в единице объёма:
Это уравнение тоже можно назвать основным уравнением молекулярно-кинетической теории. Но связывает оно уже другие параметры: макропараметр давление со средней кинетической энергией их поступательного движения, являющейся с микроскопической характеристикой.
Эта формула впервые была получена немецким физиком Рудольфом Клаузиусом, и поэтому её часто называют уравнением Клаузиуса.
Для примера решим с вами задачу. Кислород находится под давлением 95 кПа и имеет плотность 2,1 кг/м3. Определите среднюю кинетическую энергию поступательного движения его молекул.
Источник: https://videouroki.net/video/26-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii.html
Молекулярная физика Основные формулы
- m — масса;
- μ — молярная масса вещества;
- N — число молекул;
- NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
- p — давление идеального газа;
- m — масса одной молекулы;
- n = N/V — концентрация молекул;
- V — объем газа;
- N — число молекул;
![]()
1.3 Средняя квадратичная скорость молекул идеального газа
![]()
- k = 1,38·10-23 Дж/К — постоянная Больцмана;
- R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
- T = t+273 — абсолютная температура;
- t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
- n — концентрация молекул;
- k — постоянная Больцмана;
- T — абсолютная температура.
1.6 Закон Бойля-Мариотта
![]()
p — давление;
V — объем газа.
1.7 Закон Шарля
![]()
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
![]()
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
- ν — количество вещества;
- R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
- T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
- при изменении объема на бесконечно малую величину dV
- p — давление газа.
- При изменении объема от V1 до V2
2.3 Первый закон термодинамики
- ΔQ — количество подведенной теплоты;
- ΔA — работа, совершаемая веществом;
- ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
- ΔQ — количество переданной системе теплоты на участке процесса;
- ΔT — изменение температуры на этом участке процесса.
Источник: http://fizikazadachi.ru/molekulyarnaya_fizika/
Идеальный газ. Основное уравнение МКТ. Молекулярная физика — Класс!ная физика
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
- Свойства идеального газа:
- — давление газа на стенки сосуда — за счет ударов молекул газа
- Скорость молекул газа
— взаимодействие между молекулами пренебрежительно мало — расстояние между молекулами много больше размеров молекул — молекулы — это упругие шары — отталкивание молекул возможно только при соударении — движение молекул — по законам Ньютона
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
![]()
- где n — число молекул в газе v — модули скоростей отдельных молекул в газе В теории газов часто используется понятие кинетической энергии молекул.
- Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура). Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
![]()
где р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м3)
— масса молекулы (кг) — средний квадрат скорости молекул (м2/с2) ρ — плотность газа (кг/м3) — средняя кинетическая энергия молекул (Дж)
- Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
- Дополнительные расчетные формулы по теме
- Формула для расчета концентрации молекул:
- где N — число молекул газа
- V — объем газа (м3)
- Формула для расчета плотности газа:
где mo — масса молекулы (кг) n — концентрация молекул (1/м3)
Назад в раздел «10-11 класс»
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. — Взаимодействие молекул. Строение твердых тел, жидкостей и газов. — Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие.
Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
Источник: http://class-fizika.ru/10_27.html
Основное уравнение МКТ в физике
Основное уравнение МКТ наглядно объясняет, каким образом идеальный газ создает давление на окружающие его стенки сосуда. Молекулы все время ударяются о стенку, воздействуя на нее с некоторой силой F.
Тут следует вспомнить третий закон Ньютона: когда молекула ударяется о предмет, на нее действует сила -F, вследствие чего молекула «отбивается» от стенки. При этом мы считаем соударения молекул со стенкой абсолютно упругими: механическая энергия молекул и стенки полностью сохраняется, не переходя во внутреннюю энергию тел.
Это значит, что при соударениях изменяются только скорости молекул, а нагревания молекул и стенки не происходит.

Зная, что соударение со стенкой было упругим, мы можем предсказать, как изменится скорость молекулы после столкновения. Модуль скорости останется таким же, как и до соударения, а направление движения изменится на противоположное относительно оси Ох (считаем, что Ох – это та ось, которая перпендикулярна стенке).
Молекул газа очень много, движутся они хаотично и о стенку ударяются часто. Найдя геометрическую сумму сил, с которой каждая молекула воздействует на стенку, мы узнаём силу давления газа.
Чтобы усреднить скорости молекул, необходимо использовать статистические методы.
Именно поэтому в основном уравнении МКТ используют усредненный квадрат скорости молекул , а не квадрат усредненной скорости : усредненная скорость хаотично движущихся молекул равна нулю, и в этом случае никакого давления мы бы не получили.
Теперь ясен физический смысл уравнения: чем больше молекул содержится в объеме, чем они тяжелее и чем быстрее движутся – тем большее давление они создают на стенки сосуда.
Основное уравнение МКТ для модели идеального газа
Следует заметить, что основное уравнение МКТ выводилось для модели идеального газа с соответствующими допущениями:
- Соударения молекул с окружающими объектами абсолютно упругие. Для реальных же газов это не совсем так; часть кинетической энергии молекул всё-таки переходит во внутреннюю энергию молекул и стенки.
- Силами взаимодействия между молекулами можно пренебречь. Если же реальный газ находится при высоком давлении и сравнительно низкой температуре, эти силы становятся весьма существенными.
- Молекулы считаем материальными точками, пренебрегая их размером. Однако размеры молекул реальных газов влияют на расстояние между самими молекулами и стенкой.
- И, наконец, основное уравнение МКТ рассматривает однородный газ – а в действительности мы часто имеем дело со смесями газов. Как, например, воздух.
Однако для разреженных газов это уравнение дает очень точные результаты. Кроме того, многие реальные газы в условиях комнатной температуры и при давлении, близком к атмосферному, весьма напоминают по свойствам идеальный газ.
Как известно из законов динамики, кинетическая энергия любого тела или частицы . Заменив произведение массы каждой из частичек и квадрата их скорости в записанном нами уравнении, мы можем представить его в виде:
Также кинетическая энергия газовых молекул выражается формулой , что нередко используется в задачах. Здесь k – это постоянная Больцмана, устанавливающая связь между температурой и энергией. k=1,38•10-23 Дж/К.
Основное уравнение МКТ лежит в основе термодинамики. Также оно используется на практике в космонавтике, криогенике и нейтронной физике.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/uravneniya-po-fizike/osnovnoe-uravnenie-mkt/




